无导线起搏器与传统起搏器并发症比较
马娟 范洁,2
(1.昆明理工大学医学院,云南 昆明 650100;2.云南省第一人民医院心血管内科,云南 昆明 650100)
近60年来,心脏起搏已被证明可改善缓慢性心律失常患者的生活质量和预后。并且,随着人口老龄化的日益严重,其治疗的适应证人群逐渐增多[1]。自1958年世界第1例心脏起搏器正式植入人体,起搏器的治疗领域从此开创了新纪元[2]。其后经过60多年的努力,心脏起搏器治疗取得了显著成果,起搏器的材料、工艺、体积、导线和功能等均有了很大的改进。尽管如此,传统经静脉植入起搏器(transvenous pacemaker,TVP)并发症,如囊袋及导线的感染等,对其应用产生了严重的影响。随着对起搏器研究的不断深入,无导线起搏器(leadless cardiac pacemaker,LCP)这一概念于1970年被正式提出,并于2013年被首次植入人体,其集电池、电极和脉冲发生器为一体,无需切开皮肤做皮下囊袋,也无需植入电极,避免了囊袋破溃、出血、感染以及电极脱落、导线断裂等并发症,因此得到了迅速推广,自此起搏器进入“无线时代”。2013年进行的LEADLESS试验[3],表明LCP在具有单腔心室起搏适应证的人群中安全及可行。另外,部分研究[3-5]统计发现传统起搏器植入的并发症发生率为9.5%~10.0%,而LCP植入并发症的发生率为4.0%~6.5%,这使得LCP的发展更上了一个台阶。随着LCP应用于临床的时间越来越长,国内外的相关研究也日益增多,现旨在综述比较LCP和传统起搏器并发症的发生情况,评估LCP与传统起搏器相比,在减少并发症方面是否更具优势(表1)[6-17]。
1 手术并发症
1.1 穿刺相关并发症
1.1.1 血管穿刺并发症
因植入方式及穿刺部位的不同,与传统起搏器相比,LCP血管穿刺并发症(主要包括动静脉瘘、假性动脉瘤等)发生率更高。有研究[6,14]显示,在LCP的植入过程中,穿刺并发症的发生率为0.60%~1.40%。Micra CED研究[7]显示LCP组中有78例患者发生穿刺点事件,发生率相较于TVP组稍高(1.20% vs 0.30%)。在Vaidya等[9]的研究中,LCP组出现了5例与手术相关的腹股沟血肿(均采用保守治疗),而TVP组中未出现相应并发症。 Tjong等[10]对LCP与经静脉单腔起搏器治疗进行了倾向性评分匹配分析,结果显示LCP组中有1例患者(0.50%)出现假性动脉瘤,1例患者(0.50%)出现腹股沟血肿,3例患者(2.90%)发生穿刺部位出血,而TVP组未观察到相应并发症的发生。另外,Micra Post-Approval Registry多中心注册研究[8]显示术后30 d内有6例患者出现穿刺血管相关并发症(包括血肿、动静脉瘘、假性动脉瘤等),发生率为0.75%。尽管LCP的体积较传统起搏器明显减小,仅为其1/10,但由于递送系统较粗,且通过穿刺右股静脉建立静脉通路(也可选择左侧),因此仍存在一定比例的血管穿刺并发症,但术中的一些操作技巧可在一定程度上降低其发生率,如穿刺过程中可通过对血液颜色的变化和流速来判断是否对穿动脉,股静脉近端穿刺可避免部分动静脉瘘的发生。此外,由于LCP的导引鞘的尺寸较大,穿刺后需使用扩张鞘逐级扩张后才能送入导引组件,以防扩张时导致股静脉撕裂。如在常规血管超声引导下静脉穿刺,可进一步降低这种风险[18]。
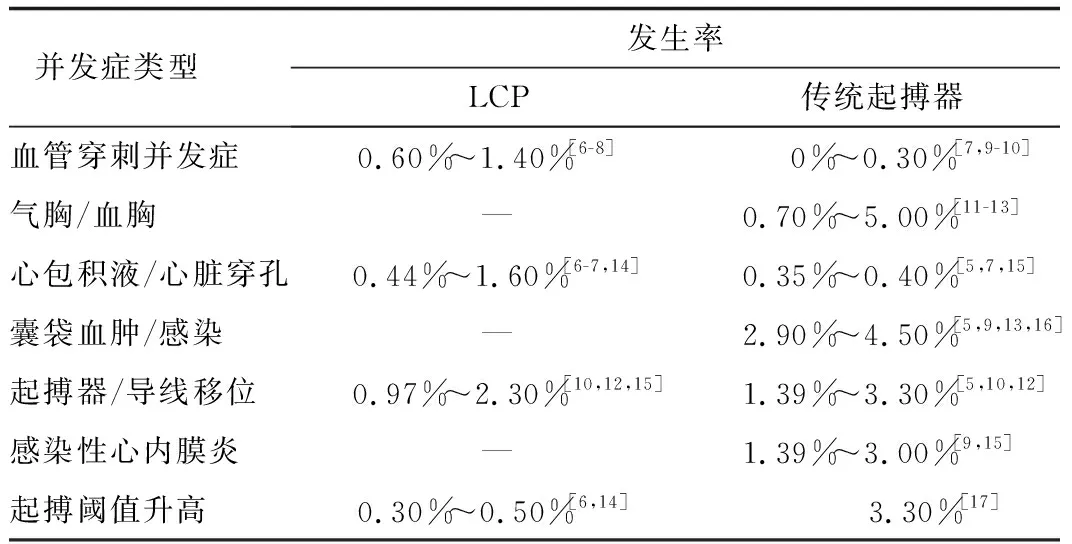
表1 LCP与传统起搏器并发症的比较
1.1.2 气胸/血胸
气胸是传统心脏起搏器植入过程中建立血管通路的一种潜在并发症,多见于植入时或植入后48 h内。尽管目前推荐腋静脉穿刺以减少该并发症的发生,但锁骨下静脉穿刺因其成功率高(约95%)[19],仍是许多中心传统起搏器植入时的常规选择,但同时也带来了气胸/血胸等相关并发症。Res等[11]对既往研究进行综合分析后显示传统起搏器植入后张力性气胸的发生率为0.70%~5.00%。Iwata等[20]报道了1例诊断为病态窦房结综合征的94岁女性患者,接受了双腔永久性起搏器植入。次日起搏失败,CT显示导线穿通右心室,造成左侧气胸和由起搏器导线引起的肺损伤部位的囊性病变。Rehaman等[21]报道了1例62岁女性患者,静脉血管造影显示右锁骨下静脉重度狭窄,经左锁骨下入路行双腔起搏器植入后,发生左侧张力性气胸,导致整个纵隔移位。目前关于LCP植入后发生气胸的相关报道较少,在Tjong等[10]进行的倾向性评分匹配分析中,TVP组中有2例患者(0.90%)出现气胸,1例患者(0.50%)发生血胸,而在LCP组未出现相应并发症。梁静等[12]的研究显示,与TVP组相比,LCP组气胸的发生率较低(0% vs 3.20%)。Moore等[13]对经导管心脏瓣膜置换术后行永久起搏器植入的患者进行了术后并发症研究,该研究发现与LCP组相比,TVP组有明显的气胸并发症(4.50% vs 0%)。Kirkfeldt等[4]的研究和FOLLOWPACE研究[5]均表明女性、低身体质量指数患者更容易发生气胸。另外,盲穿锁骨下静脉、植入双腔起搏器以及既往有肺部疾病史的患者发生气胸的风险也更高[21]。LCP植入时通过穿刺股静脉即可将起搏器植入右心室,避免了穿刺锁骨下静脉带来的气胸等并发症的发生,因此在预估穿刺风险高的人群中建议优先选择LCP。
1.2 心包积液/心脏穿孔
心脏损伤乃至穿孔是LCP植入过程中最危险的并发症,常会危及患者生命,其发生率为0.44%~1.60%[6-7,14]。有文献[22]报道,与经静脉起搏器相比,LCP的心脏穿孔更为常见。Cantillon等[15]的研究中分别纳入LCP和经静脉传统起搏器植入患者718例和1 436例,结果发现LCP组患者总体并发症发生率较低,但心包积液与TVP组相比发生率更高(1.53% vs 0.35%,P=0.005),其中LCP组有1例患者在手术过程中发生心脏穿孔,随后出血延及胸腔,并进行了紧急心肺复苏。Micra CED研究[7]同样显示,LCP组患者的30 d内心包积液/心脏穿孔发生率明显高于TVP组患者(0.80% vs 0.40%,P=0.004)。另外,Hai等[23]报道了1例在LCP植入过程中递送系统紧贴右心室游离壁,注射造影剂后,心脏穿孔伴急性心脏压塞。Togashi等[24]报道了1例LCP植入过程中因器械损伤右心室游离壁引起的无症状心脏穿孔。LCP植入导致的心脏穿孔的原因可能有多种。一方面,其递送系统内径较粗,且手术过程中输送系统可能会始终保持较硬的状态,如操作不当可能会对心脏组织造成较大的创伤;另一方面,女性、低身体质量指数、合并心肌梗死病史和肺部疾病史等患者,心脏穿孔的风险更高。掌握LCP植入技巧具有一定的学习曲线,有研究[6,8]显示Micra LCP心包积液/心脏穿孔的发生率已由早期的1.60%降至后期的0.13%。因此,为了减少心脏穿孔或心脏压塞的发生,术前对患者进行全面评估、术中操作轻柔、术后严密监测生命体征至关重要。
2 囊袋及导线相关并发症
Micra全球上市前的临床IDE研究[6]及上市后的注册研究[8]均表明,LCP与传统起搏器相比,并发症的发生率明显下降。尤其是最新发表的来自真实世界的Micra CED研究[7]显示,与经静脉传统起搏器相比,急性期30 d内LCP设备相关的总体并发症(包括导线移位、感染和囊袋相关并发症等)发生率显著降低(1.40% vs 2.50%)。
2.1 囊袋血肿/感染
LCP无囊袋,因此可避免囊袋破溃、出血、感染等并发症。既往研究[5,9,13,16]显示,传统起搏器囊袋相关并发症的发生率为2.90%~4.50%。在Cantillon等[15]的研究中,起搏器植入1个月内LCP组中未观察到出现囊袋相关并发症的患者,而TVP组中有6例(0.42%),随着随访时间的延长,TVP组中囊袋并发症患者增加至16例,其中4例患者同时并发感染,而相应并发症在LCP组中均未出现。在Vaidya等[9]的研究中,TVP组共发生4例囊袋血肿,而LCP组无相应并发症的发生(0% vs 4.00%)。Moore等[13]的研究显示TVP组中有1例患者发生囊袋感染,LCP组未观察到相应并发症的发生(0% vs 4.50%)。在梁静等[12]的研究中,TVP组出现6例囊袋血肿,而LCP组无相应并发症的发生(0% vs 19.40%,P=0.068)。术中彻底止血是避免传统起搏器植入术后囊袋血肿最重要的方法。Kirkfeldt等[4]的研究显示,低身体质量指数与术后并发症的风险增加相关,特别是发生血肿的风险;另外,口服抗凝药物也容易引起起搏器囊袋血肿,传统起搏器植入需钝性分离皮下组织,容易造成小血管损伤,若同时使用抗凝药物,术后易形成囊袋血肿。因此,术前对患者进行综合的评估、适时停用抗凝药物、术中彻底止血,有利于减少此并发症的发生。
2.2 起搏器/导线移位
LCP或传统起搏器导线移位多发生于术后1周,FOLLOWPACE研究[5]报道了传统起搏器植入后导线移位的发生率为3.30%。LCP的移位是较为少见的并发症,但可能导致严重后果。Tjong等[10]进行的倾向性评分匹配分析结果显示,TVP组中有5例患者(2.30%)发生导线移位,而在LCP组中未观察到起搏器移位的发生。梁静等[12]的研究显示LCP组电极移位发生率低于TVP组(0% vs 3.20%)。而在Cantillon等[15]的研究中,LCP组有7例患者出现电极移位,需手术取出,但与TVP组相比发生率仍较低(0.97% vs 1.39%)。邹彤等[25]对传统心脏起搏器电极脱位的原因进行了初步探讨,表明起搏器电极脱位不仅与电极导线的物理性能、年龄以及基础心血管疾病对心脏结构的影响等相关,还与术者的操作经验、电极导线以及起搏器囊袋的固定方式有关。起搏电极移位主要表现为起搏和感知不良,为减少其发生,术者在手术过程中一定要保证电极与心肌的接触部位稳定可靠。在LCP的植入过程中,进行牵拉试验时需确保至少2个固定小翼固定在心肌才可撤出栓绳[26],以保证LCP固定在位。
2.3 感染性心内膜炎
传统起搏器留置导线过程中容易发生生物膜沉积,产生湍流以及瓣膜撞击,上述因素正是导致感染的常见原因。LCP因无导线,可进一步降低感染的风险。Vaidya等[9]的研究显示与TVP组相比,LCP组感染性心内膜炎的发生率较低(0% vs 3.00%,P=0.04)。Cantillon等[15]的研究显示了同样的结果,短期(1个月)内TVP组中有20例患者发生感染性心内膜炎,而LCP组中未观察到相应并发症的发生(0% vs 1.39%)。临床中部分有导线起搏器植入的患者因反复发生感染性心内膜炎,需进行导线移除这样的复杂手术,LCP的出现无疑为这一困境带来了解决办法。Beurskens等[27]对17例植入传统心脏起搏器后发生感染的患者进行起搏器移除,并于2~7 d在不同的时间植入LCP,随访42个月未发现起搏器相关感染的发生。既往文献[28]报道,感染性心内膜炎在起搏器相关感染中占10.0%,且起搏器相关的感染性心内膜炎属于较为严重的并发症,发生后自然病死率为10.0%~30.0%。因此,对于术后出现新发心脏杂音、持续发热、心功能不全、起搏器工作异常等患者,应高度怀疑起搏器相关感染性心内膜炎,并尽快完善超声心动图及血培养检查。近年,随着医疗水平的提高,感染性心内膜炎的病死率也随之下降。相信随着无导线时代的到来,将会进一步为此类患者带来福音。
3 起搏阈值升高
起搏阈值升高是术后常见并发症之一,有研究[6,14]显示LCP植入后起搏阈值升高的发生率较低,为0.30%~0.50%。在Reynolds等[6]对LCP术后并发症的研究中,随访6个月时有2例患者出现起搏阈值升高,其余患者6个月起搏阈值<2.0 V,从植入到6个月起搏阈值增加不超过1.5 V/0.24 ms。Cantillon等[15]的研究结果显示,LCP组中有5例患者在起搏器植入1个月内出现起搏阈值升高,而在对照组中未出现相应并发症(0% vs 0.70%)。匡晓晖等[26]报道了1例82岁的老年男性患者LCP植入术后出现起搏阈值升高的情况,该患者术中释放起搏器3次且起搏参数欠佳,术后24 h起搏阈值升高且与体位改变相关。陈章强等[17]对传统起搏器术后起搏阈值升高进行了临床分析,该研究共纳入447例植入永久性心脏起搏器的患者,其中15例患者(3.30%)发生起搏阈值升高,12例患者早期阈值升高,主要临床表现为胸闷、心悸、头晕、乏力、一过性黑朦,甚至反复发生阿-斯综合征,经静脉点滴地塞米松后均恢复正常。此外,陈章强等[17]研究发现起搏器植入术后起搏阈值升高和电极与心内膜处心肌的反应、起搏器电极位置放置不佳或电极脱位导致接触不良,以及高血钾、Ⅰ类抗心律失常药的使用等均有关。因此,临床医师应重视起搏器植入术后工作异常这一现象,明确故障原因,避免盲目再次手术,以减轻患者不必要的痛苦。国外有研究[29]表明LCP植入时较高的阈值和较低的阻抗均是起搏阈值升高的预测因子,因此在植入时起搏阈值应尽量<1.5 V/0.24 ms,阻抗>600 Ω[26]。
4 对心脏瓣膜及结构的影响
既往研究[30-31]显示传统起搏器治疗与25%~50%的三尖瓣反流(tricuspid regurgitation,TR)的发生或加重有关,TR加重可能与导线植入过程中损伤三尖瓣小叶或瓣膜下装置,以及跨瓣膜导线的长期机械冲击有关。Moore等[13]通过比较经导管心脏瓣膜置换术后LCP植入与单腔经静脉起搏器植入的结果,发现与TVP组相比,LCP组TR减少。在Vaidya等[9]进行的真实世界的研究中,6个月随访后LCP组中未出现TR严重程度增加≥2级的患者,而TVP组中有19%的患者出现了此种情况。这与之前的研究结果一致,即LCP比传统起搏器导致的TR更少。此外,Salaun等[32]基于超声心动图研究了无导线起搏对心功能和TR的直接影响,他们得出结论,LCP植入后2个月,心脏形态和功能(包括TR和二尖瓣反流)均无明显变化。而Beurskens等[33]在为期12个月的随访研究中观察到,尽管无导线,但LCP植入仍与TR加重有关,与经静脉起搏器相比,接受LCP治疗的患者同样容易出现三尖瓣功能恶化的情况,作者分析这可能与植入过程中三尖瓣损伤、起搏器对三尖瓣持续机械冲击以及起搏引起的右心室非同步化等因素相关。此外,该研究还进一步观察到二尖瓣和双心室功能的下降。值得注意的是,上述研究的随访时间不同,所以尚不能进行直接比较,如Salaun等[32]的超声心动图评估是在LCP植入后2个月进行的,而Beurskens等[33]的随访期为12个月,这可能表明LCP相关的三尖瓣功能障碍并不是手术的典型急性并发症,而是一个慢性发展的过程。如表2的比较结果所示,与传统起搏器相比,LCP治疗对心脏结构及功能的影响目前暂无明确结论,希望能在未来Micra LCP更长期的临床随访研究中得到答案。
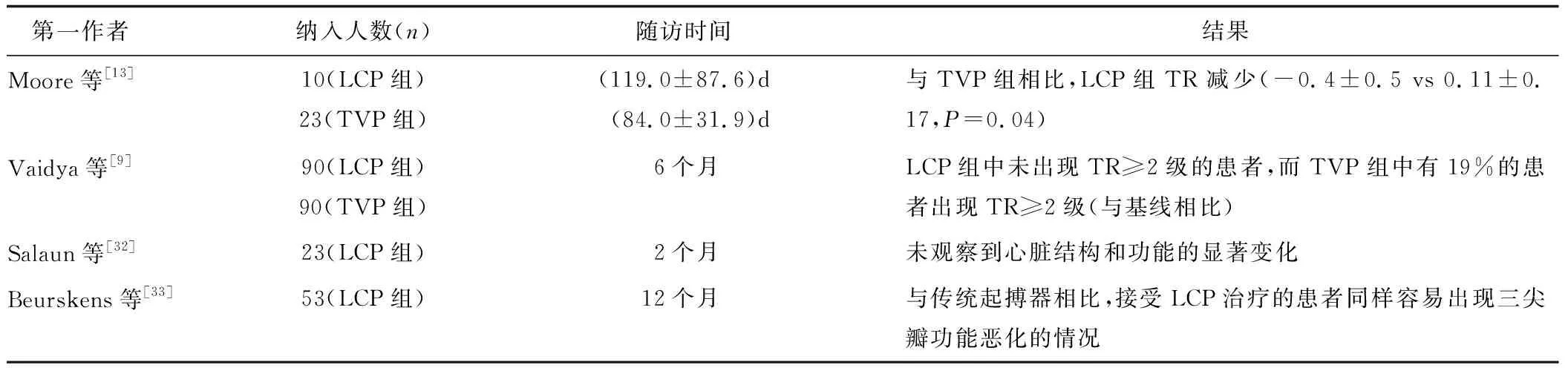
表2 两种起搏器对心脏瓣膜及结构的影响
5 结论
LCP无囊袋及导线相关并发症,且简化了手术步骤,减少了植入传统起搏器时需穿刺锁骨下静脉所带来的相关并发症(如血胸、气胸等)。但由于递送系统较粗,通过穿刺股静脉建立静脉通路,所以血管穿刺并发症(主要包括动静脉瘘、假性动脉瘤等)的发生率较传统起搏器高,其对心脏瓣膜及结构的影响目前尚不能得出明确结论。与传统起搏器相比,LCP的两年慢性并发症发生率降低了31%,起搏器系统再干预率降低了38%[34],具备房室同步功能的Micra AV现已正式在国内应用,且有研究显示95%的患者同步性>70%[35],解决了传统单腔起搏器的弊端。LCP降低并发症的优势已在临床应用中得到了证实。随着技术的进步,无导线心脏再同步化治疗、联合皮下植入型心律转复除颤器及多部位LCP治疗将有广阔的发展前景。

