葡萄糖氧化酶在动物饲料中的作用机理及研究进展
黄 菲 王 曦 曹云鹤
(中国农业大学动物科技学院,动物营养学国家重点实验室,北京100193)
近年来,动物饲料中抗生素的滥用引起的环境污染与细菌耐药性等问题愈发严重。为了实现畜牧业的可持续发展,包括中国在内的多个国家已明确禁止抗生素作为生长促进剂在饲料中添加。为了适应现代绿色农业的发展,以获得高质量、无公害的畜产品,抗生素替代品的研究成为人们关注的重点。
葡萄糖氧化酶(glucose oxidase,GOD)是部分真菌、昆虫和植物产生的一种需氧脱氢酶。早在1999年,GOD就被纳入我国允许使用的饲料添加剂品种目录[1]。多项研究已证明,GOD在畜禽饲料中的添加可以改善动物生产性能、繁殖性能、机体免疫水平和抗氧化能力,还可以调节肠道屏障功能,维持肠道菌群平衡。本文将对GOD的结构、催化机理、在动物饲料中发挥作用的机制以及应用效果作一综述。
1 GOD的结构
截至目前,晶体结构已在美国蛋白质数据库(Protein Data Bank,PDB)(www.rcsb.org)中得到报道的GOD主要来自黑曲霉(1GAL、3QVP、3QVR、5NIT、5NIW和1CF3)、尼崎青霉(1GPE)和黄曲霉(4YNT和4YNU)。GOD的相对分子质量为130×103~175×103,以糖基化的同源二聚体的形式存在,每个亚基非共价结合1个黄素腺嘌呤二核苷酸(flavin adenine dinucleotide,FAD)分子,2个亚基之间通过盐桥和氢键等作用力结合在一起[2-3]。来自黑曲霉的GOD亚基晶体结构如图1所示[4-5]。
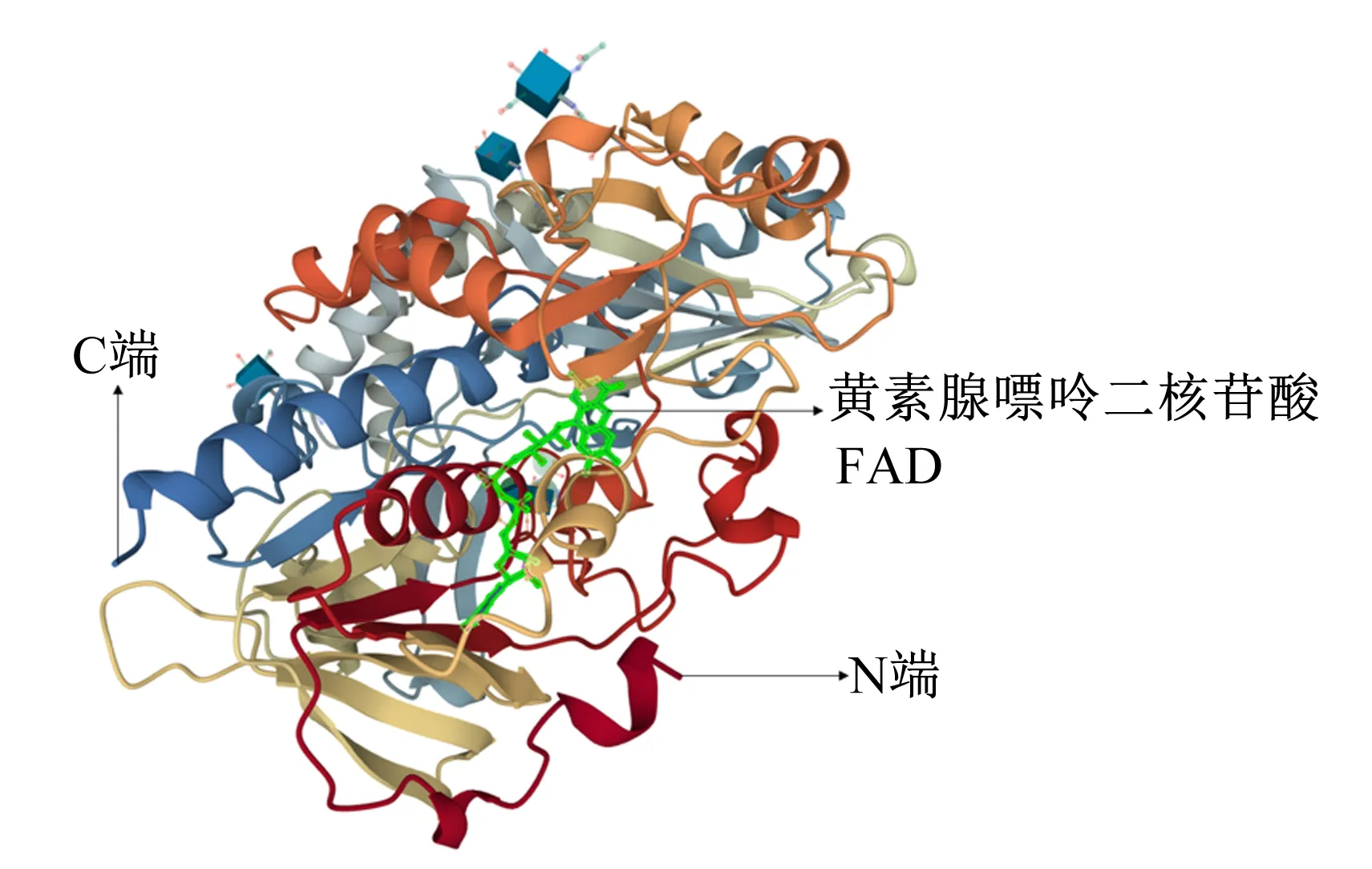
图1 来自黑曲霉的GOD亚基晶体结构
2 GOD的催化机理
GOD能以分子氧为电子受体,特异性地催化β-D-葡萄糖生成过氧化氢和葡萄糖酸(gluconic acid,GA),反应方程式如图2所示[6]。
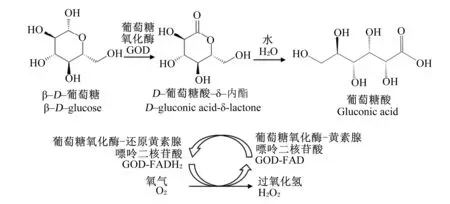
图2 GOD催化反应示意图
在此过程中,GOD分子中的FAD充当辅酶,通过电子与氢的得失参与氧化还原反应。该反应可分为还原和氧化2个步骤:在还原半反应中,GOD催化β-D-葡萄糖氧化为D-葡萄糖酸-δ-内酯,后者能够通过自发的水解形成GA;随后,GOD的FAD环被还原,成为还原型黄素腺嘌呤二核苷酸(FADH2)。在氧化半反应中,还原型GOD被分子氧氧化,生成过氧化氢[3]。
3 GOD的作用
3.1 清除分子氧作用
在饲料加工、运输与储存过程中,氧气不仅有利于好氧微生物(如霉菌等)的生长与繁殖,还会使得饲料中易被氧化的有益成分失活,引起饲料形态、颜色和味道等一系列的变化,导致其保质期缩短,影响动物对饲料的采食。GOD的催化反应可以利用底物葡萄糖,清除分子氧,产生具有杀菌作用的过氧化氢,因此它在食品和饮料上已被广泛用于去除残余的葡萄糖和氧气,以延长保质期[7-8]。Sagi等[9]研究发现,GOD-过氧化氢酶(catalase,CAT)制剂在室温下能在约30 min内将新鲜橙汁中的溶解氧降低到1 mg/L以下,由此可以抑制微生物的生长,从而延长果汁货架期。
应用于动物体内时,GOD的催化作用使得消化道内分子氧减少,有利于肠道厌氧环境的维持,并能促进厌氧有益菌的生长。Wu等[10]研究表明,GOD可以显著增加爱拔益加(Arbor Acres,AA)肉鸡盲肠中厌氧抗炎益生菌普氏栖粪杆菌(Faecalibacteriumprausnitzii)的数量。
3.2 酸化作用
消化道的酸度与饲粮、肠道微生物组成以及消化液的分泌等有很大的关系。GOD催化葡萄糖生成的产物GA是一种有机弱酸,它可以作为益生元改变肠道菌群,其经微生物发酵产生的乙酸、丁酸等短链脂肪酸(short chain fatty acid,SCFA)可进一步降低肠道pH[11]。Biagi等[12]使用GA进行了猪体外盲肠发酵试验,结果表明,与对照组相比,GA在体外系统中调节了盲肠菌群,增加了SCFA的产生,降低了氨浓度;并通过体内试验进一步证明GA倾向于增加仔猪空肠中的总SCFA。
胃肠道的pH会影响蛋白酶原转化为蛋白酶的过程以及消化酶的活性,进而影响饲粮的消化率。杨久仙等[13]研究了GOD对断奶仔猪的影响,发现饲粮中添加0.1%~0.2%的GOD能够降低断奶仔猪胃肠道pH。刘亚娟等[14]研究了GOD对生长獭兔肠道消化酶活性的影响,发现十二指肠和空肠部分的胰蛋白酶活性有随GOD添加量的增加而增强的趋势,并认为GOD催化产生的GA降低了肠道pH,形成了有利于消化酶活性的弱酸性环境。
3.3 抑菌作用
体外试验已证明,GOD对多种细菌和真菌都有抑菌作用。此外,GOD对一些植物病原菌引起的植物病害也有预防和治疗效果[15-16]。GOD的体外抑菌效果见表1[16-26]。
Leiter等[17]研究了产黄青霉GOD的抑菌活性,发现在D-葡萄糖存在下,所有受试细菌、酵母菌和丝状真菌都对GOD敏感。GOD的抑菌效果主要是依靠催化反应产生的过氧化氢完成的,在葡萄糖存在的条件下,GOD催化反应产生的过氧化氢可通过引起胞膜脂质过氧化、干扰细胞内电子传递系统、破坏蛋白质分子结构或损伤遗传物质等方式影响细菌或真菌的正常生理功能[19]。塔宾曲霉(Aspergillustubingensis)产生的GOD可以引起极腐霉(Pythiumultimum)和茄腐镰刀菌(Fusariumsolani)菌丝的变形并抑制其孢子的产生,对其造成致死性损伤[15,25]。GOD对不同微生物的抑菌效果取决于微生物固有的抗氧化能力。Dobbenie等[19]研究表明,微生物分解过氧化氢的能力存在显著差异,在其研究的4种细菌中,荧光假单胞菌(Pseudomonasfluorescens)具有最高的CAT活性,同时对GOD/葡萄糖抗菌系统具有最强的抵抗能力。GOD催化反应导致的碳源减少[16]、反应产物GA引起的细菌膜的去极化、内部pH的变化以及细菌内营养物质运输和合成的改变也可对部分微生物的生长产生抑制[11,22,24]。Kantt等[24]研究发现,GOD和GA对致病菌水生棒杆菌(Corynebacteraquaticum)的生长均有抑制作用,但是仅加入过氧化氢对该菌的生长没有影响,说明GOD对其抑制作用是由GA导致的。
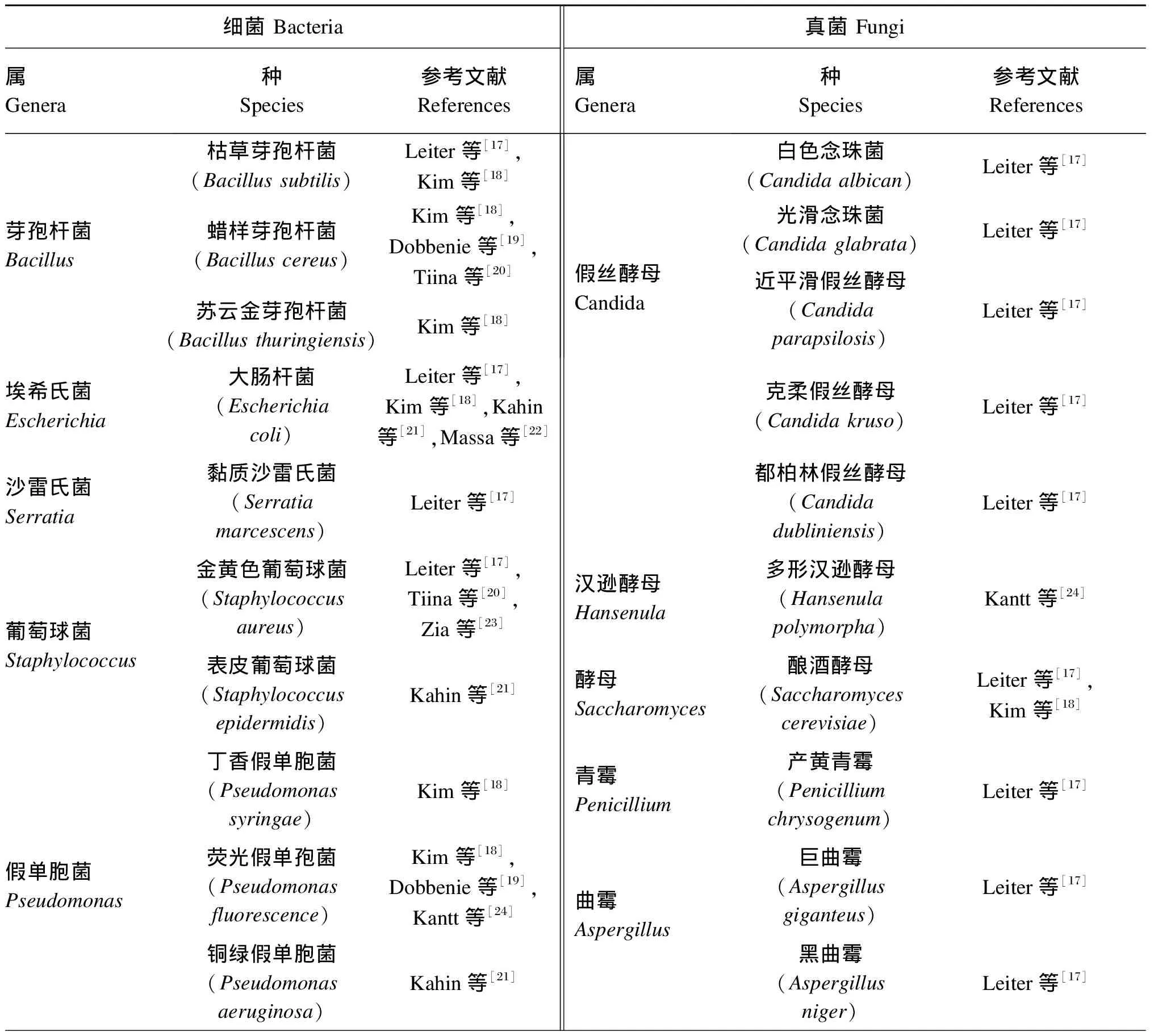
表1 GOD的体外抑菌效果

1 BacteriaGeneraSpeciesReferences FungiGeneraSpeciesReferencesErwinia(Erwinia carotovora)Kim[18](Aspergillus terreus)Leiter[17]Micrococcus(Micrococcus luteus)Dobbenie[19](Emericella nidulans)Leiter[17]Salmonella(Salmonella enteritidis)Dobbenie[19]Rhizoctonia(Rhizoctonia bataticola)Kriaa[25](Salmonella infantis)Tiina[20](Rhizoctonia solani)Kim[18],Kriaa[25](Salmonella derby)Massa[22]Fusarium(Fusarium solani)Kriaa[25]Clostridium(Clostridium perfringens)Tiina[20]Pythium(Pythium ultimum)Kriaa[25],Kim[18]Campylobacter(Campylobacter jejuni)Tiina[20](Pythium aphanidermatum)Kim[18]Listeria(Listeria monocytogenes)Tiina[20]Verticillium(Verticillium dahliae)Kim[18],Kriaa[25]Yersinia(Yersinia enterocofitica)Tiina[20]Alternaria(Alternaria solani)Kriaa[25]Lactobacillus(Lactobacillus plantarum)Tiina[20]Gliocladium(Gliocladium virens)Kim[18]Corynebacterium(Corynebacterium xerosis)Kahin[21]Sclerotinia(Sclerotinia minor)Kim[18](Corynebacterium aquaticum)Kantt[24](Sclerotium rolfsii)Kim[18]Pasteurella(Pasteurella multoida)Zia[23]Talaromyces(Talaromyces flavus)Kim[18]Paemibacillus(Paenibacillus larvae)Sagona[26]Trichoderma(Trichoderma hamatum)Kim[18]

1 BacteriaGeneraSpeciesReferences FungiGeneraSpeciesReferencesAcinetobacter(Acinetobacter calcoaceticus)Kantt[24]Botrytis(Botrytis cinerea)Li[16]
4 GOD在动物养殖中的应用效果
4.1 改善生产性能
GOD改善生产性能的效果因其来源、使用剂量、试验动物以及试验条件等不同而有所差异。表2中列出了部分近年来饲粮中添加GOD对动物生产性能的作用效果[27-33]。
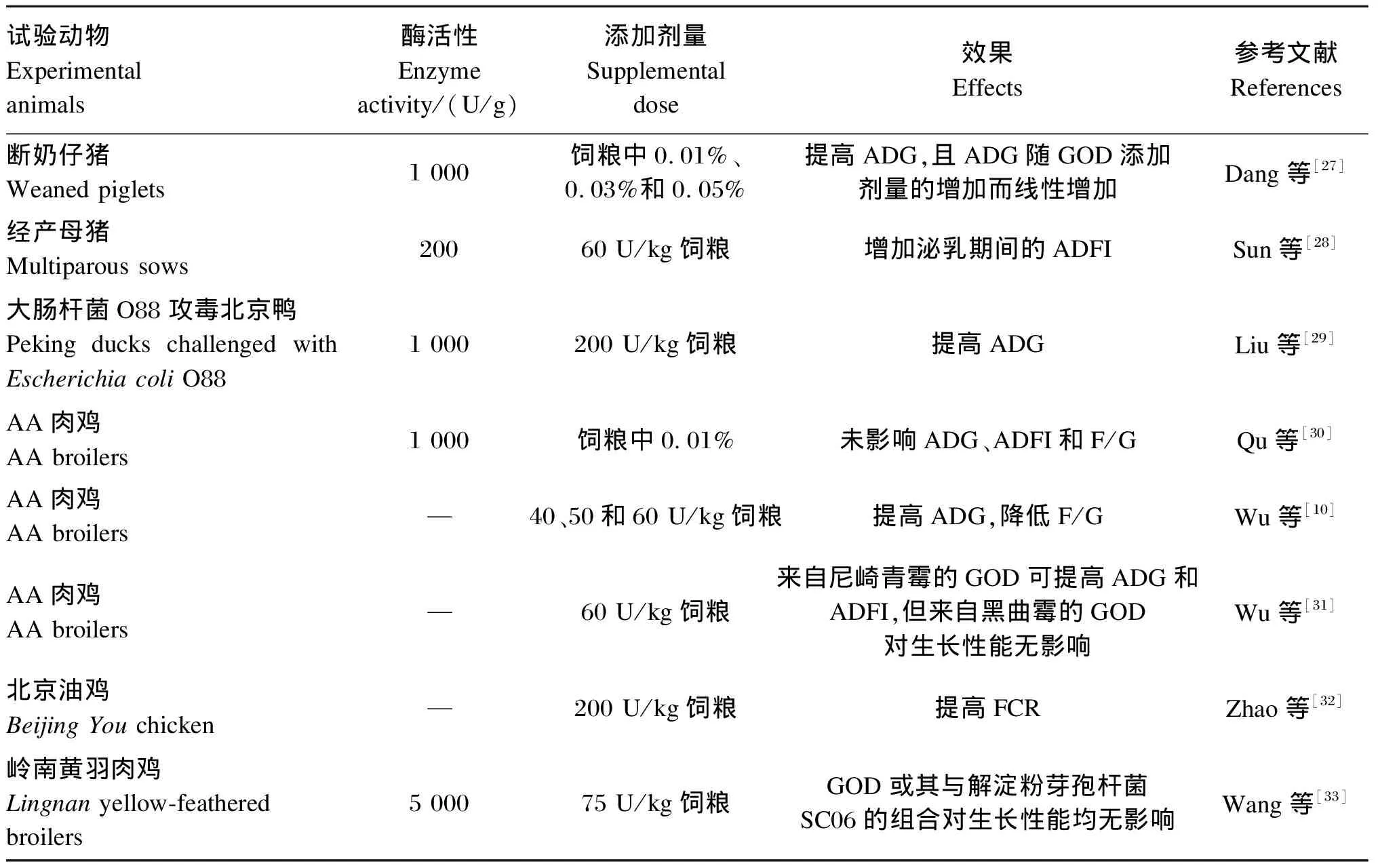
表2 GOD对动物生产性能的影响
生产性能的改善对提高畜牧业经济效益十分重要。多项研究结果表明,在动物饲粮中添加适宜剂量的GOD可以改善动物对干物质、粗蛋白质、钙、磷、粗脂肪和粗纤维等的消化率,显著提高小肠的消化酶活性[10,14,34-35],并因此改善动物的生长性能。Wu等[10]研究发现,在AA肉鸡饲粮中添加GOD可以提高21日龄肉鸡的平均日增重(ADG)并降低料重比(F/G)。Tang等[36]在仔猪饲粮中添加100 U/kg GOD进行饲喂试验,结果显示,补充GOD后仔猪的ADG和饲料转化率(FCR)与对照组相比有所提高,血清中三碘甲腺原氨酸、甲状腺素和生长激素浓度升高,粪便菌群也得到改善,表明GOD可能通过提高生长激素水平或调整肠道菌群结构来改善生长性能。
4.2 改善肉质
肉质的改善对养殖经济效益的提升十分重要。除遗传因素外,肉质主要受到饲粮营养成分和饲养管理水平的影响。饲粮中添加GOD有改善畜禽肉质的效果。Wu等[10]研究表明,与对照组相比,在AA肉鸡饲粮中添加GOD可显著提高屠宰后24 h鸡胸肉的pH和红度,GOD改善肉质可能与提高营养物质消化率和改善抗氧化能力有关。GOD诱导机体抗氧化能力增强,表现为血浆中超氧化物歧化酶(superoxide dismutase,SOD)活性提高,丙二醛(malondialdehyde,MDA)含量显著降低,这是GOD调节肉质的潜在原因。GOD通过消除肠道分子氧、产生GA来改善肠道厌氧和酸性环境,并由此调节肠道菌群,不同肠道菌群的代谢活动对宿主肉质的影响也各不相同。Wu等[31]对肉鸡分别饲喂来自黑曲霉和尼崎青霉的GOD或抗生素生长促进剂(antibiotic growth promoters,AGP),并对其肉质和肠道菌群进行了相关分析,研究发现,肠道菌群的变化介导了不同来源的GOD或AGP对肉质的不同作用;与AGP组相比,GOD组肠道菌群中显著增加的Brenneria、Faecalibacterium和Holdemania与MDA含量呈负相关,与21日龄肉鸡肉质的显著提高呈正相关,Anaerofilum、Coprobacillus和Dorea的显著增加与42日龄肉鸡肉质的显著提高呈正相关;与饲喂黑曲霉产生的GOD相比,饲喂尼崎青霉产生的GOD显著增加了42日龄肉鸡肠道中的Anaerofilum。GOD与一些饲料添加剂联合使用时对肉质的改善效果更佳。Wang等[33]研究表明,GOD和解淀粉芽孢杆菌SC06在饲粮中联用与单独使用相比较,显著降低了岭南黄羽肉鸡胸肌的剪切力,使肉的嫩度有所改善。
4.3 改善繁殖性能
动物的繁殖性能与遗传因素、营养水平、管理水平等密切相关。孙颖雪[37]研究发现,GOD可提高妊娠母猪后期平均日采食量(ADFI)以及断奶后7 d发情率,降低母猪在泌乳期的背膘损失,对母猪生产具有重要意义。尤瑞祺等[38]研究发现,与对照组相比,妊娠母猪饲粮中添加600 mg/kg GOD可以显著提高大河乌猪仔猪的初生重和20日龄体重。GOD对繁殖性能的改善作用可能是通过提高抗氧化能力并减轻氧化应激水平[38-39]、影响机体能量代谢[37]、提高繁殖相关激素的水平[40]以及减少生殖器官细胞凋亡[28]等来实现的。李嘉辉等[39]研究表明,产蛋后期蛋种鸡饲粮添加350和500 mg/kg GOD后,产蛋率、种蛋蛋壳厚度和哈氏单位显著增加,料蛋比显著降低,血清和肝脏谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、SOD活性显著提高,血清和肝脏MDA含量显著降低。由此可见,GOD可能是通过缓解种鸡的氧化应激、减轻脂质过氧化水平来提高其产蛋性能的。血液中适宜的繁殖相关激素的水平对蛋种鸡产蛋后期繁殖性能的维持十分重要。李生杰[40]研究表明,饲粮中添加200、350、500 mg/kg的GOD均提高了产蛋后期海兰褐蛋种鸡血清中雌二醇、促卵泡素和孕酮含量,并不同程度地提高了产蛋率、种蛋受精率以及大白卵泡数量,降低了试验各阶段的料蛋比。Sun等[28]研究表明,饲粮中添加GOD可提高泌乳母猪的ADFI,显著提高断奶时仔猪的窝重,并通过减少细胞凋亡相关基因的表达来减轻肝脏、卵巢和子宫的细胞凋亡,对这些器官起保护作用。
4.4 改善机体免疫水平
饲粮中添加适宜剂量的GOD可改变动物的免疫器官指数、血液或肠道中细胞因子和抗体的含量或表达水平,由此改善机体的免疫水平,且与抗生素有类似的效果。GOD对部分动物免疫水平的影响见表3[10,29,32-33,41-45]。
GOD可通过增强机体免疫水平、降低机体促炎因子水平等方式缓解外界应激引起的炎症反应。刘娇等[46]研究表明,饲粮中添加200 U/kg的GOD可通过降低大肠杆菌O88攻毒肉鸭血液白细胞数、提高淋巴细胞百分比来增强机体的非特异性免疫,且其降低空肠促炎细胞因子含量的效果与抗生素组无显著差异,这表明GOD能够缓解机体的炎症反应,减少外来病原对机体的损伤。Wang等[45]研究发现,在热应激之前补充GOD会刺激肠道氧化应激并产生补偿反应,从而防止肠道炎症因子的快速增加。Qu等[30]研究表明,与发霉玉米组相比,同时补充GOD可通过提高肉鸡回肠分泌型免疫球蛋白A(secretory immunoglobulin A,sIgA)水平和白细胞介素-10(interleukin-10,IL-10)水平,并降低转化生长因子-β(transforming growth factor-β,TGF-β)水平,由此减少霉菌毒素引起的炎症反应;该研究还表明GOD可能通过抑制核转录因子-κB(nuclear transcription factor-κB,NF-κB)信号通路发挥其作用。
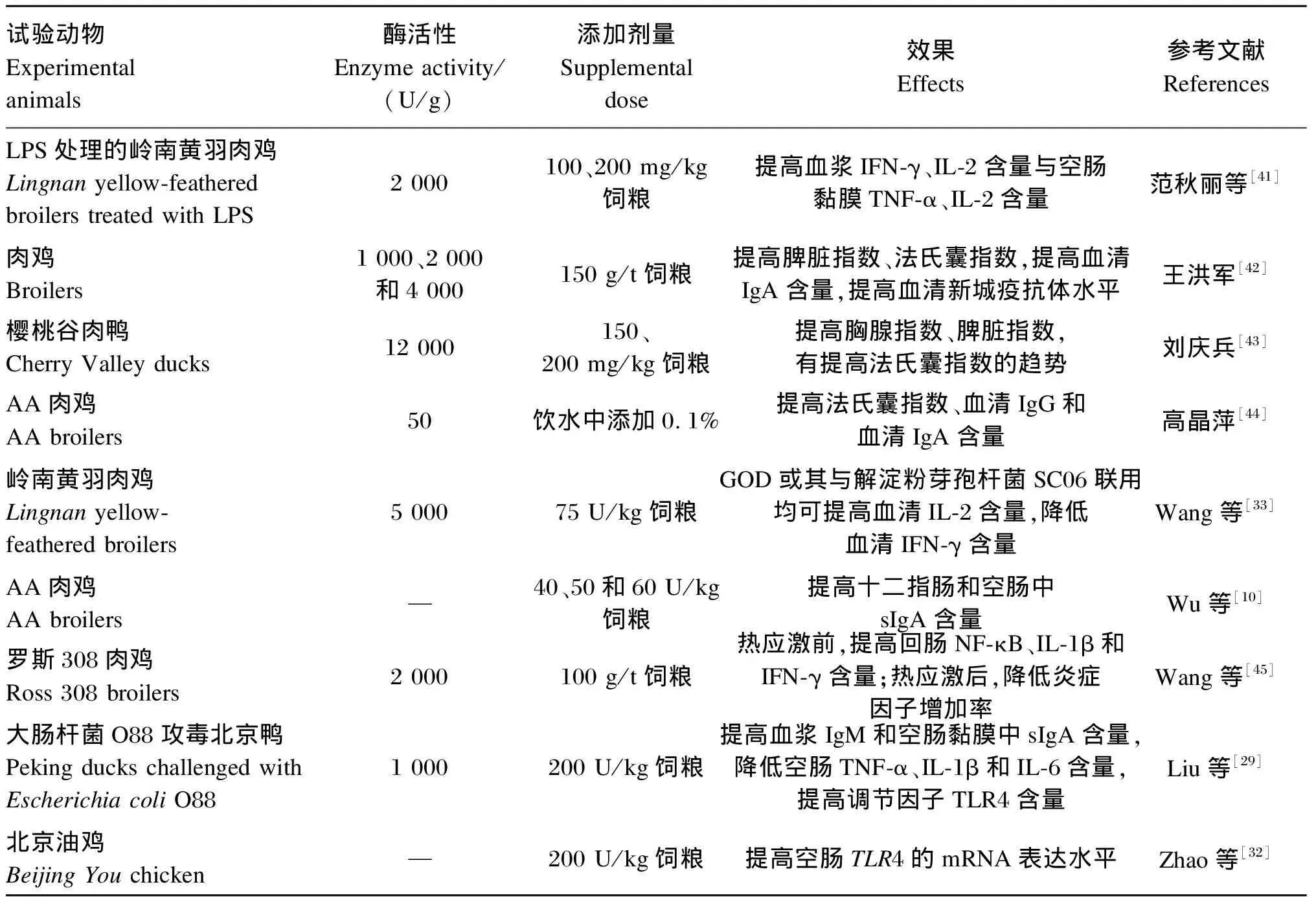
表3 GOD对动物免疫水平的影响
4.5 改善抗氧化能力
当机体的酶促和非酶促抗氧化机制不足以抵御活性氧(reactive oxygen species,ROS)和活性氮(reactive nitrogen species,RNS)的产生时,细胞的氧化还原稳态被打乱,继而发生氧化应激[47-48]。在动物生产中,诱发氧化应激的因素包括出生、断奶、饲粮组成及质量、饲养环境以及社会环境等[49]。氧化应激会导致动物生产性能与繁殖性能等的降低,进而影响养殖的经济效益。多项研究已证明,GOD可以通过提高抗氧化酶的活性和降低机体氧化水平等方式改善机体的抗氧化能力(表4)[10,27-28,31,33-34,38-41,45-46,50-53]。
核因子E2相关因子2(nuclear factor E2-related factor 2,Nrf2)是一种基本的碱性亮氨酸拉链(basic leucine zipper,bZip)转录因子,可通过诱导和上调抗氧化反应元件(antioxidant response element,ARE)依赖性基因的表达来影响谷胱甘肽(glutathione,GSH)的合成和机体氧化还原状态[54-55]。李嘉辉等[39]研究发现,饲粮中添加GOD使产蛋后期蛋种鸡的肝脏和血清中MDA、SOD、GSH-Px等抗氧化指标得到改善,且提高了肝脏抗氧化相关基因[Nrf2、锰超氧化物歧化酶(Mn-SOD)、铜锌超氧化物歧化酶(Cu/Zn-SOD)]的mRNA相对表达量。这说明GOD可能是通过激活核因子Nrf2/ARE信号通路基因的表达,进而提高下游GSH-Px等抗氧化酶的水平以提高抗氧化能力的。Zhang等[56]研究表明,八角提取物(IVE)和添加GOD的益生菌(PGO)能通过激活肝脏和空肠中的Nrf2/Kelch样ECH关联蛋白1(Keap1)信号通路来提高断奶仔猪的抗氧化能力,且IVE与PGO的互作效应显著。转录因子p53是一种具有多种细胞功能的氧化还原调节蛋白,它的持续激活将上调ROS的表达[48],使氧化应激水平升高。B细胞淋巴瘤-2相关X蛋白(Bax)是细胞凋亡中线粒体途径中的关键调节因子,也可以促进ROS的产生[57]。Wang等[33]在肉鸡上的试验结果显示,与对照组相比,GOD显著降低肝脏中p53和Bax的相对转录水平。这表明GOD可通过降低促氧化应激蛋白的表达水平来减少ROS的产生,进而减轻氧化应激对机体的影响,与单独的GOD组相比,饲粮添加75 U/kg GOD和1×105CFU/g解淀粉芽孢杆菌SC06的组合能更显著地降低p53和B细胞淋巴瘤-2(Bcl-2)的转录,表明其对抗氧化活性和抗细胞凋亡的效果更好。Sun等[28]研究表明,与饲粮只添加60 U/kg GOD的经产母猪相比,同时添加75 U/kg CAT和60 U/kg GOD可以降低泌乳第1天母猪血浆中的ROS水平。这说明GOD降低氧化应激产物水平的能力受饲粮CAT活性的影响,GOD联合CAT可以更好地缓解哺乳母猪的氧化损伤。
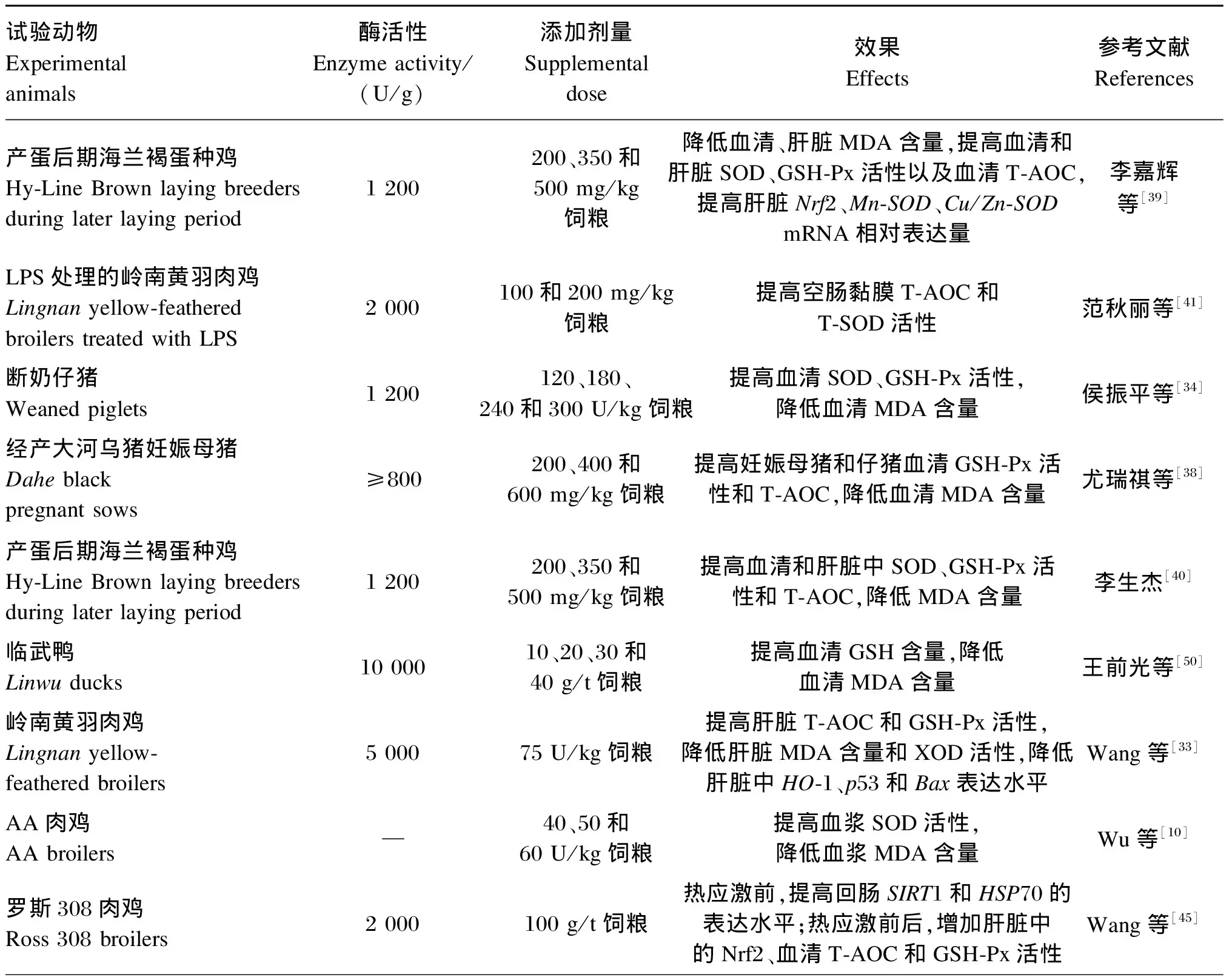
表4 GOD对动物抗氧化能力的影响
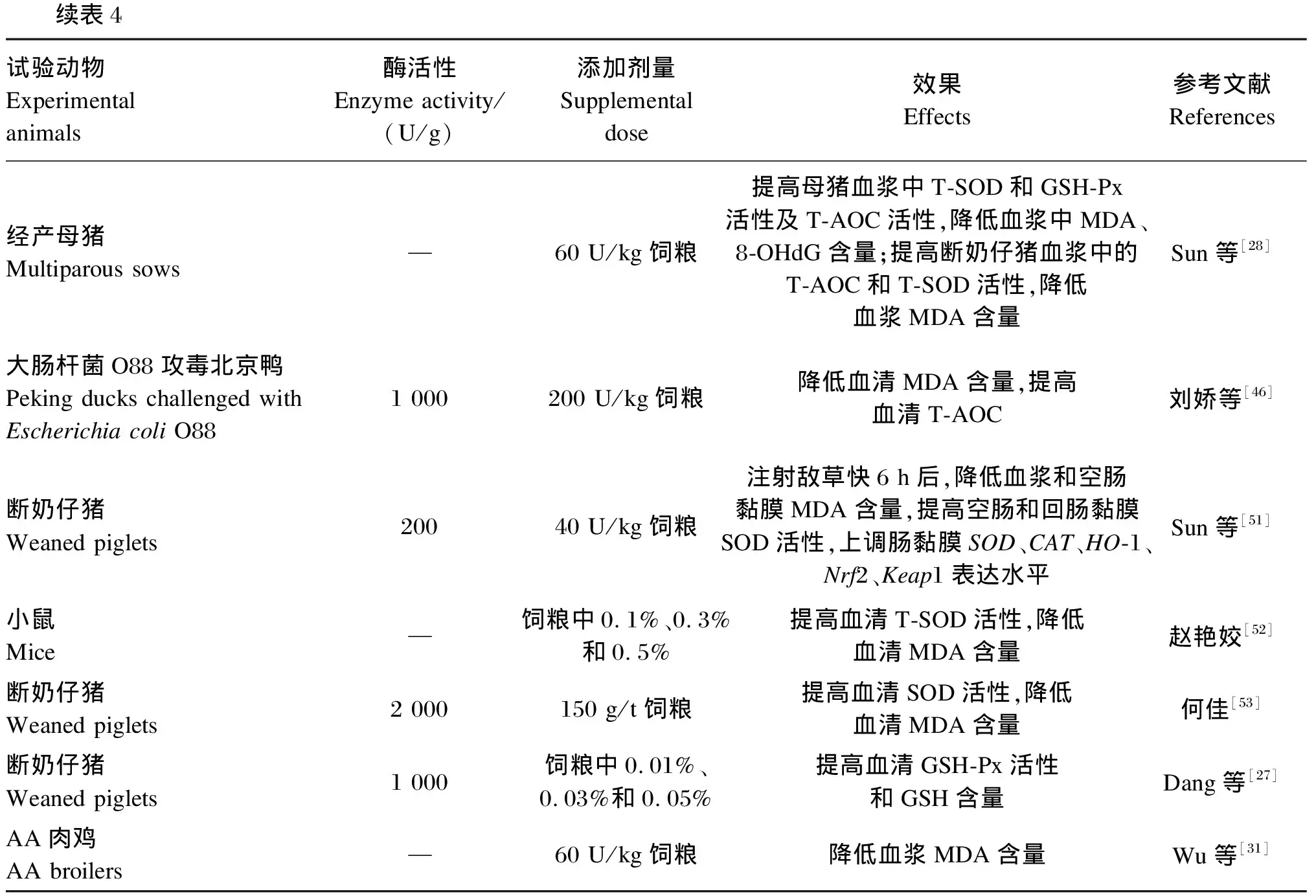
4Experimental animalsEnzyme activity/(U/g)Supplemental doseEffectsReferencesMultiparous sows—60 U/kgT-SODGSH-PxT-AOC,MDA、8-OHdG;T-AOCT-SOD,MDASun[28]O88Peking ducks challenged with Escherichia coli O881 000200 U/kgMDA,T-AOC[46]Weaned piglets20040 U/kg6 h,MDA,SOD,SOD、CAT、HO-1、Nrf2、Keap1Sun[51]Mice—0.1%、0.3%0.5%T-SOD,MDA[52]Weaned piglets2 000150 g/tSOD,MDA[53]Weaned piglets1 0000.01%、0.03%0.05%GSH-PxGSHDang[27]AAAA broilers—60 U/kgMDAWu[31]
4.6 改善肠道健康
4.6.1 改善肠道屏障功能
动物肠道屏障包括微生物屏障、物理屏障、化学屏障和免疫屏障[58-59]。肠道的物理屏障由紧密连接蛋白构成,包括咬合蛋白(occludin)、闭合蛋白(claudin)及闭合小带蛋白(zonula occludens,ZOs),它们形成了肠道屏障的结构基础[60]。黏蛋白-2(mucin-2,MUC-2),在肠道中由杯状细胞分泌,与水、电解质和脂质等一起在肠道中形成黏稠的凝胶状网络[61],构成肠道的化学屏障。研究表明,GOD能够通过提高紧密连接蛋白[29-30,32-33,51,62-63]、黏蛋白[33]、分泌型免疫球蛋白[62]等在肠道中的表达水平改善动物的肠道的屏障功能,阻止不利因素影响下肠道通透性的提高[29-30,46]。Liu等[29]研究了饲粮中添加200 U/kg GOD对大肠杆菌O88攻毒北京鸭的影响,发现GOD可以增强紧密连接蛋白ZO-1、claudin-1和claudin-2的基因表达,并降低鸭血浆中二胺氧化酶(diamine oxidase,DAO)的活性和D-乳酸(D-lactic acid,D-LA)的含量,这说明攻毒肉鸭的肠道通透性降低,物理屏障得到改善,攻毒造成的肠道损伤被减轻。
4.6.2 维持肠道菌群平衡
在人和动物的消化道中,存在着数以万亿计的微生物,它们可通过发酵食物成分影响胃肠道的消化与吸收,其产生的信号还会经由脑肠轴影响机体的神经、内分泌和免疫通路[64]。微生物群进化出了复杂的机制,包括营养竞争、竞争性代谢相互作用、生态位排斥和宿主免疫反应的诱导来抑制病原体的生长[65],由此减少有害菌对机体的影响。
研究已证明,饲粮中补充GOD可提高肠道菌群多样性[32,50,63,66]、减少有害菌数量并提高有益菌数量[28,67-69],由此来维持动物肠道菌群的平衡。Zhao等[32]在北京油鸡上的研究证明,饲粮补充200 U/kg GOD有增加回肠菌群香农-韦弗指数的趋势,且在属水平上降低了致病菌埃希氏-志贺氏菌属(Escherichia-Shigella)的相对丰度;添加GOD后,Faecalibacterium和拟杆菌门(Bacteroidetes)的相对丰度增加,这有利于77日龄北京油鸡的增重、饲料利用率和肠道屏障功能。Wu等[10]研究表明,饲粮GOD诱导的不同肠道微生物,特别是普氏栖粪杆菌,可能作为改善生长性能和肠道健康的重要调节因子,与AGP相比,GOD能在提高生长性能的同时保持肠道细菌多样性。GOD改变肠道菌群结构的功能主要是通过消耗氧气、产酸以及产生过氧化氢来完成的。GOD催化大量消耗肠道中的氧气,有利于肠道厌氧环境的维持,并促进厌氧益生菌的生长,抑制好氧有害菌的生长。GOD催化反应的产物GA经乳酸菌发酵产生的乳酸和乙酸酯能被利用酸的细菌[如埃氏巨型球菌(Megasphaeraelsdenii)]用来生成丁酸[70],而丁酸是结肠细胞的主要能量来源,可维持健康的肠道微生物群[71],从而对动物的肠道产生积极影响。
4.6.3 改善肠道形态
肠道形态不仅反映了肠道的健康水平,也能在一定程度上反映肠道对营养物质的吸收能力。肠绒毛高度(villus height,VH)越长,则其与营养物质接触的表面积越大,对营养物质的吸收越有利[72]。新的肠细胞需要从隐窝迁移到绒毛尖端,在此迁移过程中,细胞成熟且吸收营养的能力更完善[73],较浅的隐窝代表着细胞的成熟度较高。肠道VH越长、隐窝深度(crypt depth,CD)越小、绒毛高度/隐窝深度(VH/CD)值越大通常代表着肠道吸收能力越好。GOD能在有害微生物攻毒[29,63]、氧化应激[51]等对肠道功能不利的条件下不同程度地增加肠道的VH、降低CD或增大VH/CD。Zhao等[63]使用产气荚膜梭菌从第14天到第20天对AA肉鸡进行攻毒,探究了GOD对坏死性肠炎的预防和缓解作用,结果表明,GOD能显著增加第21天回肠VH和VH/CD,表明GOD可以改善肠道的形态结构,这种改善作用可能是通过GOD催化产生的GA的益生作用完成的。
4.7 其他作用
4.7.1 缓解霉菌毒素中毒
霉菌毒素是饲料中的主要污染物,饲料中霉菌毒素包括黄曲霉毒素、赭曲霉毒素A、伏马菌素、玉米赤霉烯酮和脱氧雪腐镰刀菌烯醇等[74]。霉菌毒素对动物具有肾毒性、肝毒性、神经毒性和免疫毒性等多种毒性[75],会影响动物的生长性能、繁殖性能以及肉质等多种与经济效益关系密切的指标。
饲粮中添加GOD一方面可以抑制黄曲霉等多种产生霉菌毒素的真菌的生长,另一方面也能缓解霉菌毒素暴露对动物的影响。Qu等[30]研究了饲粮添加0.01% GOD对饲喂含有10%霉变玉米饲粮的AA肉鸡的影响,结果表明,补充GOD可以防止绒毛破裂、维持肠道通透性和屏障功能来保护肠道免受霉菌毒素的损害,对肉鸡的生长、炎症反应、抗氧化活性和免疫功能具有保护作用,其有益作用可能是微生物群介导的。
4.7.2 抗仔猪腹泻
饲粮中补充氧化锌是一种常用的抗仔猪腹泻手段,但是它有污染环境、传播抗生素抗性基因和影响肠道正常微生物群的风险[76]。因此,氧化锌替代品的开发至关重要。陈成[77]进行了GOD替代高剂量氧化锌的研究,并综合试验结果中GOD的促生长和抗腹泻作用得出结论:断奶仔猪饲粮中添加30 mg/kg活性为1 000 U/g的GOD可替代3 000 mg/kg氧化锌,且经济效益显著。
4.7.3 缓解热应激
家禽生产过程中,热应激是一项巨大的挑战,会导致家禽生长性能降低,肉质变差[78]。Wang等[45]研究了在热应激前后的饲粮中添加GOD对肉鸡生长、肠道炎症等的影响,结果显示,饲粮中添加GOD(100 g/t)提高了高温下肉鸡的生长性能,显著降低了肠道炎症因子增加率。热应激之前,在肉鸡饲粮中添加GOD会引起肠道氧化应激和炎症因子的产生,激活免疫系统并刺激机体产生代偿效应,从而防止热应激后肠道炎症因子的迅速增加,使动物免受严重伤害。
5 小结与展望
GOD在包括猪、鸡和鸭等多种动物上的应用效果已得到广泛的研究,其催化过程中耗氧、产酸以及产过氧化氢的特性赋予了它在动物体外发挥的抑菌保鲜作用以及在动物体内的促生长、助消化、提高繁殖性能、改善肉质、抗氧化、提高免疫水平、改善肠道健康以及缓解应激的效果。目前,GOD在动物饲料中的使用还存在着一些问题,有待通过进一步研究提升其应用效果:1)GOD的来源、酶学性质以及使用GOD的动物品种、年龄、饲粮组成等都会影响GOD在动物中的应用效果。因此,在对不同动物使用不同来源的GOD时,应当遵循规定的使用剂量或进行合理的试验以确定适宜剂量。2)GOD发挥作用时会产生强氧化剂过氧化氢,饲粮中单独添加过量的GOD可能会使机体局部氧化应激水平升高从而降低其有益效果。因此,需要研究GOD与一些能够减轻机体氧化应激水平的饲料添加剂(如植物提取物、益生菌和CAT等)的合理配伍,以提升GOD在饲料中的应用价值。3)部分饲料加工步骤(如膨化、制粒等)中的高温环境以及动物消化道内的低pH、胃蛋白酶及胰蛋白酶等的消化会破坏酶制剂的正常结构,进而影响其功能。为得到更适合作为饲料添加剂的GOD,可发掘耐酸、耐热、耐受蛋白酶消化的新酶或基于工程技术对现有酶进行合理改造。

