吡非尼酮辅助治疗慢性心力衰竭对心肌纤维化的影响*
符芳盈,黄茂芹,陈 妮
(海南医学院第二附属医院药学部,海南 海口 570311)
慢性心力衰竭(CHF)是多种心血管疾病的终末阶段,发病率和死亡率均高,5年生存率与恶性肿瘤相当,已成为危害人类健康的主要疾病之一[1]。心肌重构是CHF的重要病理生理机制,而心肌纤维化(MF)是导致心室重构的基础病理改变,与CHF密切相关,故抑制MF可有效改善CHF患者的预后[2-3]。交感神经系统(SNS)和肾素-血管紧张素-醛固酮系统(RAAS)激活是MF发生与发展的重要因素[4-5]。常规抗心力衰竭药物如阻断SNS的β受体阻滞剂、阻断RAAS的血管紧张素转换酶抑制剂(ACEI)和血管紧张素Ⅱ受体阻滞剂(ARBⅡ)可抑制和延缓心室重构[6]。吡非尼酮是一种广谱抗纤维化药物,可抑制和逆转纤维化形成,治疗肝纤维化、肾间质纤维化等纤维化疾病疗效较好[7]。本研究中探讨了吡非尼酮辅助治疗CHF的临床疗效,以及对患者MF的影响。现报道如下。
1 资料与方法
1.1 一般资料
纳入标准:符合《慢性心力衰竭中西医结合诊疗专家共识》中CHF的诊断标准[8];经美国纽约心脏病协会(NYHA)心功能分级为Ⅱ~Ⅳ级。本研究方案经我院医学伦理委员会审批(批件号为20180827019),患者及其家属均签署知情同意书。
排除标准:严重内分泌疾病;严重感染性疾病;严重肝、肾功能异常;心源性休克,心包填塞,严重室性心律失常,肺栓塞;精神异常,不愿配合治疗;3个月内参加过其他临床试验。
病例选择与分组:参考文献[9],计算最小样本量为78例,考虑10%脱失率,最终确定研究样本量为94例。选取我 院2018年12月至2020年12月收治的CHF患者94例,按简单随机化法分为观察组和对照组,各47例。两组患者一般资料比较,差异无统计学意义(P>0.05),具有可比性。详见表1。
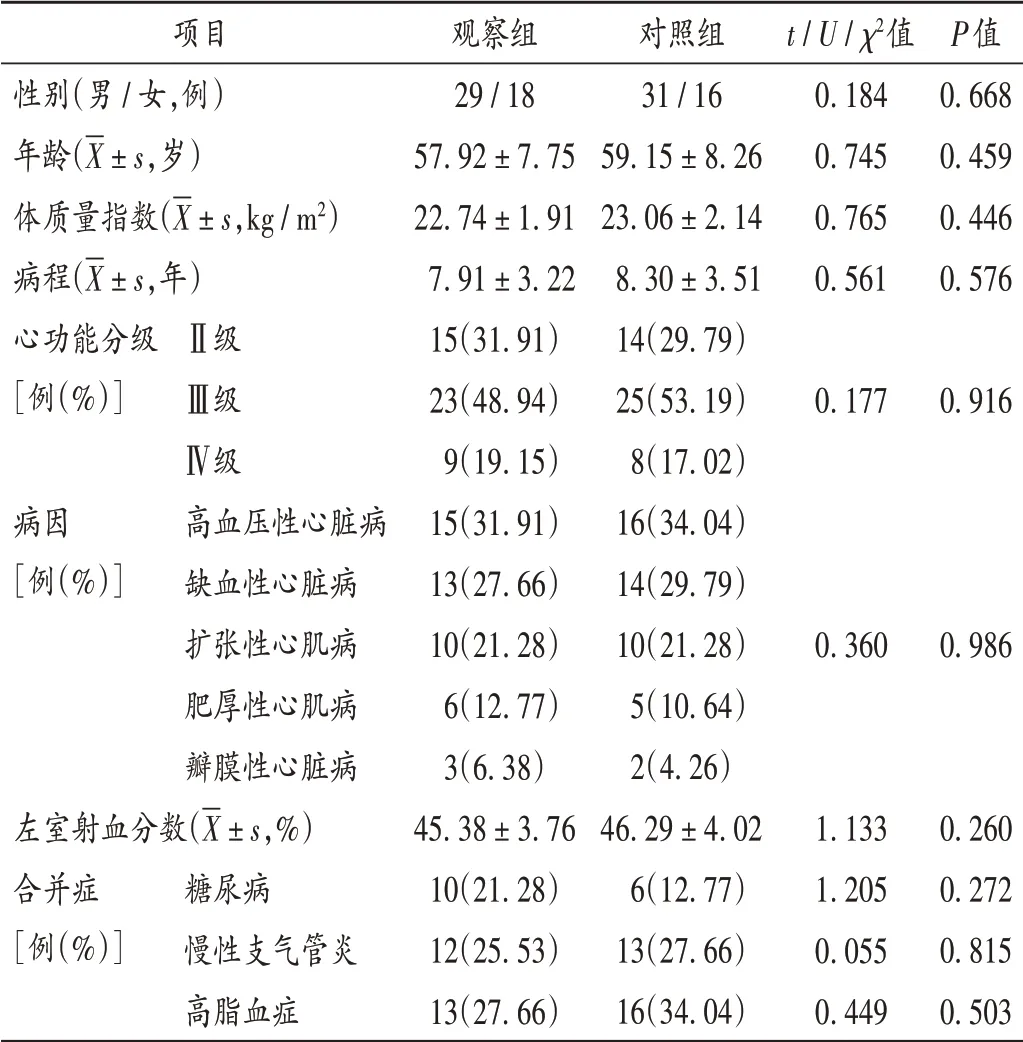
表1 两组患者一般资料比较(n=47)Tab.1 Comparison of the patients'general data between the two groups(n=47)
1.2 方法
去除心律失常、感染、缺血、酸碱及电解质紊乱、过度摄盐、应用损害心肌或心功能药物等诱因后,根据症状改善情况,在不引发症状前提下鼓励患者规律体力活动或运动训练,同时综合情感干预。对照组患者在饮食及生活管理基础上,给予β受体阻滞剂、ACEI、ARB、醛固酮受体拮抗剂等常规抗心力衰竭药物,必要时加用地高辛和利尿剂。观察组患者在对照组基础上加用吡非尼酮胶囊(北京康蒂尼药业股份有限公司,国药准字H20133376,规格为每粒100 mg),每次0.4 g,每天3次。两组患者均持续治疗1个月。
1.3 观察指标与疗效判定标准
观察指标:1)心功能指标。采用HP5500型心脏彩色多普勒超声心动图机(美国HP公司)测定左室射血分数(LVEF)、心输出量(CO)、每搏输出量(SV)、二尖瓣血流最大流速和心房收缩期二尖瓣血流最大流速比值(E/A),由同一影像科医师操作。2)MF指标。采集清晨空腹肘静脉血5 mL,离心(离心半径为8 cm,转速为3500 r/min)15 min,取血清,采用放射免疫法检测Ⅰ型前胶原(PCⅠ)、Ⅲ型前胶原(PCⅢ)、层粘连蛋白(LN)、透明质酸(HA)的水平,检测试剂盒购自上海海研医学生物技术中心。3)血清转化生长因子β1(TGF-β1)和过氧化物酶体增殖物激活受体α(PPARα)。采用酶联免疫吸附(ELISA)法检测治疗前后TGF-β1和PPARα的水平,检测试剂盒分别购自上海海军医学研究所和美国Genzyme公司。4)炎性因子。采用放射免疫法检测血清肿瘤坏死因子-α(TNF-α)和白细胞介素1β(IL-1β)的水平,采用ELISA法检测血清核转录因子κB(NF-κB)的水平,检测试剂盒分别购自北京北方生物技术研究所、天津九鼎医学生物有限公司、武汉博士德公司。
疗效判定[10]:症状及体征基本消失,心功能分级改善不少于2级,为显效;症状及体征均改善,心功能改善1级,为有效;未达到上述标准,为无效。总有效=显效+有效。
安全性:记录两组患者治疗期间的皮疹、头晕头痛、胃肠道反应等药品不良反应发生情况。
1.4 统计学处理
采用SPSS 25.0统计学软件分析。计数资料以率(%)表示,行χ2检验,当2个格子的理论数(T)为1≤T<5时采用校正值;计量资料采取Bartlett方差齐性检验与Kolmogorov-Smirnov正态性检验,均确认具备方差齐性且近似服从正态分布,以±s表示,组间比较采用独立样本t检验,组内比较采用配对样本t检验。均采用双侧检验,P<0.05为差异有统计学意义。
2 结果
结果见表2至表6。
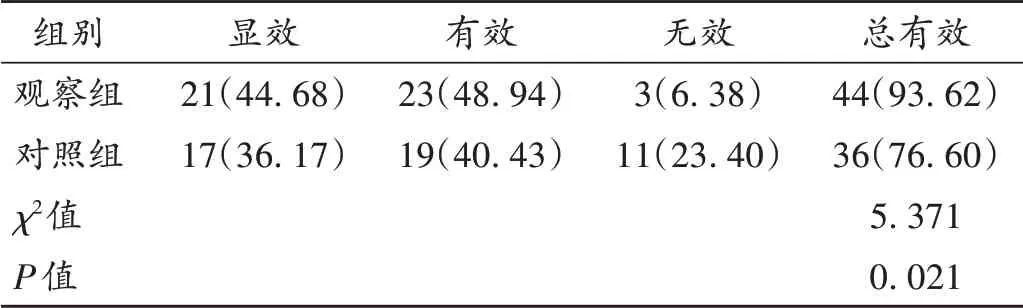
表2 两组患者临床疗效比较[例(%),n=47]Tab.2 Comparison of clinical efficacy between the two groups[case(%),n=47]
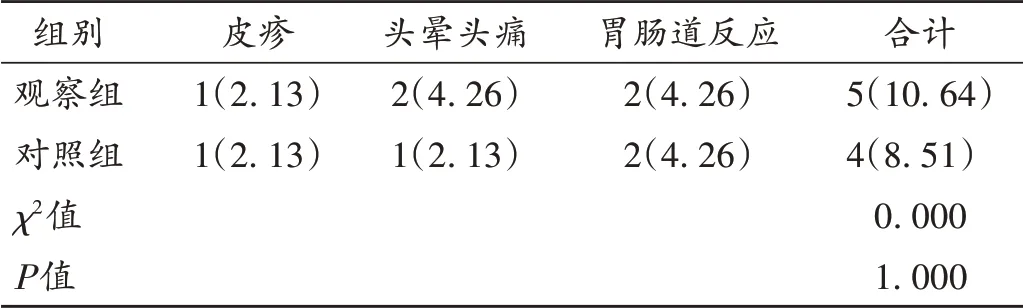
表3 两组患者药品不良反应发生情况比较[例(%),n=47]Tab.3 Comparison of the incidence of adverse drug reactions between the two groups[case(%),n=47]
表4 两组患者心功能指标比较(±s,n=47)Tab.4 Comparison of cardiac function indexes between the two groups(±s,n=47)
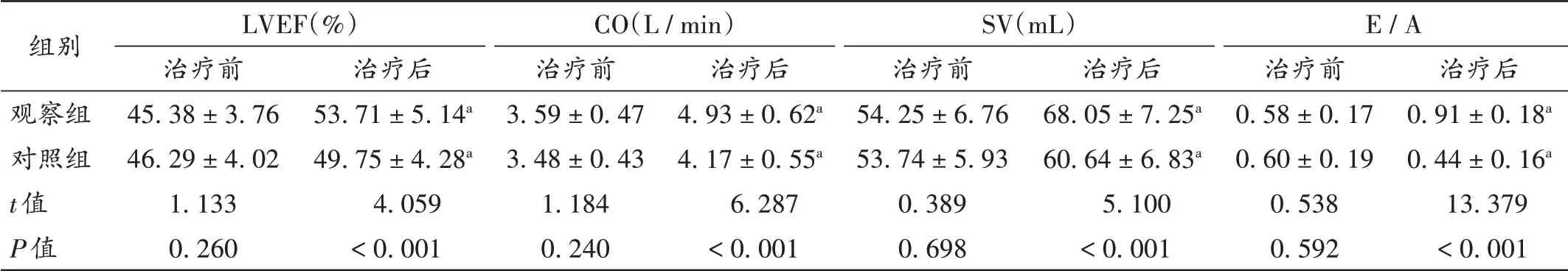
表4 两组患者心功能指标比较(±s,n=47)Tab.4 Comparison of cardiac function indexes between the two groups(±s,n=47)
注:与本组治疗前比较,aP<0.05。表5和表6同。Note:Compared with those before treatment,aP<0.05(for Tab.4-6).
组别观察组对照组t值P值LVEF(%)治疗前45.38±3.7646.29±4.021.1330.260治疗后53.71±5.14a 49.75±4.28a 4.059<0.001 CO(L/min)治疗前3.59±0.473.48±0.431.1840.240治疗后4.93±0.62a 4.17±0.55a 6.287<0.001 SV(mL)治疗前54.25±6.7653.74±5.930.3890.698治疗后68.05±7.25a 60.64±6.83a 5.100<0.001 E/A治疗前0.58±0.170.60±0.190.5380.592治疗后0.91±0.18a 0.44±0.16a 13.379<0.001
表5 两组患者MF指标水平比较(±s,μg/L,n=47)Tab.5 Comparison of MF index levels between the two groups(±s,μg/L,n=47)
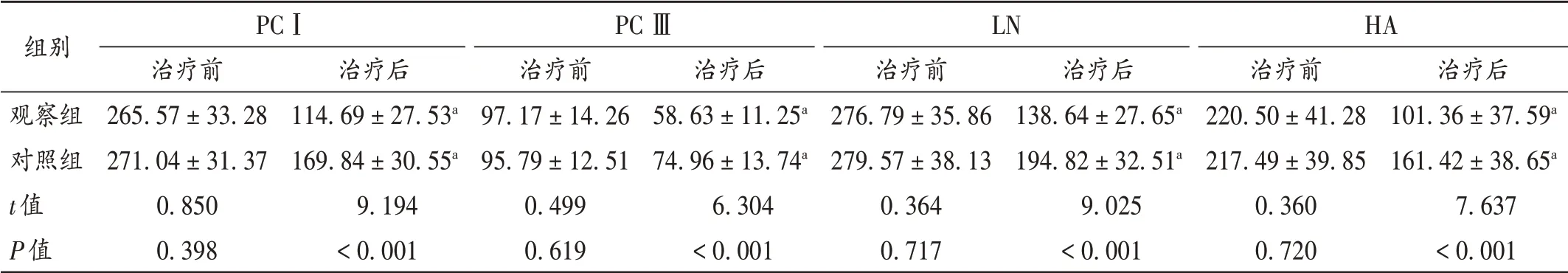
表5 两组患者MF指标水平比较(±s,μg/L,n=47)Tab.5 Comparison of MF index levels between the two groups(±s,μg/L,n=47)
组别观察组对照组t值P值PCⅠ治疗前265.57±33.28271.04±31.370.8500.398治疗后101.36±37.59a 161.42±38.65a 7.637<0.001治疗后114.69±27.53a 169.84±30.55a 9.194<0.001 PCⅢ治疗前97.17±14.2695.79±12.510.4990.619治疗后58.63±11.25a 74.96±13.74a 6.304<0.001 LN治疗前276.79±35.86279.57±38.130.3640.717治疗后138.64±27.65a 194.82±32.51a 9.025<0.001 HA治疗前220.50±41.28217.49±39.850.3600.720
表6 两组患者血清TGF-β1与PPARα和炎性因子水平比较(±s,n=47)Tab.6 Comparison of levels of TGF-β1,PPARα and inflammatory factors in the serum between the two groups(±s,n=47)
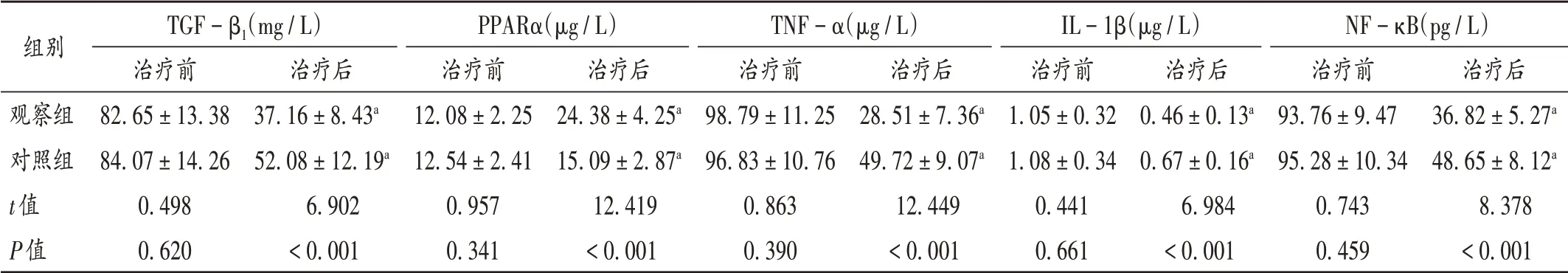
表6 两组患者血清TGF-β1与PPARα和炎性因子水平比较(±s,n=47)Tab.6 Comparison of levels of TGF-β1,PPARα and inflammatory factors in the serum between the two groups(±s,n=47)
组别TGF-β1(mg/L)治疗前82.65±13.3884.07±14.260.4980.620治疗后37.16±8.43a 52.08±12.19a 6.902<0.001 PPARα(μg/L)治疗前12.08±2.2512.54±2.410.9570.341 TNF-α(μg/L)治疗前98.79±11.2596.83±10.760.8630.390治疗后24.38±4.25a 15.09±2.87a 12.419<0.001 IL-1β(μg/L)治疗前1.05±0.321.08±0.340.4410.661治疗后28.51±7.36a 49.72±9.07a 12.449<0.001观察组对照组t值P值治疗后0.46±0.13a 0.67±0.16a 6.984<0.001 NF-κB(pg/L)治疗前93.76±9.4795.28±10.340.7430.459治疗后36.82±5.27a 48.65±8.12a 8.378<0.001
3 讨论
MF是心室壁顺应性减退、诱发心律失常甚至心源性猝死的结构基础,是心脏舒张功能障碍、心功能由代偿期向失代偿期转变的关键环节,也是慢性心功能不全难以逆转的主要原因[11]。对于CHF患者,如何防治MF、改善心功能、减少心脏恶性事件的发生是关键。
吡非尼酮作为广谱抗纤维化药物,防治肝纤维化、恶性胶质瘤、特发性肺纤维化等纤维化疾病效果良好[12]。细胞外基质(ECM)异常表达是心肌重构的病理过程之一。Ⅰ型、Ⅲ型胶原蛋白占ECM的90%以上,PCⅠ,PCⅢ,LN,HA能反映胶原代谢、积聚的情况,无创评估MF程度,可作为抗MF药物疗效观察的重要依据[13]。本研究结果显示,两组患者治疗后的血清PCⅠ,PCⅢ,LN,HA水平均显著低于治疗前,且观察组显著低于对照组(P<0.05),表明在常规治疗基础上加用吡非尼酮可有效减轻CHF患者的MF。同时,观察组患者总有效率显著高于对照组,治疗后的LVEF,CO,SV,E/A均显著高于对照组,表明吡非尼酮通过抑制CHF患者的MF进展,能延缓心肌重构,提高心功能,改善临床症状。且联合治疗并未明显增加药品不良反应,表明其安全性高。
MF是心肌对压力超负荷、炎性反应、氧化应激等的反应,炎性因子在MF进程中发挥了重要作用。TNF-α是一种多功能细胞因子,可通过活性氧中间体的产生而诱导心肌细胞肥大,并通过心肌细胞坏死的形式引起心肌细胞缺失,后由纤维组织修复,导致MF[15]。IL-1β是多效性细胞因子,可通过血小板衍生生长因子(PDGF)诱导刺激成纤维细胞增殖,参与MF进展[14]。NF-κB位于Toll样受体(TLR)下游信号通路,是炎性反应中的关键转录调控因子之一,也是介导TNF-α、血管紧张素Ⅱ(AngⅡ)促心肌成纤维细胞增殖及胶原表达的关键因子[16]。本研究结果显示,两组患者治疗后的血清TNF-α,IL-1β,NF-κB水平均显著低于治疗前,且观察组患者低于对照组(P<0.05),表明吡非尼酮可能通过抑制血清TNF-α,IL-1β,NF-κB的表达而发挥抗MF作用。既往研究证实,吡非尼酮可通过抑制炎性介质表达、减少炎性细胞与中性粒细胞集聚等发挥抗炎作用,抑制脏器组织纤维化程度[17]。
TGF-β1是具有多重生物学效应的生长因子,成纤维细胞、血管平滑肌细胞、内皮细胞等均表达TGF-β1受体,在细胞增殖、分化中发挥着重要调节作用。其在MF中的作用主要为:促进胶原、LN等ECM合成,抑制胶原降解;抑制基质金属蛋白酶-1(MMP-1)的活性,并促进基质金属蛋白酶抑制剂1(TIMP-1)表达;诱导成纤维细胞平滑肌肌动蛋白(SMA)表达,促进肌成纤维细胞形成;趋化单核细胞和巨噬细胞,放大炎症[18]。吡非尼酮可通过下调TGF-β1的表达,减轻肺、肾等器官的纤维化程度[19]。本研究结果显示,两组患者治疗后的血清TGF-β1水平均显著低于治疗前,且观察组显著低于对照组(P<0.05),表明吡非尼酮抑制CHF患者MF的进展可能与抑制TGF-β1过度表达有关。另外,氧化性低密度脂蛋白(ox-LDL)可刺激大鼠心肌细胞分泌TGF-β1,可能在MF进展中发挥重要作用[20]。而吡非尼酮可通过清除自由基、减轻氧化应激、抑制脂质过氧化发挥抗氧化效应,此可能为吡非尼酮抑制TGF-β1表达的作用机制之一。PPARα在心肌组织中呈现高表达,是心肌能量代谢的关键酶,对心肌肥厚发挥负性调控作用,与MF的发生、发展密切相关[21]。本研究结果显示,两组患者治疗后的血清PPARα水平显著高于治疗前,且观察组显著高于对照组(P<0.05),表明吡非尼酮抗MF作用也可能与PPARα的激活有关。但具体作用机制仍有待后续研究进一步论证。
综上所述,吡非尼酮辅助治疗CHF安全有效,可减轻患者的MF,改善心功能,其作用机制可能与调节血清炎性因子TNF-α,IL-1β,NF-κB的水平及TGF-β1和PPARα的表达有关。

