乳腺癌中葡萄糖转运蛋白-1和p53蛋白表达水平与临床病理特征及预后的关系
管洁,戴北飞,何丹,唐磊,姚苗苗
(1.湖南航天医院,湖南 长沙 410006;2.邵阳市中医医院,湖南 邵阳 422000)
乳腺癌发病率、病死率在女性恶性肿瘤中占第一位,且每年以3%~4%速度不断增加,对女性生命健康造成严重威胁。细胞过度增殖与乳腺癌发生、进展关系密切,细胞增殖需大量耗氧,可致细胞缺氧而产生相关蛋白,促使细胞适应低氧环境[1-2]。葡萄糖转运蛋白-1(GLUT-1)属于内源性乏氧标记物,其高表达可使恶性细胞在乏氧环境下获取能量,以快速生长、增殖、转移、侵袭[3]。p53蛋白是重要的肿瘤基因编码蛋白,可影响细胞的低分化,参与细胞错配修复机制的形成,在肿瘤的发生、进展中起重要作用[4]。本研究分析了乳腺癌中p53蛋白、GLUT-1表达水平与临床病理特征及预后的关系,为临床诊治提供新的思路。报告如下。
1 资料与方法
1.1 一般资料
选择2017年1月—2020年9月行手术治疗的64 例乳腺癌患者的乳腺癌组织标本作为乳癌组,取距离癌组织3 cm的癌旁正常组织为癌旁组。患者年龄(57.32±2.46) 岁;病程(3.15±0.21) 年;黏液性囊腺癌2 例,单纯癌35 例,硬癌3 例,侵袭性导管癌15 例,髓样癌2 例,侵袭性小叶癌1 例,乳头状癌3 例,腺癌2 例,导管内癌1 例。纳入标准:经病理组织检查确诊为乳腺癌;病历资料完整。排除标准:严重免疫力低下;精神异常;存在血液系统疾病;术前接受化疗、放疗或生物免疫治疗;合并其他恶性肿瘤。
1.2 方法
连续切片,每例组织蜡块均切成4 μm厚度切片(4 块),用甲醛溶液固定,石蜡包埋、高温灭菌、载玻片泡酸、多聚赖氨酸涂片等处理,DAB显色剂(试剂盒购自北京中杉金桥生物技术有限公司)显色,复染(苏木精),脱水(乙醇),透明(二甲苯),封固(中性树胶),用免疫组化法检测。p53蛋白、GLUT兔多克隆抗体购自美国Epitomics公司。
阳性判断标准:用上海比目仪器厂的光学显微镜(BMD-300E型)观察,GLUT-1定位于细胞膜上,阳性细胞呈棕黄色颗粒状,高倍镜下每个切片选择5 个视野,每个视野内细胞>200 个,阳性细胞≥10%为阳性,反之为阴性。p53蛋白定位于细胞核上,阳性细胞呈棕黄色颗粒状。细胞着色程度:无色为0 分,黄色为1 分,棕黄色为2 分,棕褐色为3 分。阳性细胞百分比:阴性为0 分,阳性细胞<25%为1 分,25%~50%为2 分,>50%~75%为3分,>75%为4分。细胞着色评分与阳性细胞百分比评分乘积≥3 分即为阳性,反之为阴性。
1.3 观察指标
比较两组p53蛋白、GLUT-1阳性表达率;分析p53蛋白、GLUT-1阳性表达与临床病理特征、预后(术后1 年生存率)关系,临床病理特征包含年龄、肿瘤部位、月经初潮年纪、肿瘤直径、肿瘤-淋巴结-转移(TNM)分期、淋巴结转移等。
1.4 统计学方法
采用SPSS21.0系统软件进行统计学分析。计数资料以百分率(%)表示,采用 χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 两组p53蛋白和GLUT-1阳性表达率比较
乳癌组p53蛋白、GLUT-1阳性表达率高于癌旁组,差异有统计学意义(P<0.05)(见表1)。p53蛋白、GLUT-1在乳腺癌组织和癌旁组织中表达情况见图1-4。
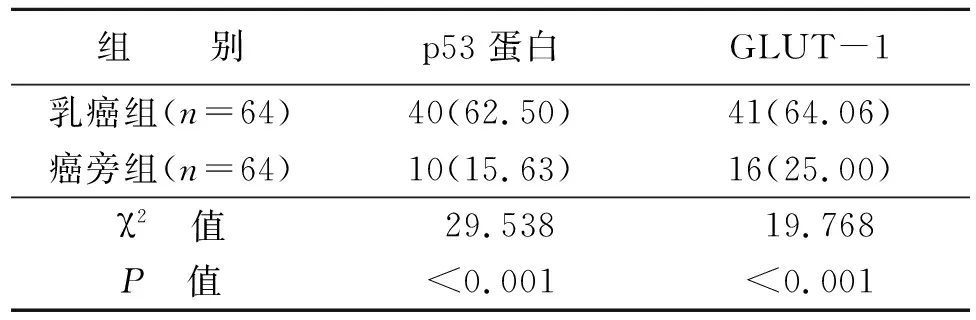
表1 p53蛋白和GLUT-1阳性表达率比较单位:例(%)
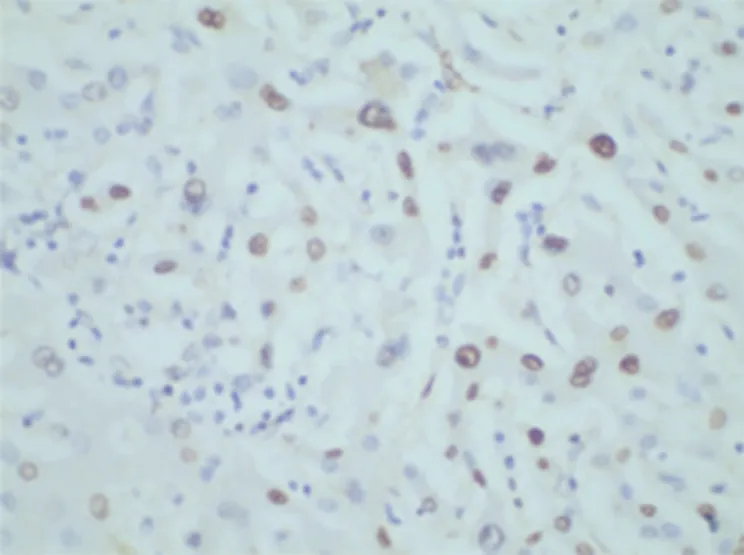
图1 乳腺癌组织p53蛋白阳性表达(SP×500)
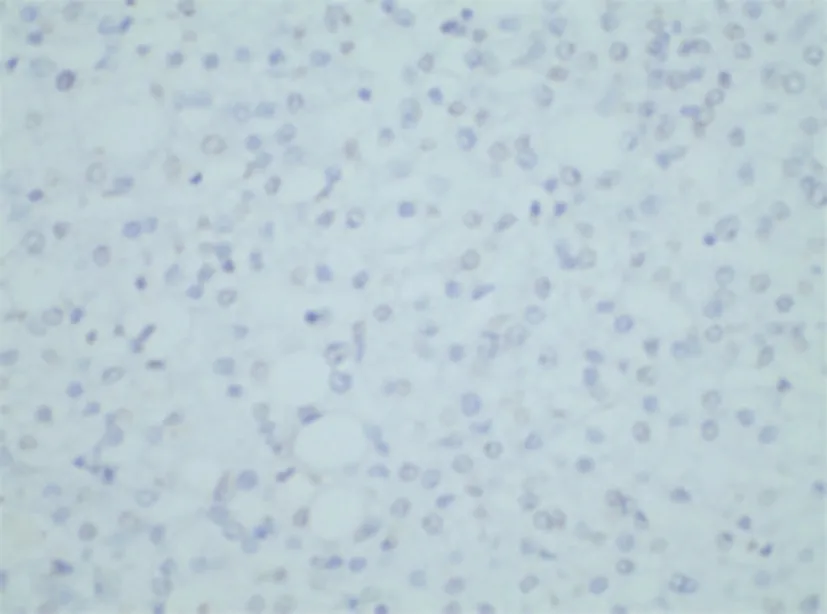
图2 癌旁组织p53蛋白阴性表达(SP×500)
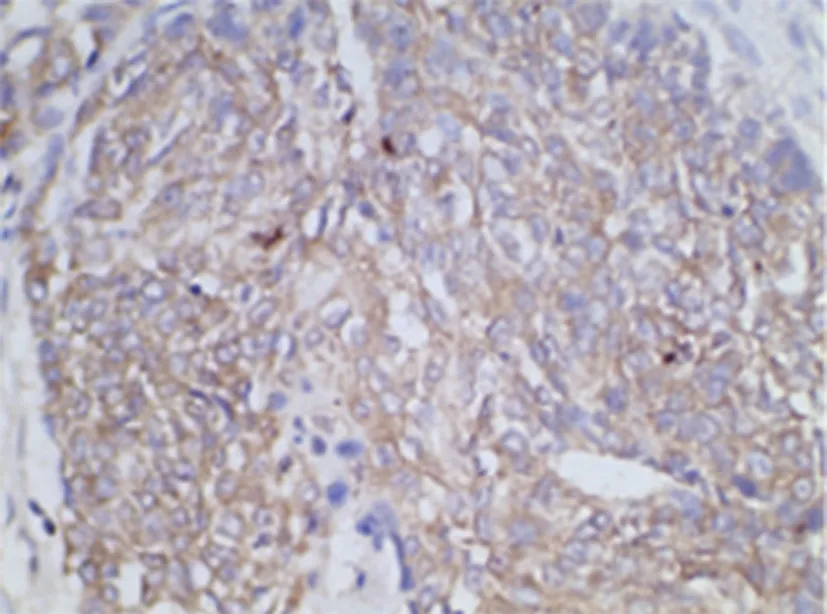
图3 乳腺癌组织GLUT-1阳性表达(SP×500)
图4 癌旁组织GLUT-1阴性表达(SP×500)
2.2 p53蛋白和GLUT-1的表达与乳腺癌患者临床病理特征关系
p53蛋白、GLUT-1阳性表达与乳腺癌TNM分期和淋巴结转移有关,差异有统计学意义(P<0.05);p53蛋白、GLUT-1阳性表达与乳腺癌年龄、月经初潮年纪、肿瘤直径、肿瘤部位无关,差异无统计学意义(P>0.05)(见表2)。
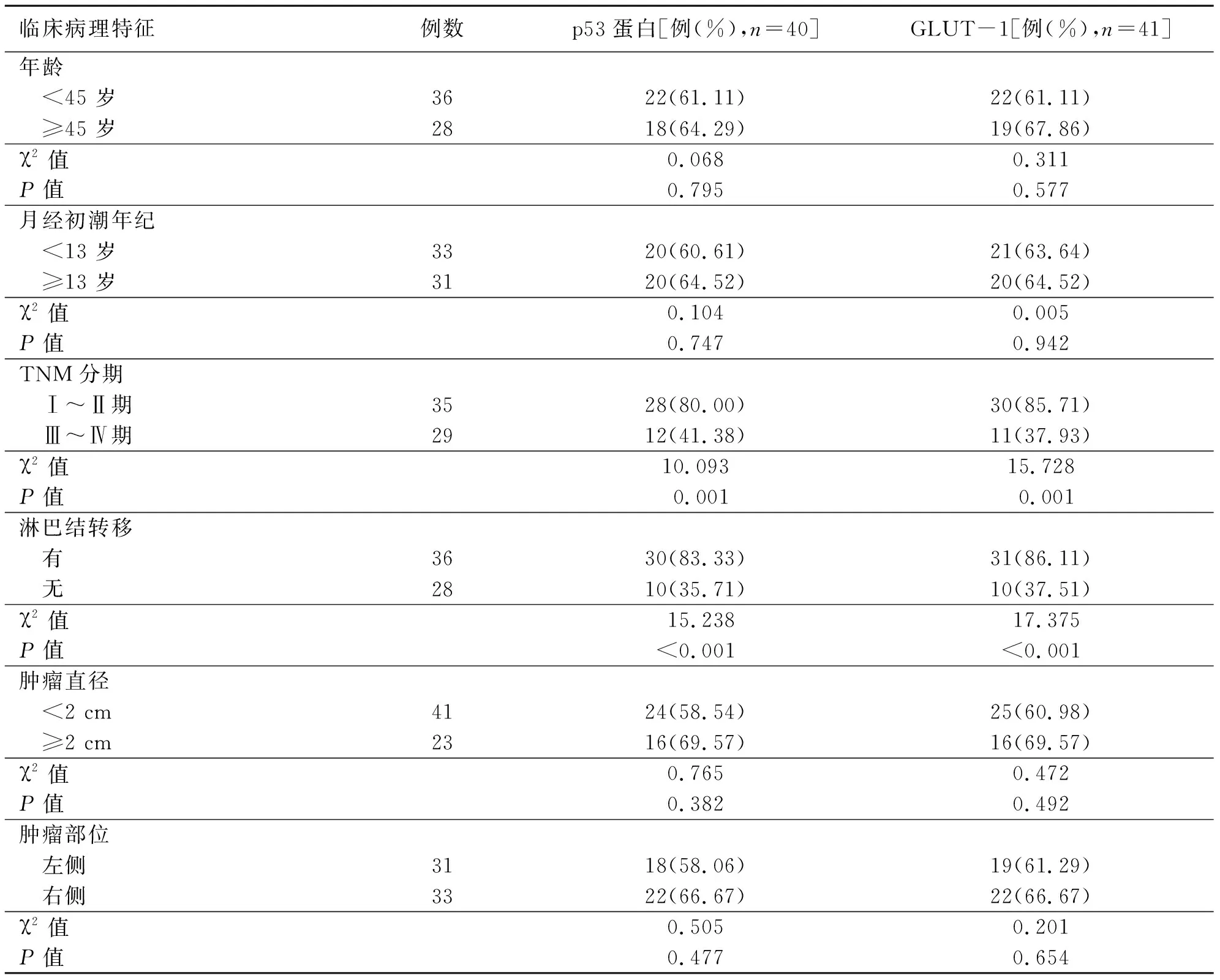
表2 p53蛋白和GLUT-1阳性表达与乳腺癌患者临床病理特征关系
2.3 p53蛋白和GLUT-1阳性表达与乳腺癌预后的关系
乳腺癌患者术后1 年生存率为79.69%(51/64)。p53蛋白阳性表达者术后1年生存率为70.00%(28/40),低于阴性表达者的95.83%(23/24),差异有统计学意义(χ2=4.691,P=0.030);GLUT-1阳性表达者术后1年生存率为70.73%(29/41),低于阴性表达者的95.65%(22/23),差异有统计学意义(χ2=4.218,P=0.040)。
3 讨 论
乳腺癌的发生、进展与抑癌基因、原癌基因的缺失、失活、突变等基因变化关系密切,基因水平异常是恶性肿瘤发生、进展的核心因素,基因表达调控异常或基因突变会增加癌细胞过度扩增风险,促使癌细胞进展[5-6]。
GLUT-1是人体葡萄糖跨膜转运的主要载体,主要在胎盘、细胞膜、血脑屏障中分布,当机体发生恶性肿瘤时,无糖酵解增加,细胞内GLUT-1代谢增强,使GLUT-1呈高表达[7]。p53属于抑癌基因,其中野生型p53基因能调控细胞凋亡、生长,发挥抑癌作用,当转变为突变型p53后,会改变原先抑癌作用,诱导异常基因表达,促使肿瘤发生、进展[8]。本研究结果显示,乳癌组p53蛋白、GLUT-1阳性表达率较癌旁组高;p53蛋白、GLUT-1阳性表达与乳腺癌TNM分期和淋巴结转移有关,且p53蛋白、GLUT-1阳性表达者术后1 年生存率均低于阴性表达者。提示乳腺癌中p53蛋白、GLUT-1呈高表达,其表达水平与肿瘤TNM分期、淋巴结转移和预后密切相关。无限增殖是恶性肿瘤的重要特点,DNA复制期细胞数目明显增加,造成局部微环境处于严重缺氧状态,并可经两条不同途径共同促使GLUT-1过量表达。其中一条途径是氧浓度降低,激活细胞内缺氧诱导因子-1α(HIF-1α),可结合GLUT-1增强子上HIF-lα的DNA结合位点,引起GLUT-1 5′端的增强子序列活化,造成GLUT-1的mRNA过度表达,并促使其产物大量合成。另一条途径是缺氧对线粒体氧化磷酸化形成抑制,可致GLUT-1内在活性改变,还可刺激其由细胞内囊泡内转移至细胞膜,增加GLUT-1 mRNA的稳定性和刺激GLUT-1基因转录[9]。p53是GLUT-1的上游调控因子,能够通过组织特异性对GLUT-1基因转录形成抑制,降低GLUT-1表达,但当p53蛋白出现突变,上述作用则会丧失。乳腺癌发生后机体多伴有p53 DNA结合区突变,影响p53抑制GLUT-1基因引物转录活性,加快葡萄糖代谢,为细胞肿瘤生长提供能量,促使肿瘤进展[10]。
综上所述,乳腺癌中p53蛋白、GLUT-1呈高表达,其表达水平与肿瘤严重程度和预后密切相关。

