赤霉烯酮通过PI3K-Akt信号通路诱导驴支持细胞炎症与细胞凋亡的机制
孙潇,于树涛,孙玉江,张孝忠,张国梁,宋俊霖
(1.青岛农业大学中心实验室,山东青岛 266109,2.青岛农业大学动物科技学院;3.莱阳市动物疫病预防控制中心,山东烟台 265200)
赤霉烯酮 (zearalenone,ZEA ) 是由镰刀菌产生的霉菌毒素,常见于玉米、小麦、燕麦和麦草中,分子式 C18H22O5。ROMER检测中心国内畜禽谷物原料与饲料霉菌毒素检测报告显示[1],大中型饲料与养殖企业采集样品中霉菌毒素的检出比例为95%,青贮饲料中ZEA检出率为65%。有报道表明,动物摄入霉菌毒素后可能会出现腹泻、肠道出血、繁殖性能降低、发育异常等症状[2]。驴误食霉菌毒素后会发生肝出血、脾淤血、肠道积液等病理现象,严重中毒时可能会死亡[3-5]。2019年全国驴存栏量260.1万头[6],产值近千亿元。山东省规模化养驴场存栏量占全省驴存栏总量的80%,同时占全国300头以上规模养殖场的61%[7]。目前,马属动物饲草料中霉菌毒素含量尚未出台国家或者地方标准,然而集约化养驴场的饲草料中ZEA等霉菌毒素含量过高已经成为损害驴繁殖性能的重要原因之一[8-9]。但是,到目前为止此类问题并未引起广泛和足够的重视。因此,探究ZEA等霉菌毒素妨害驴繁殖性能的主要途径与作用机制可制定饲草料中该毒素限量的国家标准,为促进家畜高效繁殖和健康养驴提供理论支持。
PI3K (胞内磷脂酰肌醇激酶,Phosphatidylinositide 3-kinases)参与调节了细胞凋亡、转录等多种细胞内生物过程[10]。PI3K的主要下游效应子是Akt (丝氨酸/苏氨酸特异性蛋白激酶,又称 PKB,protein kinase B),PI3K被激活与磷酸化后引起Akt活化来调节生物过程[11]。Hossini等[12]报道了PI3K/Akt途径异常能够诱导多能干细胞的凋亡。Koh等[13]研究了PI3K/Akt通路参与了细胞的增殖、分化和迁移,细胞内营养因子可以激活PI3K途径,进而促进了Akt1的磷酸化,导致细胞增殖。因此,PI3K-Akt信号分子在细胞凋亡与增殖等多种生物过程中发挥了至关重要的作用。
支持细胞(sertolicells,SCs)在家畜睾丸曲细精管中具有营养、支持、分泌、吞噬等多种功能,是血-睾屏障的重要组成部分之一[14-16]。支持细胞能够分泌多种因子保证精子发生正常进行[17],其异常发育或受损后将会对精子发生产生较为严重的影响[6]。目前为止,国内外有关ZEA暴露引起马属动物繁殖障碍的研究通常是从毒素暴露后影响动物的摄食或流产等现象去解释,而毒素直接作用的靶器官如睾丸,卵巢或子宫等蛋白、基因表达差异却鲜有报道,且ZEA等霉菌毒素的毒性作用机制尚不完全清楚[18-21]。本研究通过采用转录组测序(RNA-seq)方法分析评估了10 μmol·L-1和30 μmol·L-1ZEA在体外培养的驴睾丸支持细胞毒性作用,探讨ZEA通过PI3K-Akt信号通路诱导驴支持细胞炎症与细胞凋亡的分子机制,试验结果将为研究霉菌毒素损害驴睾丸发育的机制和制定马属动物饲草料中ZEA等霉菌毒素的限量标准提供一定的理论借鉴。
1 材料与方法
1.1 主要药品与试剂
赤霉烯酮(Z2125)、牛血清蛋白(BSA)、AnnexinV-FITC/7-AAD凋亡检测试剂盒(APOAC)均购自Sigma-Aldrich®公司(美国);青-链霉素(双抗)混合液(PS,P1400)、DMSO(D8371)、非必需氨基酸(NEAA,N1250)、丙酮酸钠(SP,SP0100)、胶原酶Ⅳ(C8160)、透明质酸酶(H8030)、DNA酶Ⅰ(D8071)均购自Solarbio®公司(北京);FBS(ST30-3302)购自PAN®公司(巴伐利亚);胰酶(SH30042.01)、DMEM/HIGHGLUCOSE(SH300 22.01)购自Hyclone®公司(北京);TUNEL(A113)凋亡检测试剂盒购自南京诺唯赞生物科技有限公司;InvitrogenTRIzol(15596026)购自Thermo Fisher Scientific®公司(美国)。细胞免疫荧光抗体信息见表1。

表1 抗体信息表Table 1 The information of the antibodies
1.2 试验方法
1.2.1 驴睾丸收集与睾丸支持细胞培养处理
取新鲜屠宰的驴(Equusasinus)睾丸,迅速放置于37 ℃含体积分数5%青-链霉素生理盐水的保温杯中,1 h以内运回实验室。使用含体积分数1%青-链霉素的磷酸盐缓冲溶液(phosphate buffer saline,PBS) 清洗驴睾丸,去除多余脂肪与结缔组织。清洗后的组织放入无水乙醇中浸泡10~20 s,使用PBS冲洗3遍,睾丸样品置于无菌操作台上,除去白膜,将剩余睾丸实质剪碎至2~3 mm3小块,去除可见血管和结缔组织,用含双抗的PBS冲洗后移入50 mL离心管中,加入2~3倍体积胶原酶IV(约2 mL)与0.2 mL·L-1透明质酸酶(约2 mL)消化液,用1 mL移液器轻轻吹打混匀,37 ℃消化10~15 min,每隔3~5 min观察曲细精管分散状况;之后将睾丸组织与消化液转移至50 mL离心管,加入相同体积不含FBS的DMEM培养基,1 200 r·min-1离心5 min,弃上清;分别加入2 mL 37 ℃ 预热的0.25 mL·L-1胰酶与10 μg·mL-1DNA酶 I的消化液,37 ℃培养箱消化5~8 min,其间每隔1 min 200 r·min-1震荡一次;加入等体积含体积分数1% FBS的DMEM培养基终止消化;过200目和300目高压灭菌的细胞筛过滤得细胞悬液;细胞悬液1 200 r·min-1离心5 min,加入10 mL含1% FBS的DMEM培养基在体积分数5 % CO2、37 ℃的条件下培养6~8 h,然后更换全液。试验中采用10 μmol·L-1和30 μmol·L-1ZEA连续72 h体外培养并处理支持细胞。
1.2.2 驴睾丸支持细胞纯度鉴定
本研究通过对支持细胞特异表达的SOX 9蛋白,进行细胞免疫荧光染色的方法鉴定支持细胞的分离纯度[22]。采用Image J软件进行计数和统计分析。
1.2.3 TUNEL检测
收集ZEA处理后的支持细胞,使用4 mL·L-1多聚甲醛溶液常温下固定30~40 min,取细胞悬液于多聚赖氨酸处理的载玻片上,涂抹均匀后于42 ℃热台上烘烤2 h左右。PBS洗2~3次,每次5 min。使用1 mL·L-1Triton X-100透化10 min。PBS洗3次,每次5 min,置于湿盒中保持湿润。按照试剂盒说明书对样品进行TUNEL标记,之后使用Hoechst 33342染细胞核,最后每个样品滴加100 μL抗荧光淬灭封片剂,盖上盖玻片,4 ℃干燥避光保存。波长620 nm荧光观察BrightRed红色荧光,波长460 nm荧光观察Hoechst 33342蓝色荧光。
1.2.4 流式细胞仪检测细胞凋亡
收集ZEA处理后的支持细胞,加入4 ℃的PBS后混匀,300 r·min-1离心5 min后弃上清,1×Binding Buffer重悬细胞,调整细胞悬液密度为1 × 106个·mL-1。设置阴性对照组、单染对照组、对照组和试验处理组。每组取100 μL细胞悬液,加入5 μL的7-AAD和Annexin V-FITC,轻轻吹打混匀,25 ℃避光孵育15 min。最终加入400 μL 1×Binding Buffer终止反应,上机检测。
1.2.5 RNA提取和转录组分析
每个样本使用1 mL Invitrogen TRIzol裂解收集大约1×107个细胞,7 500 r·min-14 ℃离心5 min。上下颠倒混匀后室温放置10 min。12 000 r·min-14 ℃离心10 min,弃上清。加1 mL体积分数75 % DEPC水配置酒精。短暂涡旋后7 500 r·min-14 ℃离心5 min,弃上清,风干10 min。加30 μL DEPC水溶解RNA。RNA测序由Novogene使用Hiseq 4000平台进行,每组至少3个生物学重复。
1.2.6 差异表达基因的数据预处理和鉴定
测序数据分为对照组(CTRL)、10 μmol·L-1处理组(低浓度处理组)、30 μmol·L-1处理组(高浓度处理组),使用NovoMagic平台对支持细胞进行分析、富集并筛选差异表达基因(differential expression genes,DEGs)。使用DEseq2软件检测差异表达基因,设置参数为| log 2 FoldChange|>1,P<0.05。使用NovoMagic平台对DEGs进行差异表达分析和功能富集分析。
1.2.7 细胞免疫荧光染色
收集驴支持细胞,体积分数4%多聚甲醛溶液固定1 h。吹打混匀细胞悬液滴加在多聚赖氨酸处理过的载玻片上,于42 ℃热台上烤1.5 h。PBS洗3次,每次4 min。PBST溶液透明10 min,PBS洗1遍。在细胞区域滴加等体积封闭液,室温封闭1 h。细胞样品区域加50 μL一抗(使用封闭液稀释),湿盒内4 ℃过夜孵育。随后将样品置于室温30 min进行复温。用含体积分数1% BSA的PBS洗3次,每次3 min。滴加100 μL二抗,37 ℃避光孵育1 h。PBS洗3次,每次5 min。使用10 μg·mL-1Hoechst 33342染核2 min,PBS洗1遍。滴加抗荧光衰减封片剂,盖盖玻片,4 ℃干盒中避光保存。使用Image J软件进行阳性细胞计数。荧光二抗为:山羊抗兔AlexaFluor594-IgG和山羊抗兔AlexaFluor488-IgG。以上试验3次重复。
1.3 数据处理与分析
本研究使用GraphPad Prism 9软件进行统计学分析,对照组和处理组之间的差异分析使用双尾t检验的方法,若P<0.05时,认为有统计学差异,用*表示,若P<0.01时,认为有显著统计学差异,用**表示。
2 结果与分析
2.1 体外分离培养驴支持细胞纯度检测结果
为检测分离培养驴支持细胞的纯度,本鉴定方法为利用细胞免疫荧光染色测定支持细胞特异蛋白SOX 9的表达[22-23]。统计SOX 9阳性数与细胞核染色 Hoechst 33342数量的比率(图1B),最终计算驴支持细胞占培养细胞总数的比例。结果显示,SOX 9蛋白在分离培养的驴睾丸支持细胞内均呈现正常定位 (图1A),阴性对照 (驴成纤维细胞) 观察到荧光信号 (图1A)。结果显示了支持细胞的分离纯度。
2.2 ZEA处理导致驴支持细胞的凋亡增加
体外培养的驴支持细胞使用10 μmol·L-1和30 μmol·L-1浓度ZEA连续处理72 h (图1C)。TUNEL检测结果显示:ZEA暴露可能导致驴支持细胞显著凋亡 (图2A、2B)。TUNEL阳性率为:对照组为5.17%±0.72%;10 μmol·L-1ZEA处理组为14.77%±0.91%;30 μmol·L-1ZEA处理组为23.59%±1.15%,结果与ZEA处理浓度的升高呈正相关。流式细胞仪检测结果显示:ZEA连续处理72 h后,10 μmol·L-1ZEA处理组凋亡率可达8.06%±0.06%,30 μmol·L-1处理组凋亡率达到14.22%±0.09% (图2C)。以上结果表明ZEA可能诱导驴支持细胞凋亡。
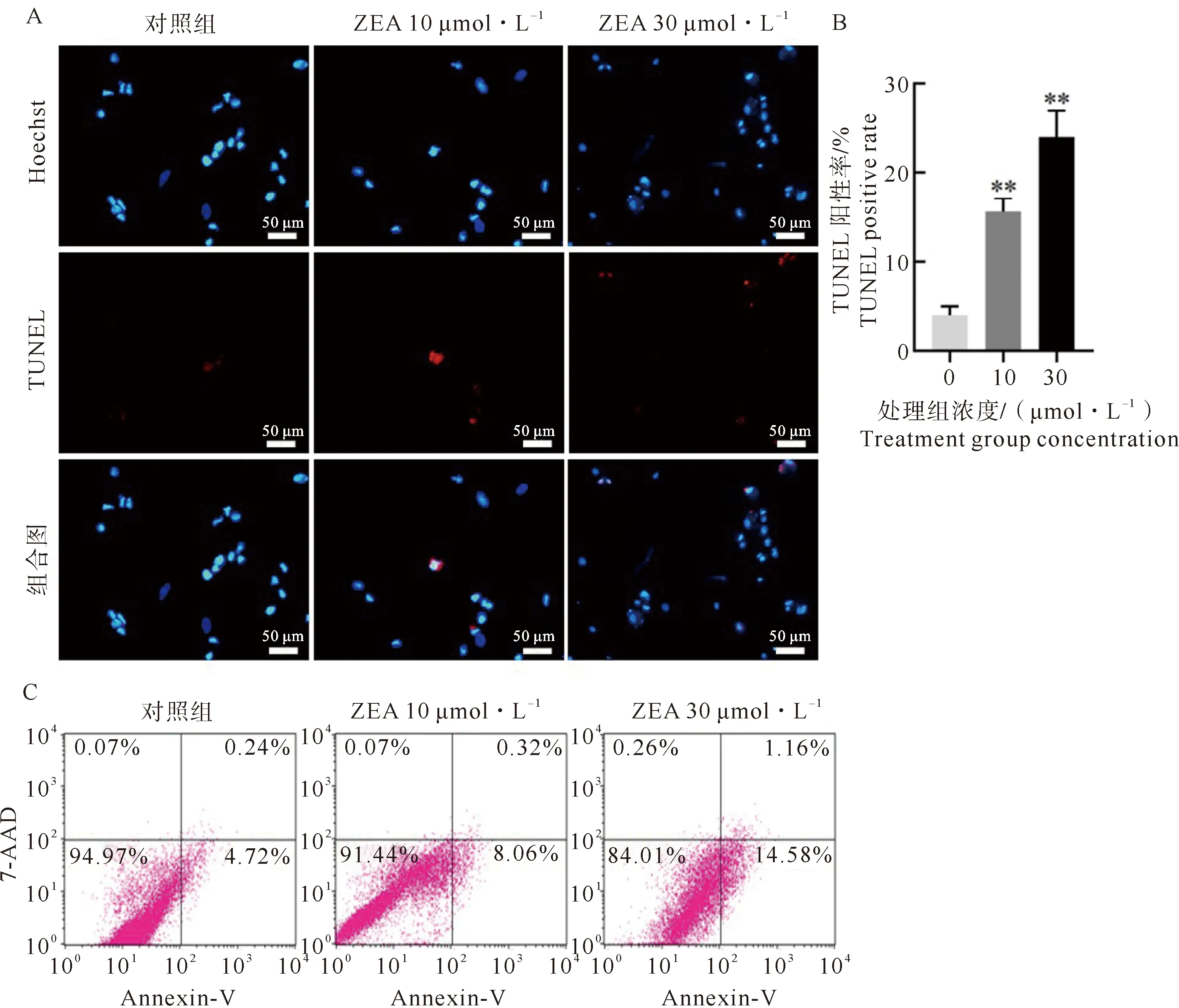
A.TUNEL (红)和Hocehst 33342 (蓝)染色检测结果,标尺:50 μm;B.TUNEL阳性率统计图;C.流式细胞检测结果。图2 10 μmol·L-1和30 μmol·L-1 ZEA诱导驴支持细胞72 h TUNEL、流式凋亡检测结果Fig.2 The results of TUNEL and flow cytometry apoptosis detection of E. asinus sertoli cells treated by 10 μmol·L-1 and 30 μmol·L-1 ZEA for 72 h
2.3 ZEA暴露改变了驴支持细胞基因表达模式
RNA-seq结果(图3A)显示:与对照组相比较,在10 μmol·L-1处理组检测到803个差异表达基因,其中上调差异表达基因共391个,下调差异表达基因共412个;30 μmol·L-1处理组检测到5 947个差异表达基因,其中上调差异表达基因共2 816个,下调差异表达基因共3 131个。与10 μmol·L-1ZEA处理组相比较,在30 μmol·L-1ZEA处理组中共检测到5 218个差异表达基因,其中上调差异表达基因共2 407个,下调差异表达基因共2 811个(图3B)。VENN分析结果显示30 μmol·L-1ZEA处理组差异基因与10 μmol·L-1ZEA处理组差异基因存在显著差异(图3C)。因此,30 μmol·L-1ZEA处理组与10 μmol·L-1ZEA处理组支持细胞基因表达模式差异显著。

A.ZEA 处理驴支持细胞差异表达基因火山图;B.柱状图表示差异表达基因数目,红色表示上调,绿色表示下调;C.VENN图显示对照组与ZEA处理组之间的差异基因个数。图3 ZEA处理影响驴支持细胞基因表达模式Fig.3 The effect of ZEA treatment on gene expression of E. asinus sertoli cells
2.4 差异表达基因功能富集分析
为分析ZEA不同处理组差异表达基因的功能,分别将10 μmol·L-1ZEA 与30 μmol·L-1ZEA处理组中的差异表达基因进行Kyoto Encyclopedia of Genes and Genomes(KEGG)信号通路富集分析,设置P<0.05的标准筛选差异表达基因显著性高的信号通路(图4)。结果显示:10 μmol·L-1ZEA 处理影响的生物进程有cell cycle(细胞周期)、p53信号通路等 (图4A),30 μmol·L-1ZEA处理影响的生物进程有PI3K-Akt信号通路、MAPK(丝裂原活化蛋白激酶)信号通路、Ras信号通路、Apoptosis(程序性细胞死亡)以及TNF(肿瘤坏死因子)信号通路等 (图4B)。下调的信号通路包括PI3K-Akt信号通路 (P=0.001 458 6,计数:22)、类固醇合成途径 (P=0.007 337 7,计数:10)、细胞周期 (P=0.006 938 9,计数:21)等信号通路。
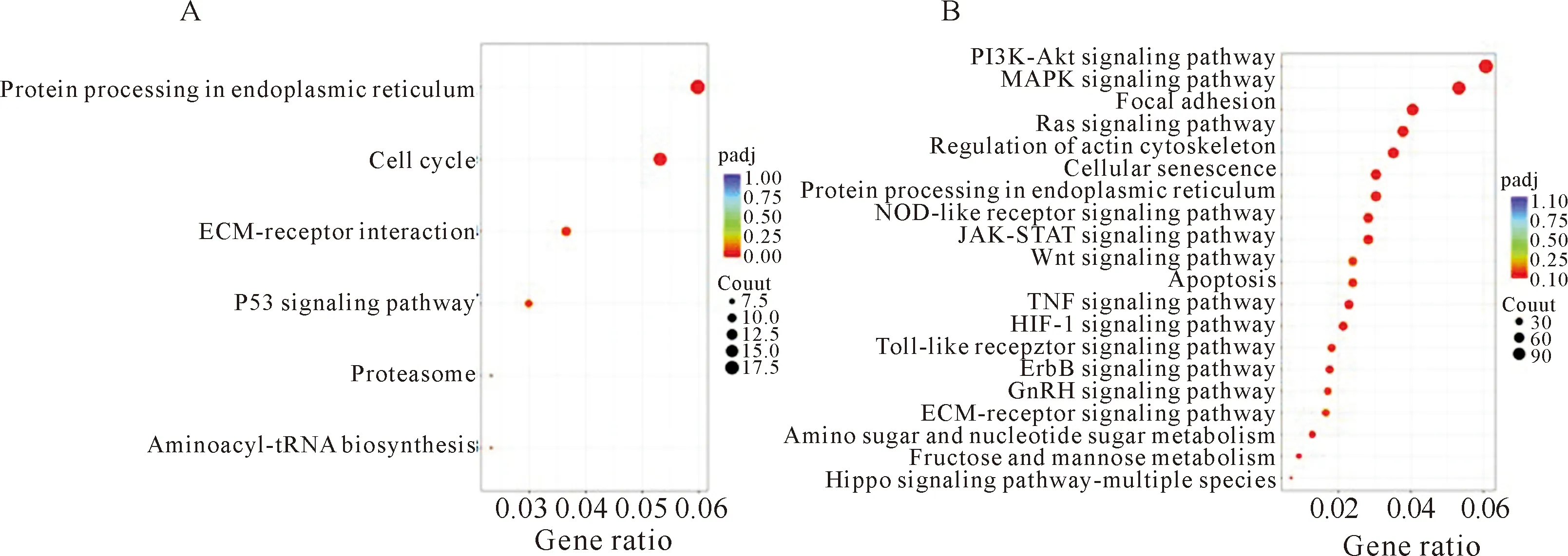
A.10 μmol·L-1 ZEA处理组DEGs KEGG信号通路富集分析气泡图;B.30 μmol·L-1 ZEA处理组DEGs KEGG信号通路富集分析气泡图。图4 对 10 μmol·L-1 ZEA 与 30 μmol·L-1 ZEA处理组驴支持细胞差异表达基因进行KEGG信号通路富集分析结果Fig.4 The results of KEGG signal pathway enrichment analysis on the differential genes expression of E. asinus sertoli cells in 10 μmol·L-1 and 30 μmol·L-1 ZEA treatment group
2.5 ZEA诱导驴支持细胞炎症反应并影响类固醇激素受体基因表达
对差异基因数据进一步分析,结果显示:白介素-10受体因子A (IL 10 RA) 在ZEA处理组中表达量与对照组相比显著升高;差异基因雌激素受体1 (ESR1) ZEA处理组中表达量与对照组相比显著升高。为了验证该分析结果,我们使用细胞免疫荧光检测ZEA处理后的驴支持细胞中炎症反应与类固醇激素受体相关差异基因蛋白表达量的变化。结果表明,ZEA处理组显著提高了支持细胞白介素-10受体因子A (IL 10 RA) 蛋白的相对表达水平(图5)。细胞免疫荧光结果显示,支持细胞中ESR 1蛋白表达趋势与转录组数据相一致 (图6)。
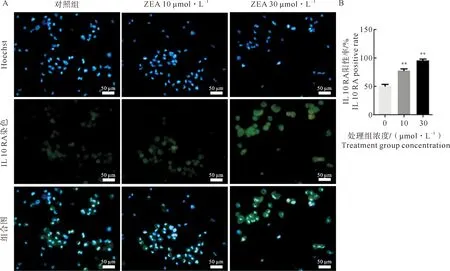
A.10 μmol·L-1 和30 μmol·L-1 ZEA处理组细胞免疫荧光检测IL 10 RA的表达 (绿色);B.IL 10 RA蛋白阳性表达统计。图5 细胞免疫荧光检测ZEA影响驴支持细胞IL 10 RA蛋白的表达Fig.5 The effect of ZEA on IL 10 RA protein expression of E. asinus sertoli cells by ICC
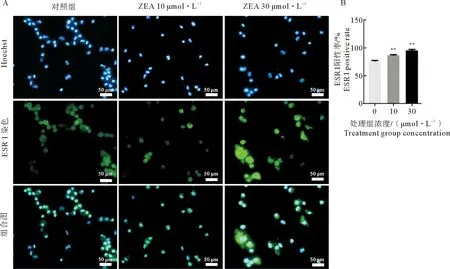
A.10 μmol·L-1 和30 μmol·L-1 ZEA处理组细胞免疫荧光检测ESR 1的表达 (绿色);B.ESR 1蛋白阳性表达统计。图6 细胞免疫荧光检测ZEA影响驴支持细胞ESR 1蛋白的表达Fig.6 The effect of ZEA on ESR 1 protein expression of E. asinus sertoli cells by ICC
3 讨论
我国是全球唯一具备驴养殖、屠宰、加工及销售等全产业链国家[24]。近年来,驴的功能与作用由役用逐步向肉用、药用保健等多用途的“活体经济”方向转型,且驴的饲养逐步向集约化养殖方向转变。饲料中的霉菌毒素特别是ZEA污染已严重影响规模化饲养中驴的繁殖性能。本研究使用10 μmol·L-1和30 μmol·L-1浓度的ZEA连续72 h暴露体外培养的驴支持细胞,利用RNA-seq的手段分析并探讨ZEA损害驴支持细胞发育并导致其凋亡的机制,采用TUNEL检测、细胞免疫荧光与流式细胞检测的方式验证了ZEA诱导驴支持细胞炎症反应和细胞凋亡的分子机制。
流式细胞检测和TUNEL标记结果显示30 μmol·L-1浓度的ZEA处理显著高于10 μmol·L-1驴支持细胞凋亡率,该结果与廖美芳[25]利用ZEA处理IPEC-J2细胞诱导凋亡结果一致,也与利用ZEA诱导猪巨噬细胞凋亡的结果一致[26]。以上结果说明ZEA支持细胞发挥毒性作用具有呈剂量依赖性的特点。PI3K-Akt信号通路参与了多种生理过程,如细胞生长、增殖、运动和代谢等[27],还可能与多种类型细胞的炎症反应与癌变息息相关[28]。本研究结果显示:ZEA处理支持细胞通过PI3K-Akt信号通路影响了与细胞周期相关的基因表达:CDK1和CCNB1基因的mRNA表达量均显著提高[29];KEGG富集分析结果显示,30 μmol·L-1的ZEA处理组DEGs多富集在Hippo信号通路,该结果与Zhang等[30]报道结果相符。另有研究表明,ZEA暴露可影响糖酵解过程,进而干扰大鼠支持细胞内乳酸合成,并可能影响雄性大鼠的繁殖机能。本试验结果表明,ZEA处理后支持细胞内PGK1和PFKM基因mRNA相对表达量显著提高,这表明ZEA暴露可能导致驴支持细胞内糖酵解进程加快,支持细胞内物质与能量代谢发生异常,进而可能促进细胞的炎症反应的发生或肿瘤的形成。
肿瘤的形成与发展和细胞周期异常密切相关[31-32]。ZEA处理后支持细胞KEGG分析结果显示其细胞周期通路相关基因的表达显著异常 (图4)。这一结果说明ZEA可能通过影响细胞周期通路内相关基因的表达,导致驴支持细胞基因表达模式改变,最终可能增加家畜睾丸癌变的风险。有报道表明[33],LIN28A基因是睾丸内肿瘤发生的标记基因。另外,GADD45B基因在多种肿瘤中均被检测到过表达,该基因参与调控细胞生存,DNA损伤修复、细胞周期停滞,并与肿瘤转移现象密切相关[34]。结果显示,ZEA处理后,支持细胞LIN28A、GADD45B基因的mRNA表达量均显著升高,这说明ZEA具有导致支持细胞发生癌变风险的可能。KEGG分析结果得知,ZEA可引起IL17信号通路、T细胞受体信号通路等炎症相关信号通路上调。此外,KEGG结果显示ZEA显著下调细胞代谢及DNA复制相关信号通路 (图4),诸如半胱氨酸和蛋氨酸代谢、谷胱甘肽代谢、DNA复制、同源重组等。这些结果表明ZEA可能引起驴睾丸支持细胞的炎症反应 (图5),并干扰细胞正常代谢和DNA复制,但其机制有待进一步研究。
支持细胞能够合成并分泌多种激素[35]。磷酸戊糖途径在支持细胞中较为活跃,该途径可提供胆固醇、类固醇激素等合成所需的能量因子如NADPH+H+[36]。G6PD是该途径氧化反应阶段的限速酶,能催化葡萄糖-6-磷酸形成6-磷酸葡萄糖酸-δ-内脂,进一步使NADP+还原形成NADPH+H+[37]。另外,关键酶DHCR24可进一步催化合成胆固醇[38]。KEGG结果表明,ZEA显著影响了磷酸戊糖途径和类固醇生物合成途径相关基因的表达。由此可知,ZEA可能通过PI3K-Akt信号通路抑制磷酸戊糖途径,降低NADPH+H+的合成进而影响驴支持细胞类固醇激素的合成,且ZEA处理后支持细胞ESR1基因的蛋白表达显著升高 (图6)。因此,ZEA可能通过干扰类固醇或受体合成途径影响睾丸的发育及家畜的繁殖性能。
总之,本研究首次利用RNA-seq手段分析探究了ZEA暴露改变驴支持细胞基因表达模式的毒性作用,该毒性作用具有呈剂量依赖性的特点。此外,ZEA暴露导致支持细胞凋亡增加,类固醇激素受体表达异常。且ZEA暴露可能通过影响支持细胞中凋亡和类固醇激素受体合成等过程关键基因的表达,直接或间接影响了睾丸发育和激素受体合成等生物学过程。30 μmol·L-1ZEA暴露能够诱导驴支持细胞的炎症反应,进而可能损害驴睾丸发育和诱导睾丸病变的潜在危害;另外,相同剂量ZEA暴露下,支持细胞存在被致癌的可能性。本研究将为国家或地方制定马属动物饲草料中ZEA含量标准提供理论借鉴,并对研究ZEA等霉菌毒素影响家畜睾丸发育提供新的研究思路。

