特发性肺纤维化患者支气管肺泡灌洗液及血清可溶性细胞粘附分子-1、基质金属蛋白酶-2表达水平及临床意义
杨晓兰,孙 莉,胡永波,张艳秋,廖 平,贺 凡
(成都市第三人民医院 a.入院处;b.神经内科;c.呼吸科;d.放射科,四川 成都 610000)
特发性肺纤维化(idiopathic pulmonary fibrosis,IPF)为一种慢性、进行性纤维化肺部疾病,最终可导致呼吸衰竭甚至死亡[1,2]。现今,临床医师多根据患者临床表现、高分辨CT(HRCT)、支气管肺泡灌洗(bronchoalveolar lavage fluid,BALF)等对IPF进行诊断[3]。但鉴于IPF临床表现复杂,部分患者的CT表现不典型,其他间质性肺病也可出现与IPF相同或类似的表现,故高分辨CT在诊断该病上具有一定的局限性[4]。当前对于IPF的诊断、进展监测以及预后判断等相关研究在临床中颇受关注。目前认为,多种细胞因子在肺损伤、修复及纤维化形成过程中异常表达,参与肺纤维化的启动和发展。可溶性细胞粘附分子-1(sICAM-1)作为L1细胞黏附分子(L1-CAM)的可溶性形式,可参与免疫应答、血管内皮活化,目前已被证实在肺部疾病诊断中发挥一定作用[5]。基质金属蛋白酶(matrix metalloproteinase,MMP)为Ⅱ型肺泡上皮细胞产生的一种内肽酶,在正常组织中表达水平极低,其亚型基质金属蛋白酶-2(MMP-2)可在肺癌等疾病中检测到[6]。目前很少有报道表明二者在IPF发病机制中是否同等发挥重要作用。本研究检测IPF患者BALF和血清中sICAM-1、MMP-2的表达水平,分析其与肺功能的关系。
1 资料与方法
1.1 一般资料2018年8月至2020年8月我院收治的IPF患者118例(IPF组)及同期健康体检者63例(对照组)。纳入标准:①IPF患者均符合IPF诊断[7],经影像学检查确诊;②其他病因所致的间质性肺炎;③意识清楚,可正常语言沟通。排除标准:①气道分泌物过多,无法行BAL者;②恶性肿瘤;③合并传染性疾病;④语言、认知等障碍;⑤就诊前4周内有呼吸道感染。入组者均知情同意,本研究已经医院伦理委员会批准。
1.2 方法BAL与血清留取[8]:术前4 h禁食,局部麻醉后经鼻腔插入将纤维支气管镜,向选定右肺中叶或左肺舌叶或其他病变部位注入0.9%氯化钠溶液100 ml,采用负压吸引装置吸引(25~100 mmHg)、回收BALF,回收率中叶、舌叶40%~60%,其他病变>30%,使用无菌纱布过滤,装入硅胶灭菌器-80 ℃备用。另取患者空腹静脉血2 ml,取上清液-80 ℃待测。采用酶联免疫法(ELISA)测定BALF和血清中sICAM-1、MMP-2表达(试剂盒购自上海西唐生物科技有限公司)。肺功能评价采用Muller对IPF组患者进行胸部高分辨率CT(HRCT)评分[9]。0分无改变;1分:病变范围≤5%;2分:病变范围6%~25%;3分:病变范围26%~50%;4分:病变范围51%~75%;5分:病变范围>75%。
1.3 观察指标①IPF组和对照组一般资料。②以患者临床、实验室指标作为暴露因素,分析各因素是否与IPF存在关联。③根据美国GAP(gender)分期标准[10]对IPF组患者进行疾病严重度分期,GAP0~3分为Ⅰ期,4~5分为Ⅱ期,6~8分为Ⅲ期。比较不同疾病分期IPF患者BALF和血清中sICAM-1、MMP-2表达水平。④分析IPF患者BALF和血清中sICAM-1、MMP-2表达水平与肺HRCT评分的关系。
1.4 统计学方法应用SPSS 19.0统计学软件对数据进行分析。计量资料以均数±标准差表示,比较行t检验或单因素方差分析,两两比较行LSD-t检验;计数资料以(%)表示,比较行χ2检验;影响IPF发生的危险因素采用多因素Logistic分析;BALF和血清中sICAM-1、MMP-2表达水平与HRCT评分间的关系采用Pearson相关性分析。检验水准α=0.05。
2 结果
2.1 IPF组与对照组临床基线资料比较IPF组与对照组性别、BMI、糖尿病、高血压、高脂血症等比较差异无统计学意义(P>0.05); IPF组年龄、吸烟比例高于对照组(P<0.05)。见表1。

表1 两组临床基线资料比较
2.2 IPF组与对照组BALF和血清中sICAM-1、MMP-2表达水平比较IPF组BALF和血清中sICAM-1、MMP-2表达水平均高于对照组(P<0.05)。见表2。

表2 两组BALF和血清中sICAM-1、MMP-2表达水平比较
2.3 影响IPF发生的危险因素分析年龄≥60岁、有吸烟史、BALF和血清中sICAM-1、MMP-2表达是IPF发生的独立危险因素(P<0.05)。见表3。
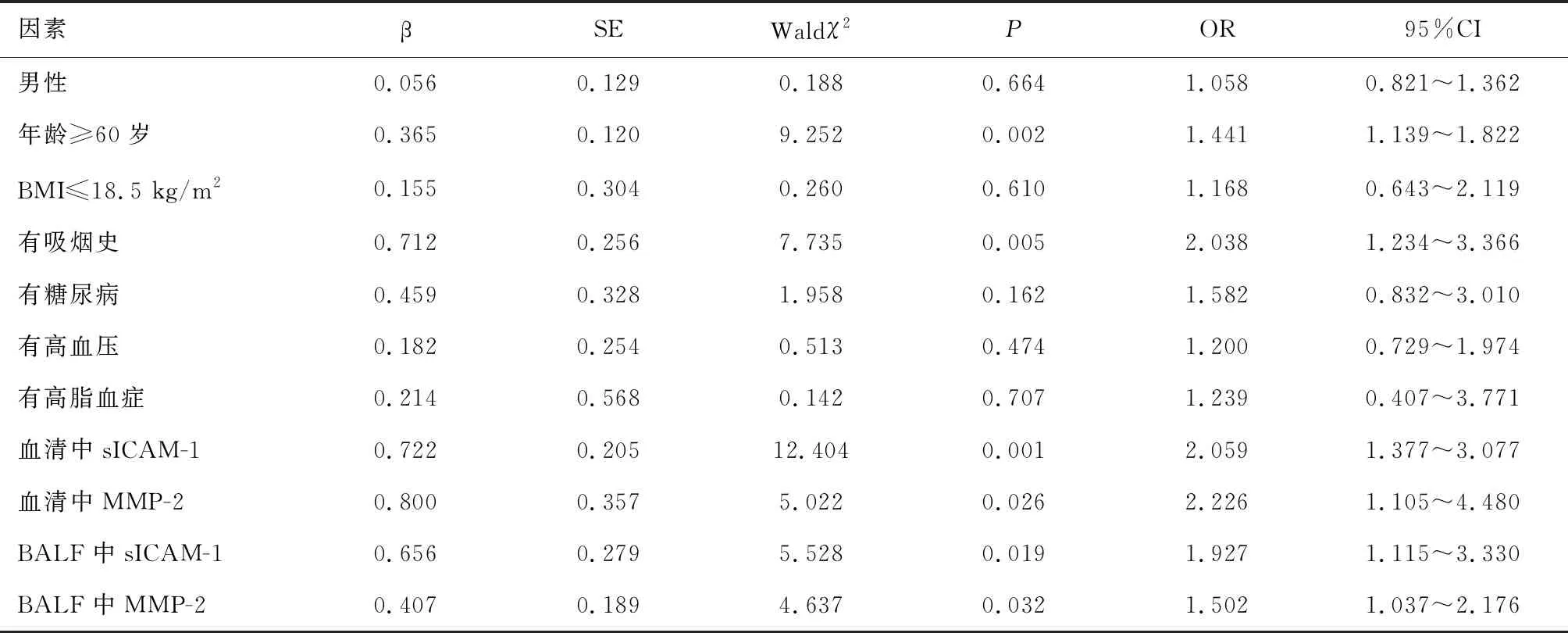
表3 影响IPF发生的危险因素分析
2.4 不同疾病分期IPF患者BALF和血清中sICAM-1、MMP-2表达水平比较根据GAP分期标准将IPF患者分为Ⅰ期38例,Ⅱ期47例,Ⅲ期33例。Ⅲ期IPF患者BALF和血清中sICAM-1、MMP-2表达高于Ⅱ期、Ⅰ期患者(P<0.05)。见表4。
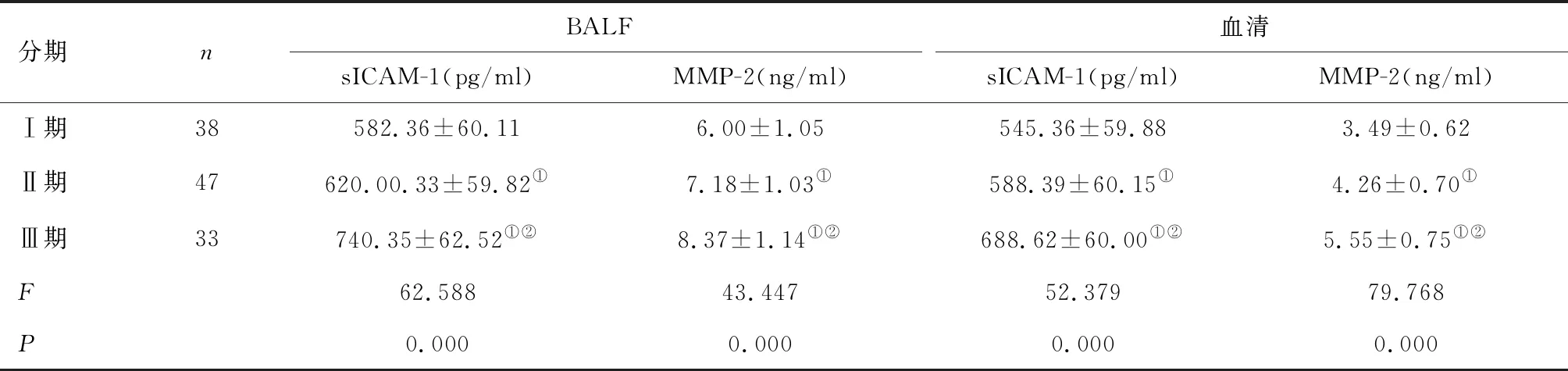
表4 不同疾病分期IPF组患者BALF和血清中sICAM-1、MMP-2表达水平比较
①与Ⅰ期比较,P<0.05;②与Ⅱ期比较,P<0.05
2.5 IPF患者BALF和血清中sICAM-1、MMP-2表达水平与肺HRCT评分的关系IPF患者的HRCT评分为(8.28±2.48)分。其BALF和血清中sICAM-1、MMP-2表达水平均与HRCT评分呈正相关(P<0.05)。见表5。
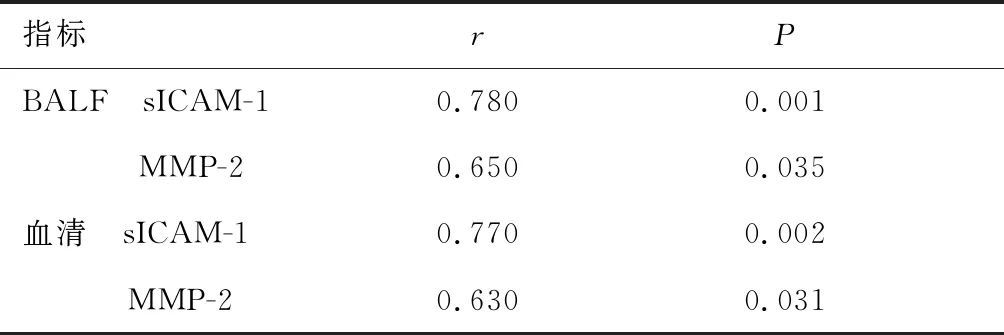
表5 IPF患者BALF和血清中sICAM-1、MMP-2表达水平与肺HRCT评分的关系
3 讨论
sICAM-1为LI-CAM的可溶性形式,其分布较为广泛,黏附分子在细胞表面脱落并溶解在血液中,能够介导细胞间或细胞外基质(Extracellular matrix,ECM)之间的联合,侧面反映肺部疾患的进展情况[11]。本研究中,与对照组相比,IPF组BALF和血清中sICAM-1表达水平均较高,提示IPF患者BALF和血清中存在sICAM-1水平表达异常的情况。此前有学者测定了IPF、肺癌以及慢性咳嗽患者BALF及其血清中sICAM-1的水平,发现IPF患者BALF及其血清中sICAM-1的水平明显高于肺癌以及慢性咳嗽患者,提示sICAM-1可能参与IPF的发病机制,并有可能成为IPF的诊断性标志物[12]。在如今IPF的临床研究中,注意力已从炎症反应转移到肺泡上皮损伤和ECM过度沉积[13]。Grigorieva等[14]认为,尽管IPF的原发病因存在较大的差异,但病情进展中出现的ECM代谢异常大体是类似的。MMP是一类可以合成和降解ECM的蛋白水解酶。近年研究显示,其家族成员MMP-2、MMP-9在多种肺部疾病中均呈高表达,且与肺组织纤维化有关联[15]。MMP-2的特异性底物主要是Ⅳ型胶原,在IPF的病理过程中,MMP-2可通过分解Ⅳ型胶原降解肺基质成分,破坏肺基膜结构和肺泡壁的完整性,引起肺纤维化改变。张娟娟等[16]研究表明,肺组织内MMP-2的高表达是发生IPF的重要机制。本研究中,与对照组相比,IPF组BALF和血清中MMP-2表达水平均较高,提示MMP-2表达的异常升高与IPF疾病的发生发展有关。
IPF的病因尚未完全明确,可能与遗传、吸烟、职业暴露、微生物感染等有关。本研究结果显示,年龄≥60岁、有吸烟史、BALF和血清中sICAM-1、MMP-2过度表达是IPF的危险因素,或许可作为预测IPF的特异性敏感标志物,但其中的因果关系仍不清晰,有待后期进一步研究。另外,随着疾病分期的加重,IPF患者BALF和血清中sICAM-1、MMP-2表达水也存在差异,其中Ⅲ期IPF患者其BALF和血清中sICAM-1、MMP-2表达水平均高于Ⅱ期、Ⅰ期患者。在受到炎症因子的刺激时,机体MMP-2水平增高,加速ECM分解,使炎症细胞向深层组织浸润,随着病情进展,成纤维细胞增多,基质金属蛋白酶抑制剂(TIMPs)和MMP-2分泌增多,进而导致MMP/TIMPs比例逐渐下降,在肺部形成不益于ECM降解的微环境,肺泡间质胶原过度沉积,加速肺纤维化进展,改变疾病分期,加重患者病情[17,18]。
胸部影像学表现以及肺功能与间质性肺病严重程度关系密切,临床上常将其用作疾病转归的评价指标[19]。但肺功能测定对于早期和亚临床损害该项检测并不敏感,难免有漏诊、误诊病例。在2011、2018版IPF诊治指南中,临床已认可肺HRCT在IPF诊断、病情严重程度评估、指导治疗中的重要价值[20]。张颖等[21,22]证明,HRCT比肺功能可以更为敏感地发现肺间质疾患,并在IPF患者后续随访与控制治疗方面价值较为突出。刘曦等[23]研究亦表明,HRCT评分对急性肺损伤(ALI)的病情评估有重要价值。本研究根据IPF患者的胸部HRCT影像学特征,对其行HRCT量化评分,发现IPF患者BALF及血清中sICAM-1、MMP-2表达分别与HRCT评分呈正相关,提示BALF和血清中sICAM-1、MMP-2表达水平能够反映IPF患者肺损伤程度,表现为BALF和血清中sICAM-1、MMP-2表达水平越高,IPF患者的HRCT评分越高,提示患者肺病病灶范围越广,肺功能受损越严重,sICAM-1、MMP-2这两项指标能够提示IPF患者的疾病分期情况,有利于临床医师准确把握患者疾病进展,方便后续治疗的行进。

