剔除目标成分的丹参注射液对大鼠嗜碱性粒细胞白血病细胞和大鼠过敏反应的影响
颜 倩,曹佩琳,刘 奕
(四川省医学科学院·四川省人民医院口腔科,四川 成都,610072)
口腔黏膜下纤维化(oral submucosa fibrosis,OSMF)是一种慢性、隐匿性疾病,以口腔和口咽部黏膜下纤维化为特征[1]。据报道,丹参注射液对OSMF具有一定的治疗作用[2]。丹参注射液是由Radix S miltiorrhiza的提取物制成,具有抗氧化、抗炎、抗血凝、抗血栓、抗肿瘤、免疫增强以及抗纤维化等作用[3]。丹酚酸A、丹酚酸B和丹参酮IIA是丹参注射液的重要活性化合物。这三种活性化合物在体外都有很好的抗纤维化活性[4]。然而,丹参注射液可引起速发型超敏反应[4]。因此,降低丹参注射液在OSMF治疗过程中引起的过敏反应对OSMF的治疗效果具有重大意义。本研究于2021年10月至2022年3月通过核酸适体技术剔除丹参注射液中的目标成分,以期降低大鼠和嗜碱性粒细胞白血病(RBL-2H3)细胞的过敏反应。
1 材料与方法
1.1 实验动物SD大鼠(雄性,SPF级)购买于南方医科大学实验动物中心,许可证号SCXK(粤)2021-0041。大鼠被分开养在笼子里,温度为(23±2)℃,湿度为55%。动物实验是在四川省人民医院动物护理和使用委员会的机构准则下进行的[伦审(研)2022年第226号]。
1.2 主要试剂大鼠嗜碱性粒细胞白血病细胞(RBL-2H3)购于ATCC;MEM培养液和胎牛血清(FBS)购自于美国Gibco公司;p-anti-p38、p-cJNU、p-Syk和GAPDH抗体购自Abcam公司;DNP-BSA抗原和DNP特异性IgE购自美国Sigma-Aldrich公司;蛋白质测定试剂盒购自碧云天公司;PVDF膜购自美国Bio-Rad Laboratories公司;化学发光试剂购自MILLIPORE公司;苏木精购自北京安诺伦公司;伊红购自英国Leica Microsystems公司;丹参注射液购买于广东永康药业有限公司(产品批号:0409007);剔除目标成分的丹参注射液由广州医科大学附属口腔医院杨会肖馈赠。
1.3 方法
1.3.1细胞培养 采用MEM培养液(10% FBS+1%双抗)进行RBL-2H3细胞培养和传代,培养条件为37 ℃、5% CO2。
1.3.2细胞处理 RBL-2H3细胞被接种于6孔板,培养基中分别加入25、50及100 μl/ml丹参和剔除目标成分后的丹参注射液培养24小时。正常培养24小时后的RBL-2H3细胞作为阴性对照组。阳性对照为培养基中给予200 ng/ml二硝基苯胺(DNP)特异性IgE培养24小时。
1.3.3流式细胞仪检测 各组细胞悬液与AnnexinV工作液共同孵育,流式细胞仪检测AnnexinV阳性细胞率,即为不同处理组细胞脱颗粒率。
1.3.4β-氨基己糖苷酶释放试验 将RBL-2H3细胞(1×106个细胞/孔)接种在24孔板中,并用200 ng/ml DNP特异性IgE处理细胞。按照实验目的处理后,将各组细胞暴露于200 ng/ml的DNP-BSA抗原中,并在37℃ 孵育15 min。通过测量释放的β-氨基己糖苷酶的数量来确定脱颗粒的程度。
1.3.5ELISA 收集各组RBL-2H3细胞培养液。在小鼠治疗结束时,收集小鼠血液,在4 ℃下以5000 g快速离心10分钟。上清液保存在-20 ℃。根据试剂盒说明书,使用组胺ELISA试剂盒。
1.3.6免疫印迹 使用RIPA缓冲液提取各组RBL-2H3细胞中的总蛋白,并用蛋白质检测试剂盒测定蛋白质浓度。采用SDS-PAGE(8%凝胶)对等量的蛋白质样品(40 μg)进行分离,并将目的蛋白电转到PVDF膜。5%脱脂牛奶封闭后,膜与一抗(anti-p-anti-p38、anti-p-cJNU、anti-p-Syk, and anti-GAPDH)在4 ℃下杂交过夜。洗涤后,膜与辣根过氧化物酶标记的二抗在室温下孵育2 h。增强型化学发光试剂处理后,利用凝胶成像仪对目的蛋白进行曝光显影。
1.3.7动物处理 对SD大鼠进行I类过敏反应,将雄性SD大鼠随机分别为丹参注射液组,剔除目标成分后注射液组、正常组和阳性对照组(天花粉蛋白),每组各8只。将各受试样品按照临床等倍剂量腹腔注射给予SD大鼠,丹参注射液组以及剔除目标成分后注射液组用药剂量为2 ml/kg,注射容积按体重计算,0.5 ml/200 g。隔日注射1次,连续三次进行致敏反应。阳性对照组天花粉蛋白的浓度为24 μg/ml,注射剂量为0.5 ml。同样的注射方式,正常组注射等量的生理盐水。末次注射14天后进行第一次攻击实验,攻击剂量等同致敏剂量倍,注射容积为致敏时的2倍,注射方式为一次性尾巴静脉推注。攻击实验60 min后二氧化碳窒息法处死大鼠,对背部皮肤伊文思蓝染色情况进行拍照,并将皮肤剪碎后用组织浸出液(丙酮∶生理盐水=7∶3)浸泡48 h,取上清液测量其610 nm处OD值,计算皮肤中依文思蓝染料的渗出量。提取各组大鼠血清及肺组织进行组胺和总IgE测定。摘取肺组织,进行包埋固定及HE染色
1.3.8IgE水平的检测 攻击实验60 min后,采用心脏取血法取各组大鼠血液1 ml,离心后置于-20 °C冰箱。使用全自动生化分析仪(AU5800)对血清IgE水平进行测定。
1.3.9HE染色 所有大鼠肺组织样品用4%多聚甲醛固定24 h,并进行包埋、切片(4 μm)、脱蜡、复水处理。切片用苏木精染色10 min,0.1%伊红染色30 s。冲洗后,切片被进行二甲苯透明和梯度酒精脱水。中性树胶固定后,切片用光学显微镜拍摄病理观察。切片由2名经验丰富的病理学家通过双盲阅读进行评估。
1.4 统计学方法所有统计分析均使用SPSS 20.0软件进行。计量数据用均数±标准差表示。比较各组数据时使用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 不同浓度丹参和剔除目标成分后的丹参注射液对RBL-2H3细胞的脱颗粒率,β-氨基己糖苷酶释放率和组胺含量的影响与阴性对照组相比,丹参组和剔除目标成分后的丹参组细胞的脱颗粒率显著升高、β-氨基己糖苷酶释放率、组胺含量显著增加;与丹参组相比,剔除目标成分后的丹参组细胞的脱颗粒率明显降低,β-氨基己糖苷酶释放率、组胺含量明显减少,差异有统计学意义(P<0.05),见表1。
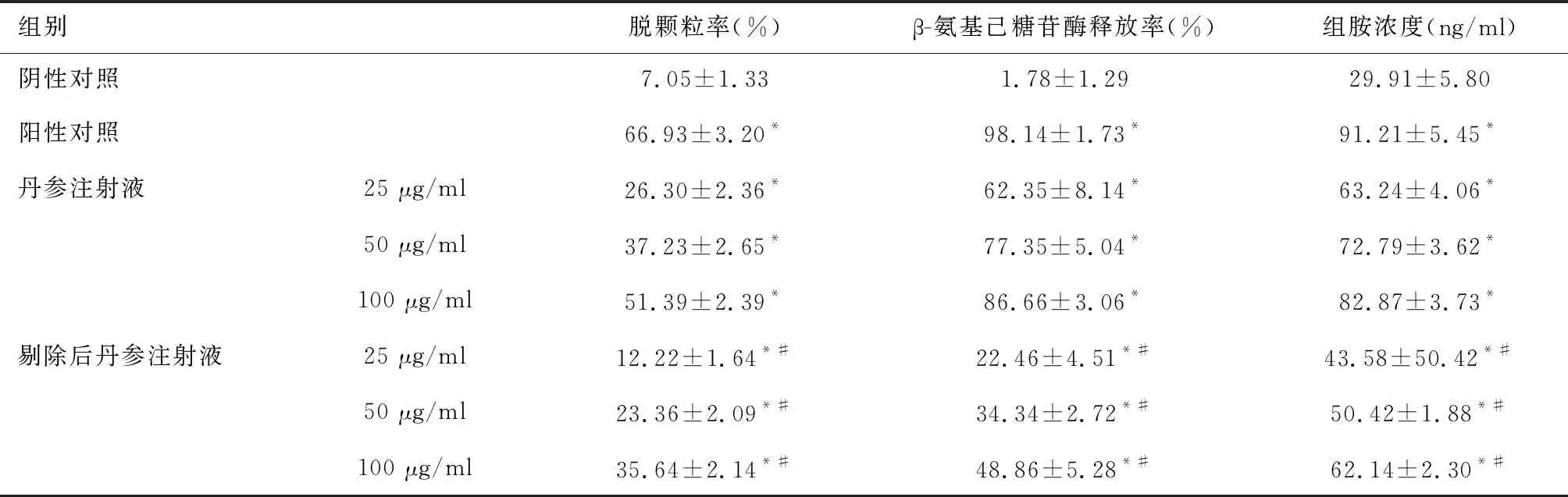
表1 不同浓度丹参和剔除目标成分后的丹参注射液对RBL-2H3细胞脱颗粒率、β-氨基己糖苷酶释放率和组胺含量的影响
2.2 不同浓度丹参和剔除目标成分后的丹参注射液对RBL-2H3细胞中p-p38、p-cJNU和p-Syk的表达的影响与阴性对照组比,使用25、50、100 μl/ml丹参和剔除目标成分后的丹参注射液处理的RBL-2H3细胞p-p38、p-cJNU和p-Syk相对表达水平显著上调;相同浓度的丹参和剔除目标成分后的丹参注射液干预下,与丹参组比较,p-p38、p-cJNU和p-Syk的相对表达水平在剔除目标成分后的丹参组显著降低,差异有统计学意义(P<0.05)。见图1和表2。
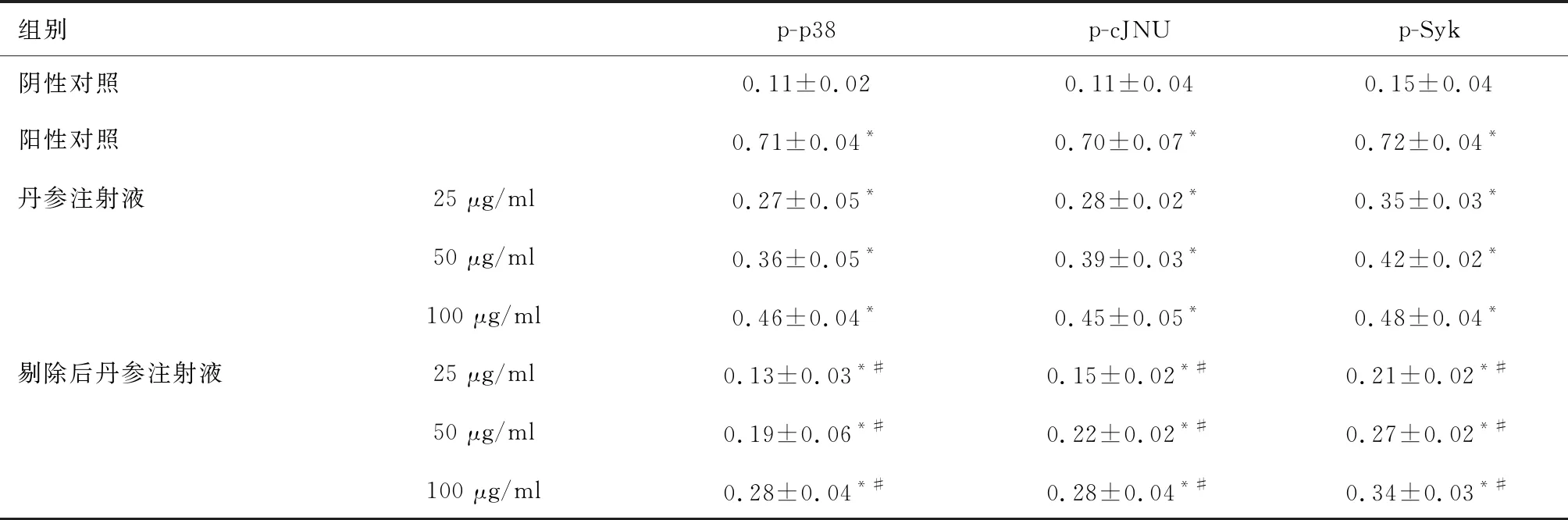
表2 RBL-2H3细胞中p-p38、p-cJNU和p-Syk蛋白表达的定量分析
2.3 剔除目标成分丹参注射液对SD大鼠被动阿瑟斯反应和肺组织的影响伊文思蓝染色结果显示,与正常组组比,OD610 nm在丹参和剔除目标成分后的丹参注射组显著升高;与丹参注射组比,OD610 nm在剔除目标成分后的丹参注射组显著降低,差异有统计学意义(P<0.05),见表3。HE染色结果显示,阳性对照组肺组织内血管扩张充血,肺泡腔扩张,黏膜上皮呈脱落坏死,炎性细胞聚集;与正常组比较,丹参和剔除目标成分后的丹参注射组的炎症细胞有所增加;与丹参注射组比,炎症细胞数量在剔除目标成分后的丹参注射组明显地降低(图2)。
2.4 剔除目标成分的丹参注射液对SD大鼠血清和肺组织总IgE及组胺含量的影响丹参和剔除目标成分后的丹参注射液的处理可明显增加SD大鼠血清和肺组织中的组胺含量;与丹参注射组比,血清组胺含量在剔除目标成分后的丹参注射组明显减少,差异有统计学意义(P<0.05)。丹参注射液和剔除目标成分后的丹参注射液的处理也可显著地升高总IgE在 SD大鼠血清和肺组织中的浓度;而与丹参注射组比,总IgE浓度在剔除目标成分后的丹参注射组明显降低,差异有统计学意义(P<0.05)。见表4。

表3 四组皮肤伊文思蓝染色OD610 nm比较

表4 丹参和剔除目标成分后的丹参注射液对SD大鼠血清和肺组织中组胺及总IgE含量的比较
3 讨论
OSMF是一种慢性隐匿性疾病,被认为是一种口腔癌前病变[5]。OSMF主要表现为张口和舌头运动困难,有烧灼感,口腔黏膜纤维化,进而导致患者饮食限制,语言障碍,难以保持口腔健康[6]。据报道,OSMF与遗传,免疫,辣椒摄入和营养缺乏等因素有关[7]。流行病学证据表明,咀嚼槟榔是OSMF最重要的风险因素之一[8]。目前,OSMF的治疗方法主要包含物理治疗、高压氧治疗和手术治疗等,然而,其治疗效果较低[9]。因此,确定一种治疗OSMF的有效药物是必要的。
在传统中医理论中,OSMF与 "淤血病 "有关。这个术语主要是基于促进血液循环以消除血瘀的特殊治疗方法。丹参注射液是传统中医治疗中的一种常规药物,主要有丹参素、丹参酮、原儿茶醛等主要活性成分具有具有抗氧化、抗血凝、抗血栓、抗脂蛋白、抗炎、抗雄性激素、抗肿瘤、免疫增强以及抗纤维化的作用[10,11],对活血散瘀非常有效[12]。邹萍等研究发现,丹参注射液可以促进OSMF凋亡,并且具有剂量和时间依耐性[13]。丹参注射液中的丹参酮ⅡA、丹参素、丹参多酚酸盐、原儿茶醛等能显著抑制成纤维细胞增殖[14]。采用丹参注射液局部黏膜下注射对OSMF具有一定的疗效,可改善OSMF的症状[15,16],具有临床治疗推广价值。然而,丹参注射液具有多种不良反应,其主要不良反应为速发型超敏反应,包括I型过敏反应和类过敏反应,可累及神经、心血管、呼吸、消化、泌尿等多个系统[17],严重限制了丹参注射液在OSMF中的临床应用,因此深入开中药毒性成分及其与有效成分之间关系的研究,优化化学成分配伍,减少不良反应、提高治疗效率,对临床应用丹参注射液治疗OSMF具有重要意义。肥大细胞通过IgE特异性受体受到IgE调节抗原的刺激,激活下游的交联受体、Syk、Gab2和其他酪氨酸激酶,从而引起过敏反应[18,19]。因此,Syk和Gab2是被认为是开发抗过敏药物的理想靶点。在RBL-2H3细胞中,可以通过检测细胞的脱颗粒率、细胞超微结构变化、细胞上清液中的组胺、β-氨基己糖苷酶的释放等指标综合评价药物所致类过敏反应的潜在能力[20]。p38、cJUN、Sky信号通路的激活在过敏反应中发挥重要作用[19]。在研究中发现丹参注射液可增加RBL-2H3细胞的脱颗粒率、β-氨基己糖苷酶释放率、组胺含量和p-p38、p-cJNU和p-Syk蛋白表达。同时,丹参注射液可增强SD大鼠被动阿瑟斯反应、肺组织病理损伤、SD大鼠血清和肺组织中组胺含量和总IgE浓度。本研究结果进一步证实,丹参注射液可引起强烈的过敏反应。
研究发现,丹参注射液的一些成分,如丹参酮可与酸性结晶体作为半抗原与血浆蛋白结合而具免疫原性,从而引起机体发生过敏反应;一些带酚羟基的酸性成分如原儿茶酚醛及丹参素等,与鞣质的化学成分相似,可作为半抗原与血浆蛋白的氨基缔合成更大分子复合物而引起变态反应,导致过敏反应或过敏性体克[21]。因此,剔除丹参注射液中可致敏的一些目标成分也许可减少丹参注射液的不良反应、提高其治疗效率。目标成分剔除法是一种减法的策略,采用一定的方法将某种特定成分除去,同时不影响其他组分,获得剔除目标成分后的中药组分。我们通过核酸适体技术剔除目标成分,筛选得到丹参注射液中三种主要活性成分丹参素、丹参酮IIA、原儿茶醛的核酸适体,获得目标成分剔除后的丹参注射液。此外,本文结果证实,相对于丹参注射液,剔除目标成分后的丹参注射液可明显降低大鼠和RBL-2H3细胞的过敏反应。
综上所述,剔除目标成分可降低丹参注射液所引起过敏反应。这一研究结果为能为丹参注射液在OSMF的治疗提供新思路。

