热激对产气荚膜梭菌芽孢内膜蛋白理化特性的影响
张园园,李苗云,赵莉君,朱瑶迪,赵改名,梁 栋,马阳阳,刘 纯
(河南农业大学食品科学技术学院,河南 郑州 450002)
产气荚膜梭菌()是一种革兰氏阳性厌氧致病菌,广泛分布于空气、水、土壤、食物、动物以及人类的胃肠道中,是引发食源性疾病,导致人类食物中毒的主要病原菌之一。产气荚膜梭菌在外界环境不利条件下(如低温/干燥或营养缺乏等)极易形成芽孢休眠体,其芽孢具有含水量低、抗逆性强和休眠特性等特点,对各种恶劣环境(包括高温、高压、辐射、有毒有害化学物质、酸或碱等)具有极强抵抗力,在食品工业灭菌后仍可存活。当外界存在合适的萌发因子或适合萌发的条件,芽孢会迅速萌发生长,恢复繁殖,失去休眠特性和芽孢抗性,产生可以引起食物腐败变质或导致食源性疾病的毒素或酶。芽孢休眠体向营养体细胞的转化是产气荚膜梭菌产生毒性的关键一步,因此芽孢萌发被认为是产气荚膜梭菌芽孢污染的第一阶段。
热激可提高许多芽孢杆菌及其相关物种的芽孢萌发速率和萌发程度。在自然条件下,芽孢的萌发速率十分缓慢,但热激可促进90%以上的芽孢种群萌发。不同种属的芽孢表现出不同热激要求,对于产气荚膜梭菌芽孢,最常用的热激条件是75 ℃处理10~20 min。90 ℃以上热激温度处理的芽孢萌发效果低于60~80 ℃热激处理。热激对芽孢的作用过程与芽孢蛋白结构的变化和各种芽孢分子的释放密切相关,该过程可能涉及一些芽孢蛋白中化学键(例如氢键)的断裂。目前关于热激的调控机制和热激诱导蛋白质的动态变化尚未得到系统研究。
芽孢主要具有7 层结构,由外到内依次是孢外壁、芽孢衣、外膜、皮层、芽孢壁、内膜和内核。芽孢内膜上存在超过300 种蛋白质,其中与芽孢萌发相关的蛋白质基本上都位于芽孢内膜,如萌发受体蛋白和通道蛋白等,这些蛋白质在芽孢萌发的不同阶段起到信号传导、门控机制等重要作用。芽孢内膜与营养体细胞膜上的蛋白质组成存在较大差异,主要体现在萌发受体蛋白GRs和吡啶-2,6-二羧酸钙(Ca-dipicolinic acid,Ca-DPA)通道蛋白-spoVA家族蛋白,此类蛋白不存在于营养体细胞中。Luu等研究发现热激是通过直接激活芽孢杆菌GRs蛋白引起芽孢萌发;Wang Guiwen等发现,湿热处理主要影响产气荚膜梭菌芽孢的Ca-DPA释放过程中的一些重要蛋白。有研究证明枯草芽孢杆菌中spoVA蛋白与GRs存在物理作用,该过程可能涉及芽孢萌发期间的信号转导。虽然已经确定了芽孢萌发时的一些物理变化以及参与这一过程的蛋白质,但关于芽孢萌发的生理途径仍不清楚。分析热诱导芽孢萌发过程中芽孢内膜蛋白理化特性的变化对于深入解析萌发蛋白作用机制具有重要意义。
因此本实验以产气荚膜梭菌芽孢内膜蛋白为研究对象,以25 ℃处理为空白对照,选择37、75、95 ℃对产气荚膜梭菌芽孢内膜蛋白进行热激处理,以研究不同温度热激对芽孢内膜蛋白理化特性的影响(图1)。旨在为进一步揭示热激对产气荚膜梭菌芽孢内膜蛋白功能的影响提供了理论基础,也为高效、定向控制产气荚膜梭菌芽孢萌发提供科学依据。

图1 热激对产气荚膜梭菌芽孢内膜蛋白理化特性的探究流程图Fig. 1 Experimental flow chart of this study
1 材料与方法
1.1 材料与试剂
河南农业大学食品科学与技术学院微生物实验室从涨袋的盐焗鸡中分离出产气荚膜梭菌C1,并由华大基因有限公司通过全基因组测序鉴定用于本研究。
-环丝氨酸溶液、蛋白胨 青岛高科技工业园海博生物科技有限公司;胰胨-亚硫酸盐-环丝氨酸(tryptone sulfite cycloserine,TSC)琼脂基础、疱肉牛肉粒、产芽孢肉汤、液体硫乙醇酸盐(fluid thioglycollate,FTG)培养基 北京陆桥技术有限责任公司;十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、二硫苏糖醇(-dithiothreitol,DTT)、核糖核酸酶A(RNase A)、脱氧核糖核酸酶I(DNase I)、溶菌酶、乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)、尿素、苯甲基磺酰氟(phenylmethanesulfonyl fluoride,PMSF)、蛋白上样缓冲液、溶菌酶、Tris、彩虹Marker、1 mol/L磷酸盐缓冲液(phosphate buffered saline,PBS)索莱宝生物科技有限公司;革兰氏阳性菌膜蛋白提取试剂盒 北京百奥莱博科技有限公司;10-壬基吖啶橙(nonyl acridine orange,NAO) 北京拜尔迪生物技术有限公司;MgCl、HCl(均为分析纯);碘海醇挪威Axis-shield公司。
1.2 仪器与设备
Allegra 64R型高速冷冻离心机 贝克曼库尔特商贸(中国)有限公司;TU-1901型紫外-可见分光光度计北京普析通用仪器有限责任公司;HIRAYAMA-HVE50高压灭菌器 华粤行仪器有限公司;Electrotek AW200SG厌氧工作站 英国Electrotek公司;荧光显微镜 日本Olympus公司;Zeta电位仪 英国Malvern公司;激光共聚焦拉曼光谱仪 日本Horiba公司;荧光光谱仪 赛默飞世尔科技(中国)有限公司;ECLIPSE 80i生物显微镜日本Nikon公司。
1.3 方法
1.3.1 产气荚膜梭菌芽孢培养及菌悬液的制备
参考Zhu Yaodi等方法制备芽孢,从TSC平板上挑取典型的黑色菌落接种到庖肉培养基中,37 ℃厌氧培养48 h。取该菌液接种到新制备的FTG中,37 ℃厌氧培养24 h,得到芽孢悬浮液。将芽孢7 000 r/min、4 ℃离心20 min,用0.1%无菌蛋白胨水重复洗涤芽孢悬浮液2 次,将离心洗涤的芽孢重新悬浮保存于无菌蛋白胨水中,使用生物显微镜进行镜检,当芽孢纯度在95%以上时使用碘海醇进行芽孢和菌体的进一步分离纯化,当纯度达到99.9%时收集芽孢,置于-20 ℃保存。
1.3.2 芽孢内膜级分及内膜蛋白的提取
将芽孢与配制的反应液以1∶1比例混合(50 mmol/L Tris-HCl(pH 8.0)、8 mol/L 尿素、1% SDS、50 mmol/L DTT),37 ℃水浴90 min,13 200 r/min、4 ℃离心5 min,将沉淀用150 mmol/L NaCl溶液洗涤4 次,无菌水洗涤4 次后保留沉淀。将去除芽孢衣的芽孢以OD为50~70悬浮在TEP缓冲液中(50 mmol/L Tris-HCl(pH 7.4)、5 mmol/L EDTA、1 mmol/L PMSF),加入1 mg溶菌酶、1 μg RNase A、1 μg DNase I和20 μg MgCl。然后将芽孢悬浮液37 ℃孵育5 min,在冰上冷却20 min后,将芽孢悬浮液用100 mg玻璃珠短暂超声处理,在显微镜下检查裂解情况,并在微离心机中以最大速度离心5 min,并保存上清液。后续使用革兰氏阳性菌膜蛋白提取试剂盒进行膜蛋白的提取。
1.3.3 荧光染色剂NAO染色
荧光染色剂NAO可标记芽孢内膜,通过染色程度可判断芽孢外部各层结构的去除情况,为确保实验步骤1.3.2节方法可以去除芽孢外层结构,对处理后的芽孢进行荧光染色。荧光染色过程如下:将芽孢液和去除芽孢各层结构的芽孢悬浮液与荧光染色剂NAO(200 nmol/L)在室温下避光共同孵育1 h后,10 000 r/min离心10 min,将沉淀用PBS洗涤至去掉染色剂。然后将处理后的样品在激发波长490 nm、发射波长528 nm下进行荧光显微镜观察。
1.3.4 SDS-PAGE分析
采用蛋白质SDS-聚丙烯酰胺凝胶电泳(SDS-polyacrylamide gel electrophoresis,SDS-PAGE)分析产气荚膜梭菌芽孢内膜蛋白的分子质量分布。选用5%的浓缩胶和12%的分离胶,蛋白质量浓度为1 mg/mL。向内膜蛋白样品中加入上样缓冲液,沸水浴5 min。初始电压设定为90 V,进入分离胶时设定为120 V。电泳结束后将凝胶用考马斯亮蓝染色液染色,脱色后使用凝胶成像仪扫描成像。
1.3.5 粒径分布
利用Zeta电位仪中动态光散射测定不同温度热激后内膜蛋白的粒径分布。蛋白质样品用PBS稀释至0.1 mg/mL,比色皿的光程为1 cm,测定温度为25 ℃。利用自带软件分析检测测定结果,当测定结果显示为良好时检测结果方可使用。
1.3.6 紫外-可见光谱扫描
将芽孢内膜蛋白样品用PBS稀释至0.1 mg/mL。设置紫外分光光度计扫描范围为200~400 nm,扫描速率为100 nm/min。
1.3.7 荧光光谱扫描
用PBS调节内膜蛋白质量浓度为0.1 mg/mL,设置激发波长290 nm,发射波长范围300~460 nm,狭缝均为5.0 nm进行扫描。
1.3.8 蛋白质表面疏水性测定
参考Chelh等方法并适当修改。取1.2 mL质量浓度为1 mg/mL的芽孢内膜蛋白溶液,加入12 μL 1 mg/mL的溴酚蓝溶液,涡旋振荡10 min,使样品和溴酚蓝溶液混匀,4 ℃、8 000 r/min离心15 min,用相应的PBS作空白对照,在595 nm波长处测定吸光度。表面疏水性计算公式如下:

1.3.9 拉曼光谱
参考Yu Dianyu等方法,将内膜蛋白质量浓度调节至1 mg/mL,在进行校正后开始光谱扫描。本研究使用拉曼分析仪在室温下进行,激发波长为532 nm,系统积分时间为30 s,光谱采集范围400~2 000 cm。每个样品至少随机抽取5 个点进行测量以保证数据可靠。所有拉曼光谱均使用HORIBA公司自带软件进行处理。
1.4 数据统计分析
每组实验均设置3 次重复,采用Origin 2018软件进行图形绘制。
2 结果与分析
2.1 产气荚膜梭菌芽孢内膜级分的提取鉴定及内膜蛋白的提取
荧光染色剂NAO可以和芽孢内膜磷脂分子结合,当芽孢衣和皮层等外部各层结构未被去除时,NAO染色剂无法到达芽孢内膜,去除后可以在荧光显微镜下观察到荧光,故可以通过染色效果判断外层结构的去除效果。如图2所示,未经处理的芽孢悬浮液,其染色效果较差,荧光显微镜视野暗淡;去除芽孢外部各层结构后进行染色的芽孢,其芽孢内膜的磷脂暴露,染色效果好,荧光显微镜视野明亮。以上结果表明,实验所用的芽孢均已有效去除芽孢外部各层结构,后续实验均使用去除芽孢各层结构后的内膜级分进行芽孢内膜蛋白的提取,通过蛋白质定量分析试剂盒测定提取出的产气荚膜梭菌芽孢内膜蛋白质量浓度为6 mg/mL,分子质量范围在35~75 kDa之间(图3)。

图2 产气荚膜梭菌芽孢荧光染色观察图Fig. 2 Fluorescence staining observation of C. perfringens spores
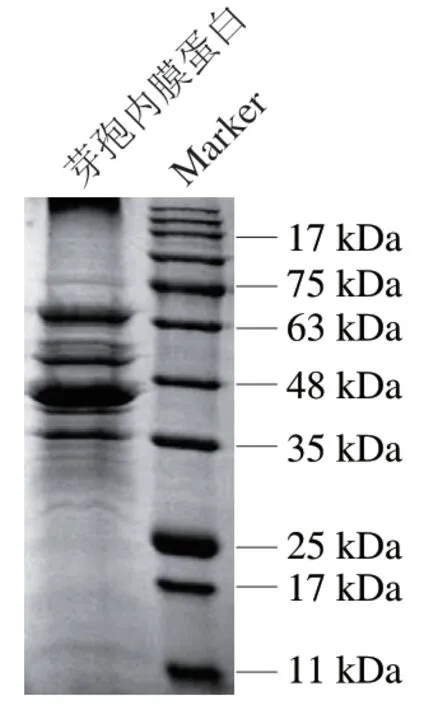
图3 产气荚膜梭菌芽孢内膜蛋白SDS-PAGE图Fig. 3 SDS-PAGE patterns of C. perfringens spore inner membrane proteins
2.2 不同温度热激后产气荚膜梭菌芽孢内膜蛋白的粒径分布情况
粒径可以表征蛋白质的聚集程度,同时也能反映蛋白质空间构象的变化,蛋白粒径的变化也会对蛋白质的功能特性产生影响。不同温度热激处理20 min后芽孢内膜蛋白粒径分布如图4所示。空白组芽孢内膜蛋白质粒径主要分布在70~170 nm之间,不同温度热激对芽孢内膜蛋白溶液体系的影响不同。37 ℃处理后的内膜蛋白粒径分布与对照组无明显差异。在75 ℃热激后,内膜蛋白粒径分布均匀稳定,主峰位置向大粒径方向偏移,粒径分布在85~205 nm之间。该结果表明75 ℃热激提高了内膜蛋白粒径分布均匀性。粒径的变化主要是由蛋白质分子内部的交联和聚集造成,热激增加了蛋白质之间的碰撞和聚集速度,从而形成蛋白质的聚集。蛋白质的聚集可能是由于非共价相互作用,如疏水相互作用,75 ℃热激处理后内膜蛋白构象发生了变化,亲水基团埋藏在蛋白质内部,疏水基团暴露并重新聚集成具有较大粒径的蛋白质聚合物,这与陈振家等的研究结果一致。95 ℃热活化后,内膜蛋白粒径分布变宽,粒径分布向大粒径方向显著偏移,蛋白质发生明显聚集或变性现象,此时蛋白质的结构可能被破坏。

图4 不同温度热激对产气荚膜梭菌芽孢内膜蛋白粒径分布的影响Fig. 4 Effect of heat stress at different temperatures on the particle size distribution of C. perfringens spore inner membrane proteins
2.3 不同温度热激后产气荚膜梭菌芽孢内膜蛋白的紫外-可见光谱分析
通过蛋白质的紫外-可见吸收光谱强度测定,可以由氨基酸微环境的变化推断蛋白质三级结构的改变。芽孢内膜蛋白样品在280 nm波长附近会出现色氨酸与酪氨酸特征吸收峰。蛋白质中氨基酸微环境的变化会引起蛋白质最大吸收波长发生红移或者蓝移,从而引起蛋白质构象的变化。如图5所示,37 ℃热激后芽孢内膜蛋白紫外光谱相对25 ℃空白组无明显差别。75 ℃热激后产气荚膜梭菌芽孢内膜蛋白紫外光谱荧光强度增加,表明热激后蛋白质结构展开,蛋白质分子内部氨基酸残基暴露,芽孢内膜蛋白构象发生改变。95 ℃热激后内膜蛋白的吸收峰降低,这可能是高温导致蛋白发生自聚集反应。

图5 不同温度热激后产气荚膜梭菌芽孢内膜蛋白的紫外光谱图Fig. 5 UV absorption spectra of C. perfringens spore inner membrane proteins after heat stress at different temperatures
2.4 不同温度热激后产气荚膜梭菌芽孢内膜蛋白的荧光光谱图

表1 不同最大发射波长处Trp残基所在的状态Table 1 Status of Trp residues at different maximum emission wavelengths

图6 不同温度热激后产气荚膜梭菌芽孢内膜蛋白荧光光谱Fig. 6 Fluorescence spectra of C. perfringens spore inner membrane proteins after heat stress at different temperatures
内源荧光光谱是推测蛋白质分子三级结构变化的一种重要方法,蛋白质荧光主要取决于自身芳香族氨基酸残基所处环境的极性,荧光基团的猝灭和荧光发射峰位的减少是分析蛋白质结合的有用指标。在295 nm处只有Trp被激发,而Tyr不会被激发。参考表1,如图6A所示,当激发波长为295 nm时,不同温度热激后芽孢内膜蛋白的最大发射波长()均在310~330 nm范围内,表明Trp残基位于蛋白质分子内部部分疏水环境中。75 ℃热激引起产气荚膜梭菌芽孢内膜蛋白荧光强度增强,且伴随轻微蓝移,这表明75 ℃热激可能破坏了蛋白质分子间的疏水键,使内膜蛋白的构象发生变化,导致分子内的Trp残基暴露,荧光强度增强。在280 nm激发波长下荧光强度是Tyr和Trp两种氨基酸产生的荧光之和。75 ℃热激活后,内膜蛋白Tyr的荧光强度明显低于空白组(图6B),表明芽孢内膜蛋白之间可能发生相互作用,将Tyr残基带到极性环境中,导致荧光猝灭。
2.5 不同热激温度对产气荚膜梭菌芽孢内膜蛋白的表面疏水性的影响
表面疏水性主要利用蛋白质表面疏水性氨基酸与8-苯氨-1-萘磺酸探针的特异性结合进行测定,表面疏水作用力在维持蛋白三级结构及功能特性等方面起着非常重要的作用,可用于反映蛋白质三级结构的变化情况。如图7所示,37 ℃热激后芽孢内膜蛋白表面疏水性与对照组相比无明显差异,75 ℃热激后产气荚膜梭菌芽孢内膜蛋白结构展开,埋藏在蛋白质内部的疏水基团暴露,表面疏水性增强。许英一等在研究热处理后改性燕麦蛋白的影响时也发现,热处理能够增强蛋白质的表面疏水性,增加有利于蛋白质无定形或纤维状聚集体的形成。当95 ℃热激处理时,芽孢内膜蛋白表面疏水性下降(<0.05),可能是由于95 ℃热激后,芽孢内膜蛋白通过疏水相互作用聚集形成蛋白质聚集物-簇,将暴露的少量疏水性残基重新包埋于蛋白质内部,从而使表面疏水性下降。

图7 不同温度热激后产气荚膜梭菌芽孢内膜蛋白的表面疏水性Fig. 7 Surface hydrophobicity of C. perfringens spore inner membrane proteins after heat stress at different temperatures
2.6 不同热激温度对产气荚膜梭菌芽孢内膜蛋白二级结构的影响
拉曼光谱强度与散射中心(化学键和基团)的数量正相关,因此样品的拉曼光谱强度变化可以作为确定蛋白质的化学键或基团变化程度的依据,推测分析蛋白质构象和结构的变化,以及获取如蛋白质主链、侧链和二硫键的信息。图8为不同温度热激后产气荚膜梭菌芽孢内膜蛋白在400~2 000 cm范围内的拉曼光谱。拉曼光谱中的酰胺I带(1 630~1 700 cm)和酰胺III带(1 230~1 248、1 242~1 250、1 264~1 310 cm)的特征峰决定了蛋白质的构象,可用于研究蛋白质二级结构的定量分析。酰胺I主要涉及C=O和C—N的拉伸,酰胺III主要涉及C—N的拉伸和NH的平面跃迁。然而,由于酰胺III所涉及的信息比较复杂,通过酰胺I带分析热激后芽孢内膜蛋白二级结构变化。根据相关文献,在拉曼光谱中,蛋白质酰胺I带中-螺旋结构归属于1 600~1 611 cm,-折叠结构归属于1 614~1 625 cm,-转角结构归属于1 625~1 632 cm,无规卷曲特征振动频率为1 604~1 619 cm。

图8 不同温度热激后产气荚膜梭菌芽孢内膜蛋白的拉曼光谱图Fig. 8 Raman spectra of C. perfringens spore inner membrane proteins after heat stress at different temperatures
如图9所示,空白组中芽孢内膜蛋白的二级结构为-螺旋27.43%、-折叠22.49%、-转角15.48%和无规卷曲34.60%,其中-螺旋、-折叠和无规卷曲为主要结构。拉曼光谱结果表明,热激可显著影响产气荚膜梭菌芽孢内膜蛋白的二级结构(<0.05)。与空白组相比,37 ℃热激后内膜蛋白的二级结构无明显变化。75 ℃热激后的蛋白质-螺旋结构含量下降3.17%、-折叠结构含量降低3.94%、无规卷曲比例上升8.31%。-螺旋主要靠肽链内部的氢键维持,75 ℃热激破坏了维持-螺旋结构稳定性的氢键,导致蛋白质之间的交联加强;研究表明,-折叠依赖于肽链之间的氢键,-折叠结构含量下降表明蛋白质的疏水位点的暴露,75 ℃热激后蛋白质肽链展开,表面疏水性增加;75 ℃热激后内膜蛋白的二级结构由有序状态逐渐向无规则状态转化。这与许晶等的报道一致,-螺旋含量降低,无规卷曲含量升高,即二级结构由-螺旋结构向无规卷曲结构转变时,分子结构更为松散,包埋在分子内部的疏水性残基更多的暴露出来,导致表面疏水性的增加。95 ℃热激后的蛋白中-螺旋和-折叠结构含量增加,无规卷曲结构比例降低。
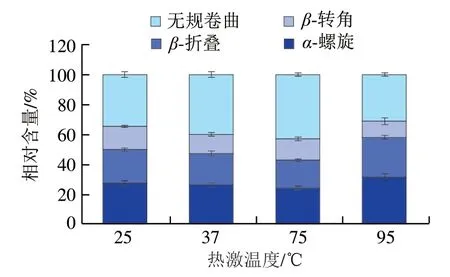
图9 不同温度热激对产气荚膜梭菌芽孢内膜蛋白二级结构含量的影响Fig. 9 Effect of heat stress at different temperatures on the secondary structure content of C. perfringens spore inner membrane proteins
3 结 论
不同热激温度(37、75、95 ℃)对产气荚膜梭菌芽孢内膜蛋白理化特性的影响存在差异。37 ℃热激处理对芽孢内膜蛋白的理化特性无明显影响。75 ℃热激破坏了维持-螺旋结构稳定性的氢键,导致蛋白质之间的交联加强,氨基酸微环境改变,疏水位点暴露,蛋白质的表面疏水性增加。95 ℃热激处理导致芽孢内膜蛋白结构被破环,并发生明显聚集或变性。综上所述,75 ℃热激可使产气荚膜梭菌芽孢内膜蛋白的二级结构更为丰富,该过程可能涉及多种蛋白质的相互作用,深入研究芽孢内膜蛋白质的相互作用过程对于解析芽孢萌发机制具有重要意义。该结论为揭示热激对产气荚膜梭菌芽孢内膜蛋白结构和功能的影响提供了一定科学依据,也为了解产气荚膜梭菌芽孢萌发相关蛋白的作用机制提供了理论基础。

