基于高场非对称离子迁移谱的糖类异构体分离研究
郝 杰,李俊晖,王陈璐,高文清, 石守东,俞建成,唐科奇
(1.宁波大学质谱技术与应用研究院,浙江 宁波 315211; 2.宁波大学高端质谱技术和临床应用浙江省工程研究中心,浙江 宁波 315211; 3.宁波大学信息科学与工程学院,浙江 宁波 315211;4.宁波大学材料科学与化学工程学院,浙江 宁波 315211)
糖类是生物体内重要的供能物质,直接参与细胞识别及活性调控,与肿瘤、糖尿病等恶性疾病的发生密切相关[1-4]。因此,深入研究糖类化合物在生物体内的种类、结构及功能,对于理解生命进程及疾病的发生机理至关重要。然而,糖类物质结构复杂且存在大量的同分异构体,为糖组学的深入研究带来了困难[5-8]。
近年来,离子迁移谱技术(IMS)凭借分析速度快、能分离同分异构体等特点,逐渐成为糖类化合物研究的新选择[6-8]。传统的IMS技术通常在一个填充惰性气体的漂移管内建立轴向均匀静电场,由于离子的迁移率(K)存在差异,在静电场作用下以不同的速度穿过漂移管,从而实现分离与识别[7-9]。但目前商业化的IMS仪器受限于可实现的分辨力(最高约200),难以有效分离结构相似的糖类同分异构体[6-9]。新兴的高场非对称离子迁移谱(FAIMS)技术已被证明可实现更高的结构分辨力(最高约500),与质谱之间有更好的正交性,并且在同等分辨力下,对脂类、氨基酸、多糖等物质的分离效果约为IMS的3~4倍,为糖组学研究提供了支持[9-12]。
不同于IMS,FAIMS能够利用离子在强弱电场间迁移率的差异实现离子的分离。高场下离子迁移率K与电场E的关系通常采用1个偶次幂的多项式来表达[13-15]:
K(E/N)=K(0)·[1+a·(E/N)2+
b·(E/N)4+c·(E/N)6+…]
(1)
式中,K(0)为标准大气压(101.325 kPa)和标准温度(0 ℃)下的离子迁移率,N为环境气体的数密度,E/N为归一化的电场强度。离子迁移率可能随电场强度的增强而升高(A类离子)、下降(C类离子)或先升高后下降(B类离子)[16-17]。在此条件下,FAIMS利用不同离子在高低电场间迁移率差(ΔK(E))的不同,实现离子在垂直距离上的分离[17-19]。通常,FAIMS由2块电极板组合而成(可组合为圆筒型或平行型),极板间留1段细微间隙。通过将特定的周期性非对称变化的高压波形(分离电压(DV))连接在其中1块电极板上,2块极板间将形成1个非对称变化的电场。当离子被恒流气体带入FAIMS间隙后,在每个DV周期下,离子都将向其中1块极板方向偏移,并在多个周期后最终在极板上被中和[18-20]。为了使具有特定ΔK(E)的离子穿过FAIMS间隙,需要将合适的补偿电压(CV)叠加在DV上,使离子反向移动,以抵消每个DV周期引起的偏移。因此,FAIMS常采用1个以固定速度变化的CV波形进行扫描,以此获得不同离子的分布谱图[18-21]。
为利用FAIMS实现糖类同分异构体的有效分离,本文拟研发一款配套零相位滤波算法和基于二阶导及改进粒子群算法的重叠峰分离算法、可独立使用的平板型FAIMS装置,使其能够在分离离子、过滤信号噪声的同时,实现FAIMS重叠峰中各峰的精准、快速提取,由此提升FAIMS数据的可读性及分析结果的准确性。同时,利用蔗糖、麦芽糖样品测试该装置对糖类同分异构体的分离效果,分析FAIMS载气中氦气比例对其分辨率/分辨力、糖类离子结构及糖类同分异构体谱峰分离度的影响,旨建立一套基于FAIMS的糖类异构体分析新方法。
1 实验部分
1.1 主要仪器与装置
本实验使用的FAIMS分离装置与文献[22-24]报道类似,其结构示意图示于图1。该装置主要由2块平行的光滑不锈钢电极板(长6.6 cm,宽3.55 cm)组成,极板间保留1.88 mm的间隙。FAIMS DV连接在底部极板(DV极板),FAIMS CV连接在顶部极板(CV极板)。CV极板上方覆盖1块帘幕极板,中间存在1个直径2 mm的离子入口。CV极板上同样存在1个与前述入口同轴的直径1 mm的离子入口。

图1 独立FAIMS分离装置结构示意图Fig.1 Schematic of the standalone FAIMS system
通过在帘幕极板上施加1 kV的直流电压,气相离子将在电压作用下经由2个入口进入FAIMS间隙内。在CV极板和帘幕极板间存在1个载气入口,载气为氮气、氦气的混合气体,其流速及成分比例由瑞士Axetris公司生产的数字流量计控制。其中,MFC2242-DJ-U0、MFC2242-CF-U0流量计分别用于控制氮气和氦气的流速。载气在进入帘幕极板和CV电极的间隙后,将根据2个离子入口直径的不同被分成2部分。其中,约70%的载气将从帘幕极板的入口流出,用于ESI源中液滴的去溶剂化;而剩余约30%的气体将流入FAIMS,以携带离子通过间隙[23-24]。1个直径6 cm的不锈钢圆形网罩将作为电荷收集器安装在FAIMS离子出口处收集全部离子;美国Keithley公司生产的No.6514高灵敏度静电计则被用于测量电荷收集器上采集得到的离子电流信号。为了消除FAIMS DV电场在离子电流测量过程中产生的射频干扰,整个装置被安装在1个矩形不锈钢的接地屏蔽壳内运行。
本实验所有的分析物离子均由nano-ESI电喷雾离子源电离产生。其中,ESI喷针为美国New Objective公司产品,外径320 μm,内径50 μm。喷针通过2个不锈钢接头连接到美国Hamilton公司生产的0.5 mL注射器上。使用中国兰格恒流泵有限公司生产的LSP01-1A进样泵将样品溶液注入喷针,并利用天津东文高压电源股份有限公司生产的DW-P502-1F74高压直流电源模块在ESI喷针上添加直流高压电以形成电喷雾。本实验还将FAIMS装置与Agilent 6560 IMS-QTOF质谱仪联用,用于检测FAIMS谱峰离子的质荷比。
1.2 主要材料与试剂
蔗糖:分析纯,上海沪试实验室器材股份有限公司产品;麦芽糖:分析纯,上海源叶生物科技有限公司产品;甲醇、乙酸:色谱纯,美国Fisher Scientific公司产品;超纯水:由美国Millipore公司生产的Milli-Q系统制备。
样品溶剂:甲醇-超纯水-乙酸(50∶49∶1,V/V/V)混合试剂;10 mmol/L标准储备液:称取34.2 mg蔗糖和麦芽糖样本,分别溶解于10 mL样品溶剂;5 mmol/L样品溶液:移取3 mL蔗糖和麦芽糖标准储备液,分别与3 mL样品溶剂充分混合。
1.3 实验条件
将频率965 kHz/幅值2.54 kV和频率1 930 kHz/幅值1.27 kV的双正弦波以90°相位差组合后作为FAIMS DV,其电压幅值将在-1.9~3.8 kV范围内非对称变化。FAIMS CV是一段连续扫描的锯齿波,其扫描范围为-20~+20 V,扫描速率为0.1 V/s。为保证FAIMS信号的最佳灵敏度及稳定性,ESI进样速率设为300 nL/min,FAIMS载气流速为3 L/min,ESI喷针连接了4 kV直流高压电并被放置在距帘幕极板离子入口约3 mm处。同时,载气中的氦气比例将在0%~40%范围内调节以避免放电。为了确定FAIMS谱图中分析物离子对应的谱峰,在实验过程中测量了不同浓度样品试剂的谱图。对于信号强度随样品浓度下降接近等比例变化的峰,将被确定为分析物所对应的谱峰,FAIMS谱峰离子的质荷比也被用于进一步验证结果的准确性。为保证数据的有效性,每组实验数据均重复采集5次。
在采集得到的FAIMS信号中,常存在明显的噪声干扰及谱峰重叠现象,难以提取谱峰的CV值、半峰宽等重要信息,以及定性分析物。零相位数字滤波算法能在有效过滤FAIMS噪声的同时保留有效信号,有助于提升仪器的检测限[9];基于二阶导及改进粒子群算法的重叠峰分离算法能够在3~5 s内实现谱图中重叠峰的精准分离,并提供各单峰的峰强、峰宽等重要信息[25-26]。因此,本研究拟将FAIMS装置与上述2种算法相结合,在信号滤噪的基础上对重叠峰进行分离,以提升FAIMS装置对物质定性分析的准确性。
2 结果与讨论
2.1 蔗糖谱图分析
为评估FAIMS装置对糖类物质的分离效果,首先检测了5、10 mmol/L蔗糖样品的FAIMS谱图,示于图2。在3 L/min纯氮气条件下,不加FAIMS屏蔽壳,高频高压的FAIMS DV将对采集金属网产生严重的噪声干扰,因此仅能采集得到噪声信号,示于图2a。在添加屏蔽壳后可有效抑制射频干扰,从而能采集到有效的蔗糖FAIMS谱图,示于图2b,在得到的谱图中存在4个未完全分离的谱峰,分别标记为1、2、3、4,且谱图中仍然存在明显的噪声干扰,影响了进一步分析。因此,采用零相位数字滤波算法对图2b中的信号进行滤波处理,相较于原始谱图,信号光滑度及信噪比均明显提升,能更精准地提取FAIMS谱峰的CV值、半峰宽等信息,示于图2c。其中,峰3、4在蔗糖样品浓度变化的过程中未发生明显改变,推测是由溶剂产生的背景峰;峰1、2的信号强度随蔗糖样品浓度的下降发生明显变化,推测可能是蔗糖离子对应的谱峰。为进一步验证峰1、2,将FAIMS装置与Agilent 6560 IMS-Q TOF质谱仪联用,获得的质谱图示于图2d,根据其中蔗糖离子m/z343.12[Sucrose+H]+筛选了FAIMS谱图,示于图2e,筛选后的谱图中仅存在峰1、2,因此可确定其为蔗糖离子信号,且存在2种不同的结构。与文献[17,24]报道相同,在波峰强度远大于波谷强度绝对值的正FAIMS DV条件下,蔗糖离子峰1、2对应的CV值分别为-6.8、-4.8 V,表明其属于迁移率随电场强度增强而下降的C类离子。
在类似的离子化条件下,IMS甚至高分辨捕集离子迁移谱(TIMS)装置采集得到的蔗糖离子迁移谱图中,几乎都显示蔗糖样品仅存在单一结构[6,27-28]。2020年,Li等[6]利用3-吡啶硼酸对二糖离子进行衍生化处理,在显著提升二糖离子间的结构差异后,使用高分辨TIMS-TOF检测,发现由于离子化位点不同,蔗糖离子存在2种结构。本研究利用平板型FAIMS,在不采取衍生化处理的情况下,就能观察到蔗糖离子的双重结构。这一结果与利用离子迁移谱技术对多肽及蛋白质进行结构多样性分析的实验类似,证明了分辨力有限的IMS设备难以对结构高度相似的异构体离子实现有效分离;而相较于低场下的特定K,不同结构离子在高低电场间的ΔK(E)常存在明显差异,这使得FAIMS对离子的结构差异更加敏感,因此能够分离出结构相似而IMS无法分离的异构体离子[22,29-30]。但由于FAIMS对不同结构离子的分离原理尚不明确,虽可分离异构体离子,但特定离子异构体的CV值及结构尚无法相互推导说明。将FAIMS与IMS联用,凭借离子的IMS漂移横截面积及严格的分子动力学计算模型有望解决这一问题。
2.2 载气时FAIMS分辨力的影响
有研究表明[10-12],利用氮气/氦气的混合气体代替纯氮气作为FAIMS载气,可显著提升FAIMS的分辨力。由于图2c中的4个谱峰存在明显的重叠,为进一步提升FAIMS对蔗糖谱峰的分离效果,并评估该装置的分辨力,本研究采集了不同氮气/氦气比例下蔗糖的FAIMS谱图,示于图3。可观察到随着氦气比例的增加,各谱峰对应的CV绝对值均明显提高;当氦气比例超过30%时,蔗糖谱峰和背景峰可实现基线分离,而背景峰3的右肩处也逐渐演化出2个新的谱峰。结果表明,随着载气中氦气比例的增加,FAIMS的分辨力得到了显著提升。
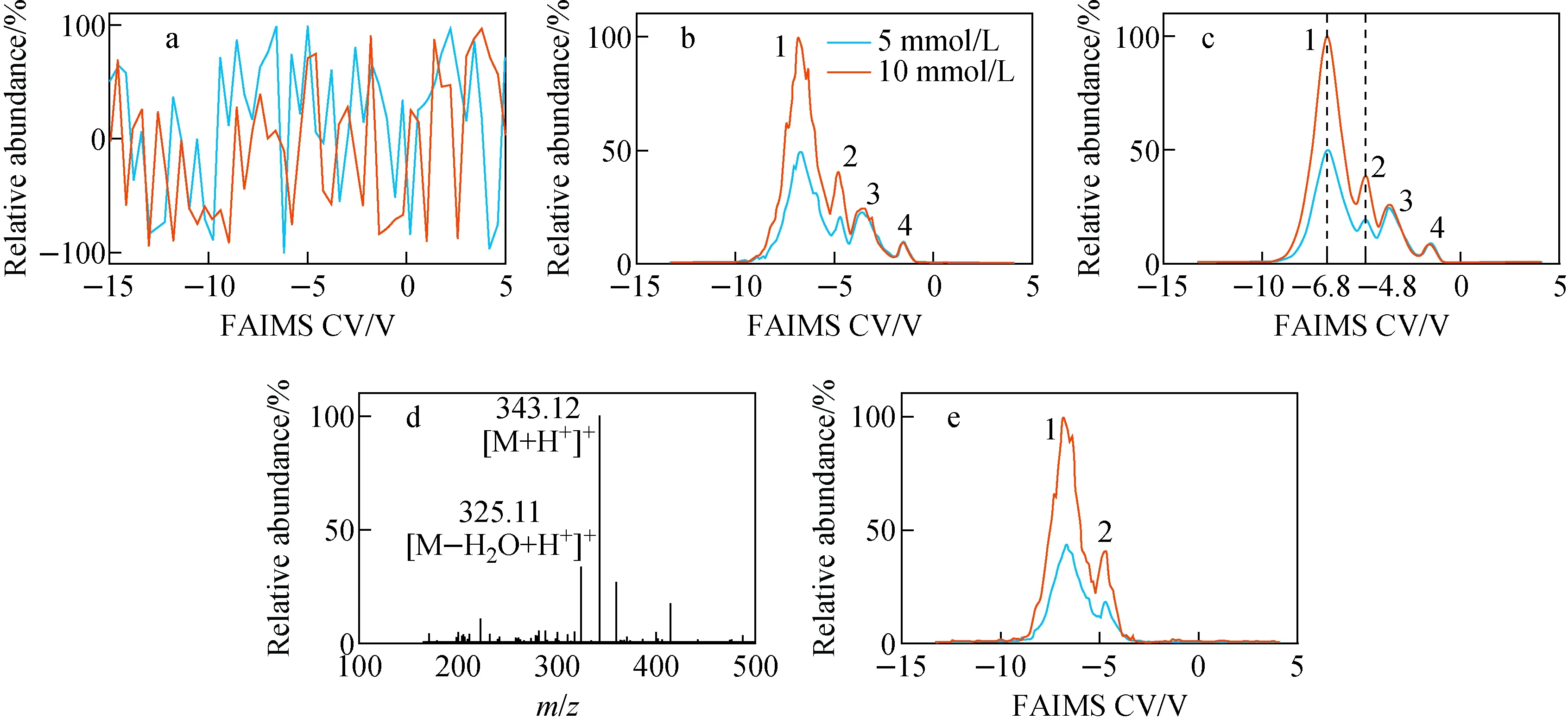
注:a.未添加屏蔽壳的FAIMS谱图;b.添加屏蔽壳的FAIMS谱图;c.算法滤噪后的FAIMS谱图; d.采集得到的MS谱图;e.根据特征离子筛选的蔗糖离子FAIMS谱图图2 5 mmol/L及10 mmol/L蔗糖溶液的FAIMS及MS谱图 Fig.2 FAIMS and MS spectra of sucrose solutions with the concentrations of 5 mmol/L and 10 mmol/L
在氦气比例增加的过程中,蔗糖离子双峰始终保持重合状态,且重合度不断提高。因此,为分析蔗糖离子双峰在不同氦气比例下的变化过程,利用基于二阶导及改进粒子群算法的重叠峰分离算法,提取了10 mmol/L蔗糖谱图中的双峰信号。分离后的蔗糖双峰示于图4,当载气中氦气比例低于40%时,该算法能有效分离信号中的重叠峰,且蔗糖双峰CV绝对值的差值随氦气的增加不断变小;当氦气比例达到30%时,双峰1、2的CV差值由100%氮气时的2 V减小为1.3 V,分辨率下降,由此导致双峰重合度提高;当氦气比例大于40%时,丰度较低的峰2被峰1完全覆盖,无法通过算法实现分离。
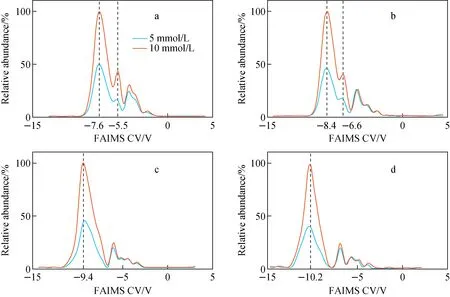
注:a.10%;b.20%;c.30%;d.40%图3 不同氦气比例下,不同浓度蔗糖溶液的FAIMS谱图Fig.3 FAIMS spectra of sucrose solutions at different concentrations with different He percentages
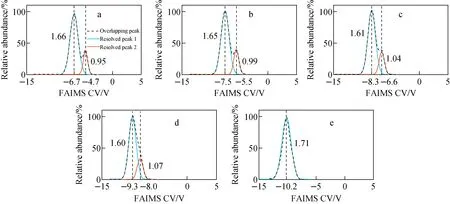
注:a.0%;b.10%;c.20%;d.30%;e.40%图4 不同氦气比例下,利用分离算法提取的蔗糖谱峰Fig.4 FAIMS spectra of sucrose solution resolved by separation algorithm with different He percentage
由图4中的半峰宽可知,在氦气比例由0%提高至30%过程中,峰1的峰宽减小0.06 V的同时,峰2的峰宽增加了0.12 V。这主要是由于FAIMS DV在分离不同结构离子的同时对离子存在加热效果,且加热温度随氦气比例的增加不断提高。当加热温度超过一定阈值时,特定离子的结构将逐渐向更稳定的方向变化。对于同分异构体,在FAIMS中特定构型离子所对应的CV绝对值越大,一般其结构较其他异构体更紧凑,受到FAIMS DV加热后更容易向展开的结构演化[23,29,31]。因此,随着氦气比例(加热温度)的不断增加,峰1的结构逐渐向峰2演化,由此造成离子间结构差异变小、双峰重合度提高,FAIMS分辨力提高,部分加热展开后的离子逐渐从峰1中被分离出来,造成峰1逐渐变窄,这些被解析出的离子结构逐渐接近峰2,被算法判定为是峰2的一部分,导致峰2逐渐变宽。上述实验结果解释了糖类离子结构在FAIMS加热影响下的衍变过程,说明基于二阶导及改进粒子群算法的重叠峰分离算法能有效分离FAIMS谱图中的重叠信号,从而对信号峰的丰度比、CV值、半峰宽、谱峰重合度等信息实现更精准的分析,显著提升了FAIMS仪器的整体性能。
为进一步评估氦气比例对FAIMS分辨率(resolution,R)及分辨力(resolving power,r)的影响,按式(2)和式(3)进行计算[10-11]:
r=|CVP|/wh
(2)
R=2.35|CVP1-CVP2|/(2wh1+2wh2)
(3)
其中,CVP是FAIMS谱峰在最大峰强处对应的CV值,wh是谱峰对应的半峰宽,CVP1和CVP2是相邻两峰在最大峰强处对应的CV值,wh1和wh2是相邻两峰对应的半峰宽。默认40%氦气下的峰为峰1,根据图4中标记的蔗糖双峰的CVP及wh,分别计算了不同氦气比例下蔗糖双峰对应的分辨力及分辨率,示于图5。随着氦气比例的增加,利用蔗糖双峰数据计算得到的分辨力值均相应提高。虽然峰2的CVP绝对值明显小于峰1,但由于其峰宽更窄,因此实际计算得到的分辨力更高。相较于肽类、蛋白质类等可带多电荷的物质,在本研究的溶剂条件下,蔗糖仅能带单电荷,因此CVP绝对值较小。同时,在相同实验条件下,蔗糖谱峰明显宽于肽类等的谱峰(约为血管紧张素Ⅰ的2倍,缓激肽的4倍[9,24]),导致目前计算得到的最大分辨力仅为7.32,远低于FAIMS装置可达到的实际最大分辨力。由于在FAIMS载气中增加氦气对于不同离子迁移率及结构的影响可能存在差异,由此造成双峰1、2间的重合度不断提高,分辨率逐渐降低,示于图5b。但该结果仍然说明,增加氦气比例可显著提高FAIMS的分辨力,且这一效果与已有研究[24]中提升FAIMS DV所产生的效果相同。证明在利用FAIMS对物质进行分析时,可以通过同时增加氦气比例及提高FAIMS DV等方式来提升FAIMS的整体分辨力。

图5 蔗糖双峰的分辨力(a)及分辨率(b)随氦气比例的变化曲线Fig.5 Variation curves of resolving power (a) and resolution (b) for sucrose sample with different He percentage
2.3 FAIMS对糖类同分异构体的分离
为进一步分析FAIMS对二糖同分异构体的分离效果,本文比较了纯氮气条件下10 mmol/L蔗糖和麦芽糖的谱图,示于图6。2种样品的FAIMS谱图存在相同的背景峰(图2c中的峰3和峰4);麦芽糖谱图中最左侧峰与图2c中蔗糖双峰1、2存在明显差异。通过考察不同浓度的样品实验和离子质荷比信息,推测差异峰分别是蔗糖和麦芽糖的FAIMS信号峰。其中,蔗糖峰1的CV绝对值最大,峰2的CV绝对值最小,麦芽糖介于二者之间。虽然蔗糖双峰及麦芽糖谱峰的CV值存在一定差异,但3个谱峰高度重叠,难以实现有效的定性分析。
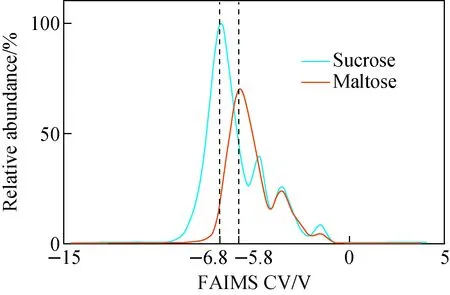
图6 纯氮气下,蔗糖、麦芽糖溶液的FAIMS谱图Fig.6 FAIMS spectrum of sucrose and maltose solutions with pure N2 as FAIMS carrier gas
为提高蔗糖、麦芽糖谱峰的分离度,在不同氦气比例下采集麦芽糖的FAIMS谱图,并利用分离算法提取2种二糖的谱峰,分离后的二糖信号示于图7。可以观察到,随着氦气比例增加,FAIMS的分辨力明显提升,2种样品对应的CVP绝对值均显著提升,但提升速度不同。根据图4和图7可知,当氦气比例由0%增加到40%时,蔗糖峰1的CVP绝对值增加3.5 V,推测峰2增加超4 V,而麦芽糖仅增加2.7 V,这使蔗糖峰1和麦芽糖峰之间的分离度持续变高,而蔗糖峰2与麦芽糖峰的分离度先降低(氦气比例0%~20%)后增高(氦气比例20%~40%)。当氦气比例达到40%时,由于蔗糖峰2被峰1覆盖,导致蔗糖与麦芽糖均只存在单一峰,谱峰分布明显简化,分离效果明显提升,2种物质主峰的重合度由纯氮气时的77%降至50%,CV差值由1 V提升至1.8 V,分辨率由0.36提升至0.67。这一结果表明,在FAIMS载气中添加氦气不仅可提升FAIMS分辨力,还能够更好地分离糖类同分异构体。此外,FAIMS DV加热可能不利于糖类离子结构多样性的研究,但在分析多种同分异构体物质时,能起到简化谱峰分布、方便物质定性分析的作用。
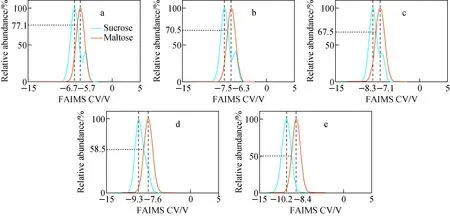
注:a.0%;b.10%;c.20%;d.30%;e.40%图7 不同氦气比例下,蔗糖、麦芽糖溶液的FAIMS谱图Fig.7 FAIMS spectra of sucrose and maltose solutions with different He percentage
3 结论
本文研发了一款可独立使用的新型FAIMS装置用于分析糖类异构体。该装置由高分辨平板型FAIMS、零相位滤噪算法及基于二阶导及改进粒子群算法的重叠峰分离算法组成,能够在分离不同离子的同时过滤噪声信号,并快速提取分析物谱峰,从而保证定性分析的准确性。同时,利用蔗糖和麦芽糖样品系统性地研究了该装置对糖类同分异构体的分离效果。结果表明,相较于IMS,该FAIMS装置对糖类离子的结构差异更敏感,能够分离出IMS无法识别的蔗糖离子结构;当载气为氮气/氦气的混合气体时,FAIMS能实现蔗糖和麦芽糖离子的分离,通过将氦气比例由0%提至40%,2种物质的谱峰重叠度由77%降至50%,分离效果明显提高。