蛋白质立体化学修饰的离子淌度质谱研究进展
许 霞,朱致君,李灵军,李功玉,3
(1.南开大学化学学院分析科学研究中心,天津市生物传感与分子识别重点实验室,天津 300071; 2.威斯康星大学麦迪逊分校化学系和药学院,威斯康星州 53705; 3.物质绿色创造与制造海河实验室,天津 300192)
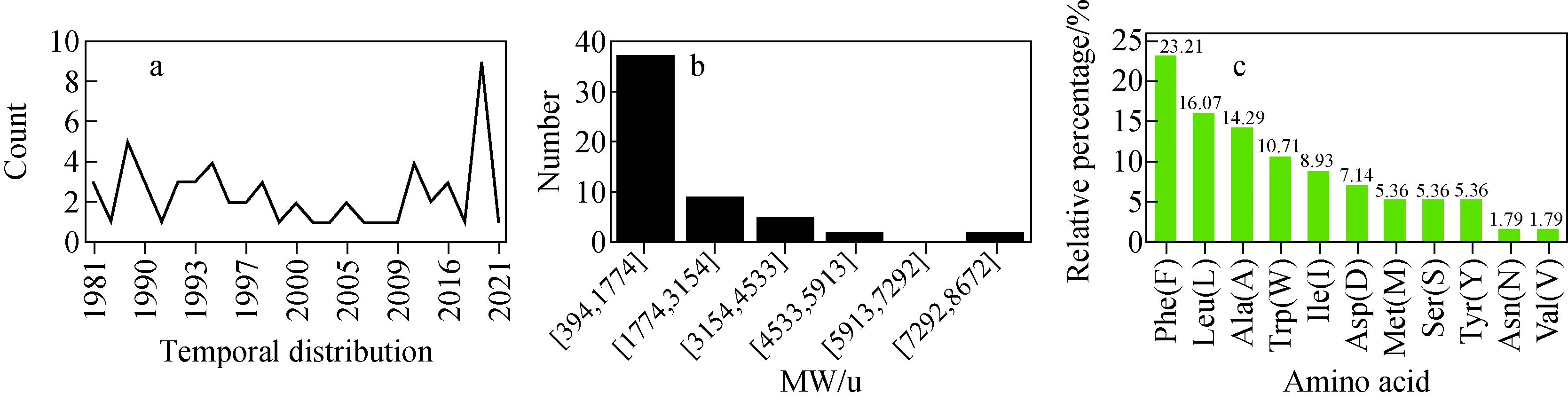
图1 立体化学修饰多肽蛋白的发现年代(a),分子质量(b)及突变位点统计(c)分布Fig.1 Distributions of temporal (a), molecular weight (b) and mutation site distribution (c) of stereochemically modified peptide/protein
立体化学修饰的多肽蛋白(stereochemically modified peptide/protein, SCMP)是天然存在的一种含量较低,但与多种疾病相关的蛋白形式。与其他常见的蛋白质翻译后修饰类似,立体化学修饰(stereochemical modification, SCM)调控着一系列重要蛋白的结构和功能。大量研究表明[1],信号转导神经肽的修饰直接影响生物活性。因此,研究以SCMP异构体形式存在的神经肽和蛋白质结构对于阐明其构效关系具有重要意义[2-7]。
多肽蛋白立体化学修饰可导致天然氨基酸空间立体异构化。目前报道最多的SCMP是单位点或极少数位点由L-构型异构化为D-型,这类蛋白和多肽最早被美国伊利诺伊大学香槟分校Jonathan Sweedler课题组[7]命名为包含D-型氨基酸的多肽/蛋白(D-amino acid-containing peptide/protein, DAACP)。立体化学修饰数据库正在逐年扩大,截至目前,至少有55种蛋白多肽体系中存在立体化学修饰,列于附表1(请登录《质谱学报》官网http:∥www.jcmss.com.cn下载)。已报道的大部分SCMP分子质量集中分布在400~2 200 u之间,少数的分子质量超过5 000 u;氨基酸的突变位点大多发生在N端的第2、3位上,其中以苯丙氨酸、亮氨酸和丙氨酸的突变数量最多,示于图1。突变位点规律性主要取决于宿主生物的酶促体系,而分子质量分布范围在很大程度上受限于立体化学修饰鉴定手段和仪器设备的灵敏度及适用范围。
这些SCMP的发现主要来源于单细胞甲壳类等低等生物,包括海蛞蝓加利福尼亚海兔[8-9]、美洲龙虾[10]、小龙虾克氏原螯虾[11]、鸭嘴兽[12]、锥螺的毒液[13]、漏斗网蜘蛛和南美树蛙[14-15]等。立体化学修饰经常在动物毒液中被检测到,也有在人类各种组织(包括牙齿、皮肤和大脑)的衰老蛋白中D-异构化氨基酸残基的报道[16]。由于内源性酶只识别由L-氨基酸组成的蛋白质和肽,而在大多数神经肽中DAACP通常含有1个D-氨基酸,对内源性酶具有更大的抗性。因此,SCMP往往比天然蛋白多肽具有更长的寿命[17-18]。一般认为,动物细胞中大多数SCMP的生成与酶促反应相关,与此同时,酶促反应之外的化学调控因子也可能参与人体组织中几种年龄依赖型蛋白的立体化学修饰[19]。与内源性神经肽相比,在许多情况下,立体化学修饰的神经肽异构体具有更高的生物活性[7,18]。但也有报道[20]指出,相比于全位点突变,单位点或者部分位点突变的DAACP具有更高的毒性。这表明,增加立体化学修饰的检测和识别能力,对探究SCMP的发生过程与机制、化学调控、以及靶向SCMP药物开发与设计都起着重要的支撑作用。
与其他修饰不同,立体化学修饰并没有引起蛋白和多肽分子质量的改变,基于质谱的常规蛋白多肽检测技术难以实现对SCMP的有效分离与鉴定。离子淌度质谱(ion mobility-mass spectrometry, IM-MS)受益于离子淌度仪在质谱基础上进行的二维分离,不仅具备分析速度快和耗样量少的优点,而且可以根据目标离子的构象与尺寸在毫秒级时间尺度上进行高效分离分析。随着硬件、软件和数据分析等方面的快速发展,近些年来IM-MS技术已成为SCMP分离分析与快速鉴定的一种重要方法[2,4,21-27]。
本文将围绕离子淌度质谱和非变性质谱的核心技术,重点介绍多种商业化离子淌度仪的性能差异、SCMP高分辨离子淌度质谱分离分析与鉴定方法的最新进展、SCMP与受体相互作用的结构质谱表征策略,并展望立体化学修饰与离子淌度仪的发展方向与应用前景。
1 离子淌度质谱的工作原理与常见类型
1.1 工作原理
离子淌度质谱(也称“离子迁移质谱”)是在常规质谱的基础上串联离子淌度仪,根据质荷比(m/z)以及离子迁移率实现目标离子的二维在线分离。IM-MS的基本工作原理是离子在漂移管飞行时与缓冲气体(通常为氮气、氦气和氩气)碰撞,由于离子形状、大小和电荷数不同而受到的阻力不同,在相同电场中通过相同距离漂移管所需要的时间不同,由此实现对目标离子的快速分离。通过一定的物理模型与近似处理,可将迁移时间转换成与离子结构相关的物理参数——碰撞截面积(collisional cross-section, CCS)。与传统质谱相比,离子淌度质谱可以对m/z相同的离子在离子淌度维度进行二维分离,提高了构象分析效果。IM-MS分离的基本原理可以用 Chapman-Enskog 和 Mason-Schamp[28]方程的理论来解释,示于式(1)。
(1)
式中,K为缓冲气体中特定离子的迁移率,提供了有关离子在穿过缓冲气体时所经历的相互作用信息;μ(μ=mM/(m+M))为扩散离子(m)和载气分子(M)这一碰撞粒子对的约化质量;kB为玻尔兹曼常数;T为开尔文温度;z为离子电荷数;e为元电荷所带的电荷量(C);N为中性气体数密度(m-3);Ω为碰撞截面积(m2)。式(1)给出了离子迁移率K与CCS之间的直接关系。离子在漂移管中受库仑力和气体分子碰撞阻碍力的作用,其通过漂移管所需的时间(td)与K直接相关,而这取决于离子的形状、质量和电荷量。在简化模型中,K取决于离子与气体分子的碰撞频率,该频率与气体数密度(N=每单位体积的气体分子数)有关。因此,离子迁移率与气体压力(p)和温度(T)相关。实验室常用的约化迁移率(K0)通过式(2)计算:
(2)
式中,p为气体压力,p0为IUPAC标准压力(即100 kPa),T0为标准温度(即273.15 K)。根据气体动力学理论,假设漂移管在低电场条件下发生纯弹性碰撞,td可转化为CCS,示于式(3):
(3)
式中,变量E、L、P分别对应电场强度(V/m)、漂移区长度(m)和压力(Torr)。
1.2 常见类型及其性能对比
IM-MS的仪器构造大部分是将IMS连接到TOF-MS上,近些年也有将IMS连接到Orbitrap MS上的报道[29]。IM-MS主要根据IMS分型进行分类,根据技术特点,离子淌度仪主要分为时间扩散型(time-dispersive)、空间扩散型(spatially dispersive)以及场分散扫描型(field-dispersive scan)[28,30-31]3类。根据基本构造,目前商业化的IMS主要包括5大类,示于图2。其中,漂移管离子淌度仪(DTIMS)和行波离子淌度仪(TWIMS)属于时间扩散型,微分迁移率分析仪(DMA)和高场不对称离子淌度仪(FAIMS)属于空间扩散型,而捕获离子淌度仪(TIMS)则属于场分散扫描型。提升结构分辨率一直是离子淌度仪发展的主要方向,包括硬件升级改造、原理方法创新以及高级数据采集与分析系统开发等。5种离子淌度仪的主要特点及分辨率信息列于表1。
1.2.1漂移管离子淌度仪 漂移管离子淌度仪(DTIMS)是最早出现、最为经典的IMS技术。早在20世纪30年代,Bradbury等[32]就采用DTIMS研究气相离子迁移率K。DTIMS由一系列叠环电极组成,在这些电极上,漂移管的轴线上产生了近似均匀的电场。载气和气态样品被引入电离区,而逆流流动的中性气体(主要是氮气、氦气或氩气,被称为漂移气体)从检测区的一侧引入[33],在漂移管腔体内没有特定的流动方向。离子在有中性气体分子存在的漂移管中通过均匀、连续的电场,以恒定的速度移动。从离子通过漂移管的时间可得离子迁移率K。一般来说,CCS越小、电荷量越高,离子的迁移速度越快。化合物在较高分辨DTIMS中能够实现良好的分离,并通过第一性原理可直接得出CCS值,实验中,通常在不同电场下多次测量以获得最准确的CCS值。由于DTIMS分析采用离子脉冲模式,其占空比相较于连续IMS要低。
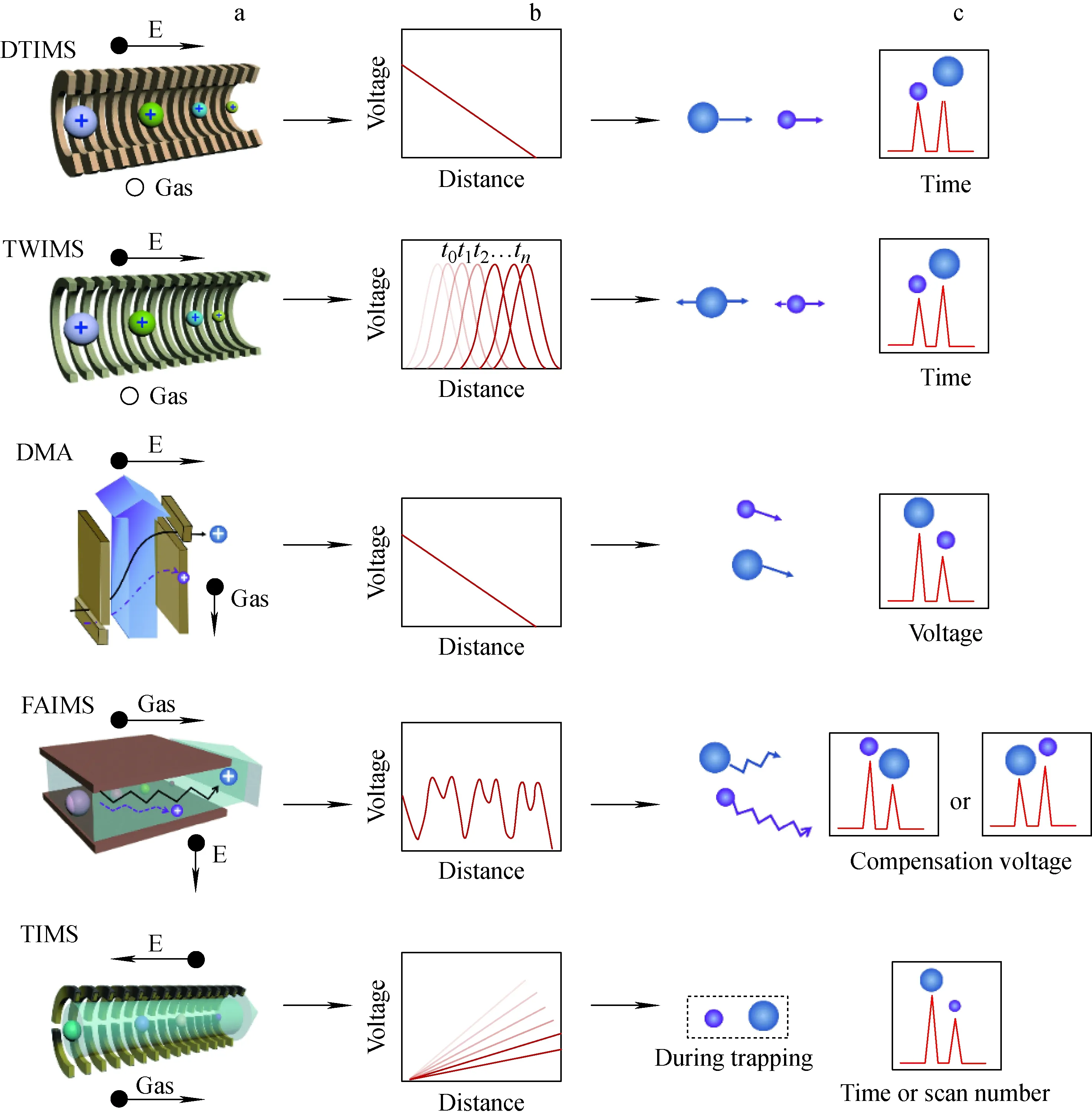
注:a.构造示意图,由文献[36]改编;b.气体动力学描述;c.离子运动规律示意图图2 目前市场上5种主要离子淌度仪的结构特点示意图Fig.2 Schematic diagrams of different types of IM-MS on the market
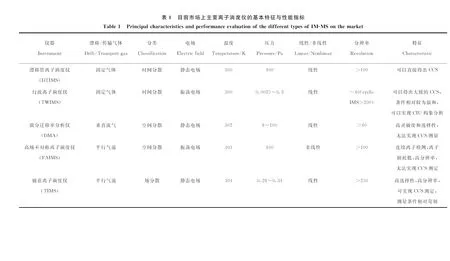
1.2.2行波离子淌度仪 2006年,美国Waters公司推出首个商业化的基于行波离子淌度仪(TWIMS)的Synapt HDMS[34]离子淌度质谱仪,随后,于2011年和2013年推出二代基于TWIMS的离子淌度质谱仪,分别为Synapt G2-S和Synapt G2-Si。目前,TWIMS已成为最成熟的IMS技术。TWIMS由施加了行波电压的堆叠环离子导向器组成,将相反相位的射频电压施加到相邻的环形电极以提供径向离子捕获,从而实现高效率传输。脉冲直流电压从设备的一端到另一端连续叠加到每个电极的射频电压上,从而轴向推动离子。在固定的脉冲停留时间后,电压施加到下一个电极对,由此产生行波。针对第一、二代仪器相对较低的分辨率,仪器厂商对TWIMS结构进行了优化,如无损离子淌度仪(structure lossless ion manipulation, SLIM)[24-25,35-36]。SLIM气相分离的基本原理与TWIMS类似。由于SLIM中工作气压较低,在射频聚焦电场的辅助下,离子可以在SLIM中稳定存储数小时以上,同时实现近乎无损的传输[37]。TWIMS能够在比DTIMS更小的装置中实现相近分辨率的淌度分离,大大缩小仪器体积。在实现较高分辨率的同时,TWIMS还可以更好地与商品化质谱仪联用。环状离子淌度仪(cyclic IMS, cIMS)[38]是Waters公司最新推出的高分辨离子淌度仪,与TOF MS联用,实现了超过200结构分辨率(基于离子迁移时间计算)的高分辨分离分析,可用于微小结构差异区分。该仪器未来可以改进的空间包括:改善由于多圈扫描引起离子损耗而灵敏度下降的问题、建立完善的多圈扫描后CCS校正方法以及提高操作界面用户友好性等方面。
1.2.3微分迁移率分析仪 微分迁移率分析仪(DMA)是IMS的一种特殊结构[39-40],其工作方式与DTIMS类似,都是利用恒定电场,并且均可以测量K值。DMA是基于一个方向的电泳迁移和正交方向的流体驱动迁移在空间上分离离子。在DMA中,所有离子必须移动相同的距离到达探测器,只有具有指定迁移率的离子才能从 DMA 的入口穿越到出口。圆形柱是最常用的DMA类型,它由2个圆柱形和同心金属电极组成[41]。DMA的分离是通过2个垂直的力叠加在离子上完成的,2个阻力分别来自高流速的鞘气和1个垂直的电场。利用高鞘流速进行空间分离,可以获得更高的分辨率和灵敏度。DMA通常用作过滤装置,仅允许在给定的时间传输具有特定淌度值或淌度特性的离子,可以提高分析的选择性,但对于较宽范围的淌度分析,其速度较慢、灵敏度较低。
1.2.4高场不对称离子淌度仪 高场不对称离子淌度仪(FAIMS)最早是由前苏联人发明的,于20世纪90年代中期被引入北美后迅速发展。与基于时间分离的DTIMS和TWIMS不同,FAIMS是一种空间电迁移谱仪[42-43]。作为离子迁移谱中较为特殊的一类,FAIMS是利用离子迁移率在高电场下的非线性变化规律进行分离。在FAIMS中,带电粒子暴露于具有相反极性的不对称波形中,这种高电场和低电场周期性交替的非对称波形导致带电粒子在一对等间距的电极之间遵循锯齿形模式运动,并且由于离子迁移率对非线性电场的依赖性而发生分离。FAIMS具有连续的离子监测能力,并基于离子迁移率正交分离的功能实现高分离选择性;此外,能够同时检测正、负离子,并且具有核心部件小等优点。但在FAIMS仪器中检测到的离子丰度相对较低,降低了其检测灵敏度。
1.2.5捕获离子淌度仪 捕获离子淌度仪(TIMS)是一种相对较新的气相分离仪器[44],由Park等[45-46]于2011年提出,是Bruker公司的专利技术。TIMS将一组电极划分为入口漏斗、TIMS迁移区和出口漏斗3个区域。入口和出口均可控制离子的偏转和聚焦,TIMS的迁移区域可以通过同向平行气流和反向电场之间的相互作用来积累、捕获和洗脱目标离子。首先,离子在TIMS中被捕获,利用径向约束的射频电场和轴向非均匀电场使离子在气流中保持静止;随后,离子在迁移区受高速气流推动力和反向电场阻力的作用,而反向电场强度随分离区轴线位置呈线性变化,其方向与高速气流相反[47-48]。当气流速率与离子迁移速率相等时,离子相对于漂移管保持静止,即不同离子根据迁移率K的差异分布在不同电场强度的位置。离子截面积越大,离子淌度越小,维持静止所需的电场强度越高,即稳定在高场区域[47,49]。跨IMS隧道区域施加的电压梯度使多种异构体被同时捕获,但在不同的电压值处被富集,通过逐步降低电场释放离子,以实现离子的逐步洗脱。TIMS通常与四极杆飞行时间质谱联用,在保证灵敏度的前提下,可以有效提高仪器的分离能力。
2 立体化学修饰的多肽蛋白发现流程与高分辨离子淌度质谱分离分析
一般认为,SCMP的发现基于传统蛋白组多肽组学工作流程[50],主要包括大规模蛋白多肽提取,样品纯化分析与氨基酸序列鉴定,结构、功能表征并与试管合成标准物比对,立体异构化氨基酸的鉴定与验证4个关键步骤,示于图3。
本文主要关注离子淌度仪在SCMP发现过程中的作用,即其在立体异构氨基酸分离分析与鉴定中的应用方法学开发。与其他分离技术,如高效液相色谱(HPLC)[51],毛细管电泳(CE)[52]等相比,离子淌度仪可以在更短的时间尺度上对异构体进行分离,同时还可以测定异构体的结构信息[53]。离子淌度质谱分析的一大挑战是使用传统商业化仪器时往往受到固有结构分辨率以及总分离时间等因素的影响,难以对大部分SCMP混合物实现基线分离。因此,本文将以如何提高离子淌度质谱的结构分辨率为主线,围绕串联质谱、硬件改造以及多维差异放大等方面,总结近些年来的研究进展。
2.1 基于串联质谱的结构分辨率提升方法
串联质谱是一种快速检测与测序的方法[54-58]。对于同分异构体的鉴别,一级质谱(MS1)只能提供相同的m/z信息,无法实现异构体的区分;而二级质谱(MS2),如高能碰撞解离(higher-energy collisional dissociation, HCD)和碰撞诱导解离(collision-induced dissociation, CID),可以通过提供不同的碎裂途径生成信息丰富、结构重要的产物离子,为识别和鉴定异构体提供互补的结构信息[59]。虽然异构体在串联质谱中可能产生难以区分的离子迁移率到达时间相似的碎片离子,但通过CID技术结合化学计量学方法可以有效区分离子淌度重叠的异构体。Julian课题组[57]利用自由基诱导解离(radical directed dissociation, RDD)和CID串联质谱技术鉴定多肽异构体,并发现了新的异构化位点。李灵军课题组[25]开发了液相色谱-串联质谱-行波离子淌度质谱(LC-MS/MS-TWIMS)法快速、可靠地鉴定手性突变多肽中D-氨基酸位点,示于图4a。该方法通过反相液相色谱从复杂混合物中分离手性多肽,用离子淌度质谱对其经CID产生的b、y碎片离子进行结构检测,通过评估与L型对映体的b、y碎片离子的漂移时间或者碰撞横截面间的变化差异定位D-氨基酸残基。研究者使用该方法揭示了龙虾体内甲壳类高血糖激素从N端起第3个氨基酸(L-苯丙氨酸到D-苯丙氨酸)的异构化。此外,还可以通过串联质谱与金属加合物结合的策略增强IM-MS的分离性能,如DAACP中D-残基的定位、拓扑异构体鉴别和肽异构体的改进分离等[22,24,60-61]。
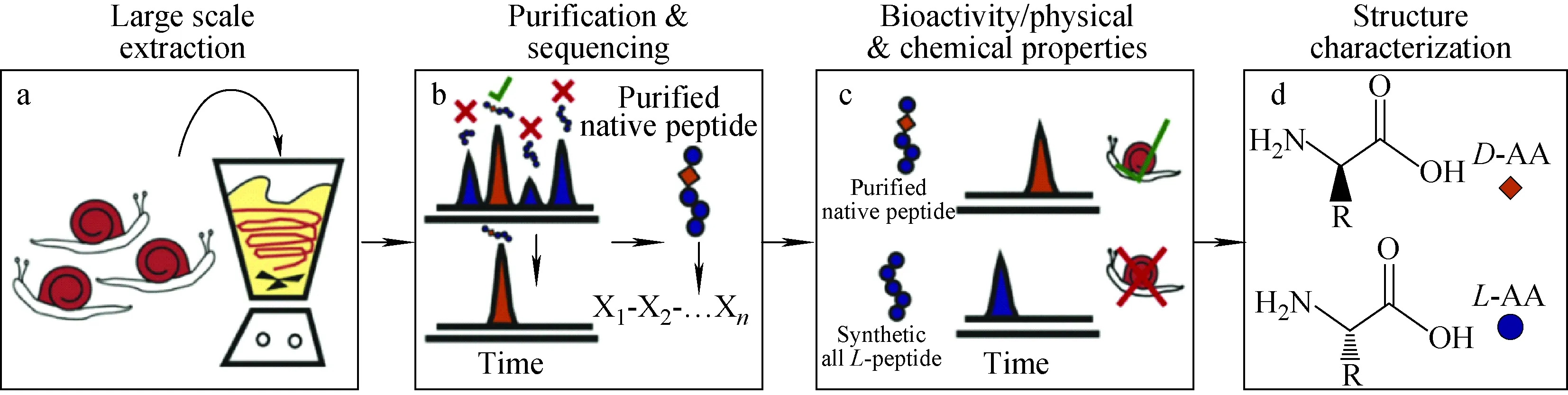
图3 发现、鉴定SCMP的常用工作流程[50]Fig.3 Workflow for discovering and identifying SCMP[50]
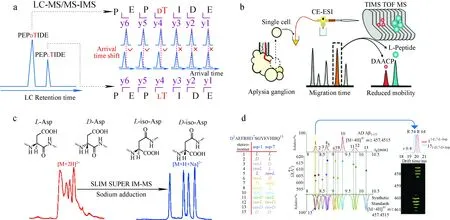
注:a.LC-MS/MS-TWIMS鉴定手性多肽D-氨基酸残基位点[25];b.CE-TIMS-MS超高分辨分析与 鉴定单细胞中多肽立体化学修饰[62];c.SLIM SUPER IM-MS高分辨分离分析Aβ17-28多肽差向异构体[64]; d.2D-LC-DTIMS-MS鉴定阿尔兹海默症病人的Aβ蛋白片段差向异构体[68]图4 4种基于离子淌度质谱的手性多肽快速分离分析与鉴定方法Fig.4 Fast separation and identification of DAACP based on IM-MS
2.2 基于仪器硬件改造与软件升级的结构分辨率提升方法
近年来离子淌度技术发展迅速,在仪器分辨率方面获得了显著提升。Fouque等[24]报道了一种利用TIMS仪器实现SCMP异构体超高分辨率分离分析的方法,其中基于CCS值计算的分辨率可达340。研究者利用TIMS对一些CCS值差异低至1%的手性多肽与其L型对映体实现了基线分离。以一种含有29个氨基酸残基的手性多肽(GRF)为例,该方法在D/L-GRF多肽400∶1的混合物中实现了基线分离和手性定量分析。Mast等[62]成功将毛细管电泳技术与TIMS-MS联用,并应用于海兔单个神经结细胞中手性多肽的分析,示于图4b。结果显示,神经组织中来自胸膜前体的Plrn2多肽有44%存在D-氨基酸残基。Berthias等[63]使用FAIMS对含有42个氨基酸残基的手性多肽及其差向异构体实现了基线分离,最大分辨率可达159。Nagy等[64]将一种基于TWIMS的新型超高分辨离子淌度质谱(TW SLIM SUPER IM-MS)[65]用于研究β淀粉样蛋白(Aβ)片段Aβ17-28肽段,示于图4c。由于Asn27可以通过异构化脱酰基生成Asp,与Asp23相同,均存在4种外消旋化异构体,研究者采用直接进样的方法对16种Aβ17-28多肽异构体进行分离分析。得益于SLIM的超高分辨率,在1 s内实现了这16种异构体钠加合离子[M+H+Na]2+的基线分离。此外,Waters公司研发的基于TWIMS的环形离子淌度质谱仪也被应用于手性多肽的研究[66]。通过与超高效液相色谱联用,在45 s色谱保留时间窗口内,通过4圈环形离子淌度循环(~50 ms,R~130)使共洗脱的手性多肽达到有效分离。该技术基于保留时间-漂移时间二维分离策略,对11种异构化的多肽实现了分离。结合b、y碎片离子的漂移时间,成功鉴别出手性多肽的单位点及双位点修饰。
2.3 基于多维差异放大和多维分离技术的结构分辨率提升方法
在无法实现快速更新仪器硬件的情况下,多维手性差异放大和多维分离技术的应用显得尤为重要。在某些情况下,还需要串联其他分离技术(如 LC 和 CE),以提高复杂混合物中肽异构体的检测覆盖率[4,67-68],同时结合多维数据可视化[69]和计算建模[70],辅助基于IM-MS的多肽异构体结构分析。
本课题组[61]利用TWIMS平台发现,有些D-和L-多肽单体在离子淌度检测中的差异很小,但以寡聚体形式存在的D/L多肽结构差异比单体更大,放大了单体的手性结构差异。在此基础上,本课题组[71]提出了一种基于金属离子结合的多维手性差异放大策略,适用于从单体、寡聚到受体相互作用的手性效应研究,被称为复合型手性分析平台(integrative chiral anatomy platform, iCAP)。通过建立以多肽质子化峰、结合1个金属峰和结合2个金属峰这3种形式的以CCS为坐标的三维体系,成功放大了多肽的手性效应,将原本在较低分辨率淌度平台难以区分的D-和L-神经肽在三维空间中有效地区分开来。离子淌度数据采集模式的创新提升了分离效果。Agilent公司将基于阿达玛变换(Hadamard transform)的多重复用离子注射法[72]应用于DTIMS,在不需增加数据采集时间和离子淌度扫描范围的前提下,产生了7~8倍的信号增益,并且将占空比提高到50%,离子淌度分辨率从60提升到了180~250[73]。运用这种新型数据采集方式,Mukherjee等[68]搭建了2D-LC-IMS-MS平台,从阿尔兹海默症病人的脑组织中检测到了一系列由天冬氨酸异构导致的Aβ手性多肽异构体,示于图4d。
3 立体化学修饰多肽蛋白与其受体相互作用的结构质谱分析方法
目前,手性神经肽受体分析研究受到广泛关注,例如,全氨基酸手性反转的多肽异构体由于对抗酶消化的显著抗性,有望用于开发新的候选药物[20,74]。尽管异构化有着独特的功能,但其结构变化往往不显著,这是因为大部分神经肽只有个别氨基酸位点会发生D-异构化[7]。为了有效解析立体化学修饰对重要蛋白多肽的构效关系,开发高分辨的神经肽异构体结构分析工具是重要的发展方向。
3.1 神经肽受体的常规生物物理研究方法
目前关于DAACP的完整生理作用研究较少,尤其是缺乏探讨DAACP与其同源受体相互作用方面的报道。Sweedler课题组[50]在加利福尼亚海兔中新发现了一种包含D-氨基酸的多肽(ATRP),该多肽既能激活受体(G-蛋白偶联受体),又能激活神经元靶点。与之前报道的DAACP及其全L-残基类似物不同,L-ATRP和D2-ATRP都是G-蛋白偶联受体的强效激动剂,且均在电生理实验中具有活性。在此基础上,该课题组又研究了来自单一神经肽前激素,即海兔素样神经肽前体(apALNP)的几个DAACP信号转导与结构的关系。为了深入了解通过apALNR的配体信号,该课题组建立了来自apALNP的天然和非天然神经肽类似物的数据库,并评估它们在与apALNR和混杂的Gα亚基Gα-16共转染细胞中的活性。这不仅研究了常规神经肽与受体的作用关系,还对DAACP与其神经肽受体的构效关系进行构象研究[75]。关于DAACP三维构象如何影响受体活性,以及D-残基在这些肽构象中发挥作用的研究很少。为了研究构效关系,该课题组使用建立计算模型、DTIMS分析和受体激活分析相结合的方法创建了简单模型,预测了一系列多肽GdFFD类似物的生物活性。该模型有助于建立GdFFD类似物结构与活性之间的联系,并强调GdFFD受体apALNR上1号位置肽活性的空间效应。
3.2 碰撞诱导去折叠技术辅助神经肽受体的结构解析
碰撞诱导去折叠(CIU)是非变性离子淌度质谱技术的重要工具,可以实现气相蛋白结构的快速精准操控。目前,基于CIU-IM-MS技术的神经肽受体研究报道较少,主要是由于受体来源有限、表达量低,且难以从现有的蛋白生产系统中分离纯化。IM-MS在包括膜蛋白在内的其他蛋白体系中取得了重要的研究进展,因此,利用IM-MS技术对神经肽受体的结构研究将得到越来越多的关注[76-77]。
由于商用IM-MS装置分辨率的限制,在保持对神经肽受体等生物大分子足够的灵敏度的同时,往往需要其他气相结构操纵技术的协助,以获得目标神经肽受体的详细信息[78]。将CIU[79-84]集成到IM-MS中可以增加分辨维度,并且能够有效区分CCS非常接近的蛋白质构象。当蛋白质离子在气相中受到碰撞加热时,通常遵循特定的去折叠路径,得到结构特异性的CIU指纹图谱[85-86]。因此,CIU技术有望成为分析神经肽受体的有力工具。
基于CIU-IM-MS的手性多肽与蛋白受体相互作用的研究过程包含溶液相孵育、非变性质谱测定和CIU构象操控3个关键步骤,示于图5a。D/L-构型的多肽与蛋白受体结合后,通过非变性质谱可以观测到显著不同的结合力和结合计量学信息。更重要的是,不同手性的多肽与受体结合形成的复合物可能展示显著不同的气相去折叠路径,这种差异可以通过相关的数据分析软件进行可视化和定量比较。本课题组[71]通过绘制CCS值与碰撞电压的关系图,初步探索了CIU技术在立体化学修饰受体作用复合物构象差异分析中的应用方案,示于图5b。CIU指纹图谱的特征条带数量及其变换信息可用于蛋白构象及结构域稳定性的快速分析。图5b展示了人血清白蛋白的CIU指纹图谱,从中可以推断出至少4个主要构象中间体以及3个核心结构域信息,这与人血清白蛋白的晶体结构相符。为了定量表征D/L-构型多肽在受体结合时的结构差异,本课题组使用Ruotolo课题组[87]开发的CIUSuite工具包,其中2个关键参数是半数构象去折叠电压(CIU50)和均方根差(RMSD)。通过对比结果,发现虽然CIU50值并没有显著差异,但不同手性多肽结合受体复合物的整体构象与去折叠CIU路径却有较显著的差别(RMSD达到14.30%,一般基线背景RMSD小于5%)。

注:a.L-和D-构型多肽与受体结合流程示意图;b.IM-MS在解决D/L构型方面的实例[71]图5 IM-MS在区分D/L构型多肽与受体结合时的工作流程图及实例Fig.5 Flow schematic diagrams and examples of IM-MS in differentiating the binding of D/L peptides to receptors
4 总结与展望
离子淌度质谱联用技术有效加速了蛋白质立体化学修饰的分离分析和定性定量鉴定,在人类疾病相关的蛋白体系方面的应用有了初步进展。但目前立体化学修饰的离子淌度质谱大部分集中在简单体系(如单细胞生物)的研究,相比于其他翻译后修饰的鉴定分析方法,该方法不够成熟,在样品提取、富集分离、仪器参数、数据采集和可视化分析等方面仍有很大的改进空间。为了绘制人类多种重大疾病相关的蛋白质立体化学修饰图谱,需要进一步开发定量分析方法及其在生物组织内空间分布的测定方法,以获得更全面的生物学信息。
1) 立体化学修饰的定量组学分析:现行大部分离子淌度质谱方法主要集中于纯化体系的研究,在组学水平上的立体化学修饰鉴定方法仍有较大的改进空间,如开发立体化学修饰特异性、兼容的多重等质量同位素定量标签标记技术,有望实现对不同生物环境下分析物中手性多肽的相对和绝对定量。
2) 立体化学修饰的空间分辨组学分析:将离子淌度与质谱成像相结合,基于手性多肽分析物的碰撞截面积信息,可将其与对应的L型多肽异构体区分开,从而特异性地获取其在生物组织切片中的分布,直观地呈现手性多肽产生与作用的区域。与此同时,可以比较手性多肽与其潜在受体在同一组织内的空间分布,探究其与受体相互作用的规律。
3) 立体化学修饰的高分辨仪器开发:随着仪器设备和分析方法的发展,更高分辨率的离子淌度仪可以使较大的手性多肽(>40残基)及其L型多肽异构体在不需要酶解的前提下快速拆分和鉴定,简化了分析步骤,并缩短了检测时间。
4) 立体化学修饰的串联质谱分析:近年来,基于新型碎裂模式的串联质谱技术逐渐用于分析手性多肽。RDD模式对前体离子结构较为敏感,可以根据串联质谱图中碎片离子的相对强度实现对手性多肽的鉴定及定量[57]。基于碎片离子的相对强度,电子捕获裂解(electron capture dissociation, ECD)也被用于区分多肽中的Asp和isoAsp[88]。未来还可尝试将紫外光致解离(ultraviolet photodissociation, UVPD)、电子诱导解离(electron induced dissociation, EID)和红外多光子解离(infrared multiple photon dissociation, IRMPD)等串联质谱模式与离子淌度分离相结合,建立更有力的手性多肽鉴定与定量方法。
5) 立体化学修饰的构效关系研究:立体化学修饰的构效关系是其发挥生物学功能的重要分子基础之一。目前,相互作用分析仪在结构分析灵敏度和样品消耗等方面均存在不利于立体化学修饰分析的因素。超高灵敏结构分析技术的开发将大大推进该领域的发展。此外,分子动力学模拟能够从原子层面给出体系的微观演变过程,尤其是结合实验测量数据,如离子淌度质谱指导下的分子动力学模拟,将为解构SCMP高分辨三维构象和全景式构象分析提供可能。