新型吡唑酰胺类农药吡噻菌胺的研究进展
韩文浩,颜振敏,吴艳兵,蔡光辉,赵莉蔺,李 薇,陈增龙
(1中国科学院动物研究所农业虫害鼠害综合治理研究国家重点实验室,北京 100101;2河南科技学院资源与环境学院,河南新乡 453003)
0 引言
吡唑酰胺类杀菌剂是同时含有吡唑和酰胺两种高活性官能团的新型琥珀酸脱氢酶抑制剂类杀菌剂(SDHIs)[1-4]。SDHIs是全球继甲氧基丙烯酸酯类和三唑类杀菌剂之后的第三大类杀菌剂,也是近年来销售额年复合增长最快的杀菌剂品种[5]。它通过抑制线粒体呼吸电子传递链中的琥珀酸脱氢酶或琥珀酸泛醌还原酶进而抑制病原体线粒体呼吸作用,达到杀菌的目的;由于SDHIs结构新颖、活性高、杀菌谱广,能有效提高作物的品质和产量,已成为目前杀菌剂市场的主体类别[2-4]。SDHIs与甲氧基丙烯酸酯类杀菌剂因作用位点不同而无交互抗性,通过两类杀菌剂复配使用,还可以延缓靶标抗性的产生,扩大防治谱[3,6]。
吡噻菌胺(Penthiopyrad)是由日本三井化学研发的用于防治叶面和土传病害的新型SDHIs[3,7]。与早期开发的SDHIs不同,吡噻菌胺不仅防治传统SDHIs(如碳毒素、氟甲苯胺等)靶标担子菌,还可以防治子囊真菌,这也区别于传统甲氧基丙烯酸酯类杀菌剂[8-9]。2009—2016年吡噻菌胺复合年增长率高达42.6%,在SDHIs产品中居于首位,表现出良好的应用前景[5,10]。国际理论应用化学联合会(IUPAC)将其命名为(RS)-N-[2-(1,3-二甲基丁基)-3-噻吩基]-1-甲基-3-(三氟甲基)吡唑-4-甲酰胺(图1)[11]。常温下,吡噻菌胺的水溶性较低(1.375 mg/L),而在甲醇、丙酮和乙酸乙酯中的溶解度达到3.5×105~5.6×105mg/L。吡噻菌胺亲油性较好,辛醇/水分配系数LogP为4.62(pH 7,20℃);饱和蒸气压为0.6×10-3MPa,表明其挥发性较低[10-12]。吡噻菌胺的每日允许摄入量(ADI)为0~0.1 mg/kg,急性参考剂量(ARfD)为1 mg/kg[13]。吡噻菌胺自上市已在全球约30个国家登记使用,包括美国、日本,以及欧盟等14个成员国等[8,14]。主要登记剂型有悬浮剂(SC)、水分散粒剂(WG)和种子处理悬浮剂(FS)等,可用于谷物、蔬菜、果树、观赏植物和草坪上由链格孢属、丝核菌属、葡萄孢属等病原菌引起的病害,包括锈病、菌核病、灰霉病等[14-16]。2019年吡噻菌胺在中国登记,登记产品包括20%悬浮剂和99%原药,登记作物为番茄、黄瓜和葡萄[17]。中国已制定吡噻菌胺在谷物、蔬菜、水果等中的一系列限量标准,番茄中吡噻菌胺的临时最大残留限量(MRLs)与国际食品法典委员会(CAC)、欧盟和韩国的限量标准一致,均为2 mg/kg,严格于美国(3 mg/kg)、日本(3 mg/kg)和澳大利亚(5 mg/kg)的限量标准。尚未制定其在黄瓜和葡萄中的MRLs,建议对内预警相关出口企业关注生产过程中吡噻菌胺在黄瓜、葡萄上的使用,加强出口农产品的农药残留检测,避免因农药残留超标导致贸易风险,同时加快吡噻菌胺在黄瓜、葡萄上限量标准的制定。
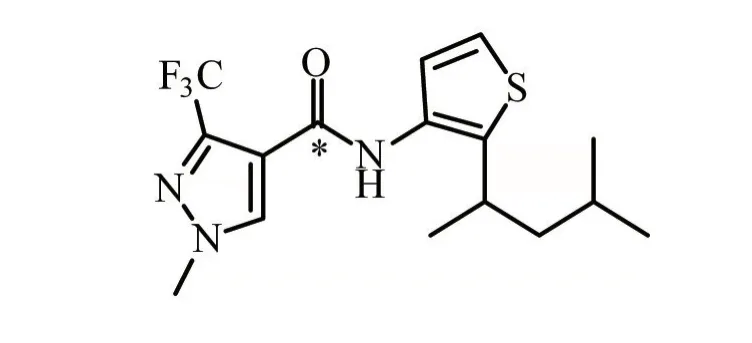
图1 吡噻菌胺的分子结构式(*手性碳原子)
随着农业生产过程中吡噻菌胺的大量使用,研究发现常温有氧土壤中,吡噻菌胺表现出显著的持久特征,降解半衰期(DT50)为121.5天,DT90更是高达544天[18];进而有利于吡噻菌胺通过渗透、地表径流、大气漂移等多种途径进入水体[13,18]。其次,吡噻菌胺对鱼的慢性生态暴露风险高,21天慢性最大无作用剂量(NOEC)为0.051 mg/L;对水生植物、水生无脊椎动物、蚯蚓等也具有中等毒性[18-19],其对水生生物的毒性效应及毒理学机制亟待解析。再次,还有研究指出吡噻菌胺对人类生殖与发育存在不良影响,属于毒理学克莱默Ⅲ级高风险,其健康效应与分子机理也成为当前毒理学领域的研究热点[18]。此外,目前对于吡噻菌胺的关键靶标作用位点及其对映体选择性研究尚未开展深入研究。因此,本文通过汇总国内外的研究进展,对吡噻菌胺的合成路径、生物活性、生态毒理、环境行为和分析方法学研究5个方面进行综述,旨在为其的科学合理应用和限量标准制定提供科学参考,也为其生态安全评估与高暴露风险规避提供理论依据。
1 吡噻菌胺的合成路径研究
阐明吡噻菌胺的合成路径对于其制剂开发与应用具有重要意义。根据吡噻菌胺的结构特征明确其合成关键环节有两个,一是吡唑环与噻吩环之间的酰胺键的生成,二是噻吩环2位上的烷基链的C-C键偶联[20]。依据吡噻菌胺合成过程中的重要中间体将合成路径分为两类:一类是分别合成中间体1-甲基-3-三氟甲基-1H-吡唑-4-甲酰氯和2-(4-甲基戊基-2-基)-3-氨基噻吩,然后2个中间体反应生成吡噻菌胺(见图2a)[20-24]。另一类则是首先合成中间体N-(3-噻吩)-1-甲基-3-三氟甲基-1H-吡唑-4-甲酰胺,再与甲基异丁基甲酮反应,最后经氢气还原得到吡噻菌胺(图2)[20-23]。
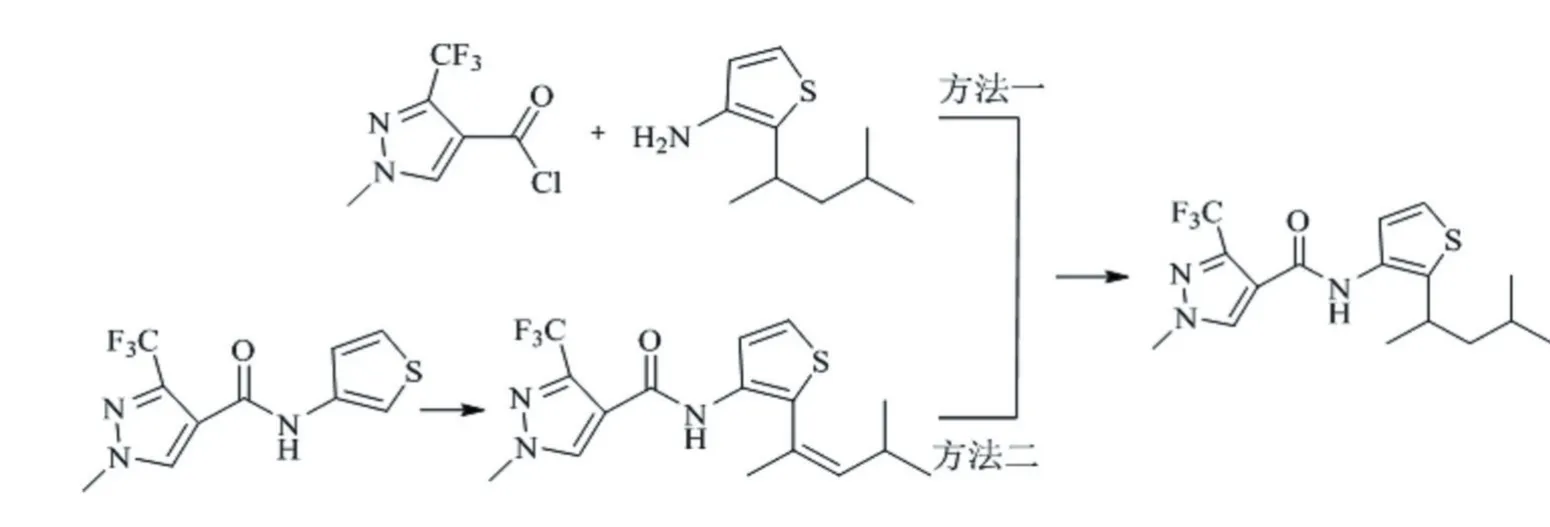
图2 吡噻菌胺的主要合成路径
上述两条合成路线,1-甲基-3-三氟甲基-1H-吡唑-4-甲酸都是合成吡噻菌胺的重要中间产物[24-27],该中间体合成路线很多,如羟基丙烯腈路线[28]、4-乙氧基-1,1,1-三氟-3-丁烯-2-酮路线[29]、甲酸乙酯路线[30-31]、三氟乙酰乙酸乙酯路线[22]、氰基乙酸钠路线[31]、二甲胺基乙烯衍生物路线[32]等。但多数存在一定的弊端,如反应条件苟刻、不易分离、副产物较多、收率较低、原料成本过高等[25-26]。建议以三氟乙酰乙酸乙酯为原料的合成路线,将其与原甲酸三乙酯反应,然后与甲基肼关环反应,再通过氢氧化钠水解得到1-甲基-3-三氟甲基-1H-吡唑-4-甲酸,该路径反应原料易得、反条件温和、工艺路线简单,收率较高(≥70%),易实现工业化生产[21-22]。其次,需要注意的是合成路径中的(1-甲基-3-三氟甲基-1H-吡唑-4-基)甲酰胺(PAM)为吡噻菌胺主要代谢产物。此外,吡噻菌胺化学结构中含有手性碳原子(图1),包含2个对映体,这在农药不对称合成、生物活性、生态毒性,以及环境行为归趋研究中需要重点关注。
2 吡噻菌胺的生物活性研究
生物活性是评价吡噻菌胺杀菌效果的首要指标。通过对多种病菌的防效试验发现,吡噻菌胺具有广谱的杀菌活性,对于叶斑病菌、褐斑病菌和菌核病菌的菌丝生长具有优异活性,但对于纹枯病菌和灰霉病菌的菌丝生长抑制效果较差,对菌核病菌、灰霉病菌、叶霉病菌和锈病菌和炭疽病菌的孢子萌发在较低剂量下也具有较高的活性(表1)。通过对多种植物病原菌进行菌丝生长抑制试验和盆栽试验表明,吡噻菌胺对叶斑病菌、褐斑病菌和菌核病菌的菌丝生长均有明显的抑制作用,最小抑菌浓度(MIC)低于10 mg/kg,但对纹枯病菌和灰霉病菌的抑制作用不明显,MIC分别为47.9和30.2 mg/kg;与菌丝生长抑制试验相比,吡噻菌胺对多种植物病原菌的孢子萌发均有较强的抑制作用,对菌核病菌、灰霉病菌、叶霉病菌和叶锈病菌的抑制中浓度(EC50)均小于0.4 mg/kg,对白粉病菌的EC50值为0.9 mg/kg,对黑星病菌的EC50值为1.4 mg/kg,可见,吡噻菌胺对白粉病菌、叶锈病菌和灰霉病菌的孢子萌发即便在较低剂量下也有较高的防治效果[33]。其次,通过对119株油菜菌核病菌的防效研究发现,吡噻菌胺的EC50值在0.0096~0.2606 μg/mL之间,体现出较高的生理生化活性,且预防作用强于治疗作用;随着药物浓度的增加,预防和治疗活性效果随之增加,当吡噻菌胺浓度由80 μg/mL增加到100 μg/mL时,预防效果由81.1%提高到100.0%,治疗效果也高达72.3%[34]。此外,利用菌丝生长速率法建立橡胶树炭疽病菌对吡噻菌胺的敏感基线并进行生物活性试验表明,敏感性频率分布呈连续单峰曲线,EC50值范围在0.243~3.377 mg/L之间;在菌丝侵染情况下,吡噻菌胺处理浓度在10 mg/L和50 mg/L时,其预防效果和治疗效果达到55.6%和83.3%,在浓度为100 mg/L时分别达到98.53%和66.8%;而在孢子侵染情况下也表现出类似的效果,处理浓度为10 mg/L和50 mg/L时,其预防效果和治疗效果分别达到57.3%和83.3%,100 mg/L时分别达到91.7%和92.9%[35-36]。上述研究均表明吡噻菌胺的预防和治疗效果具有显著的剂量依赖效应,相同浓度下保护效果优于治疗效果[32-36]。
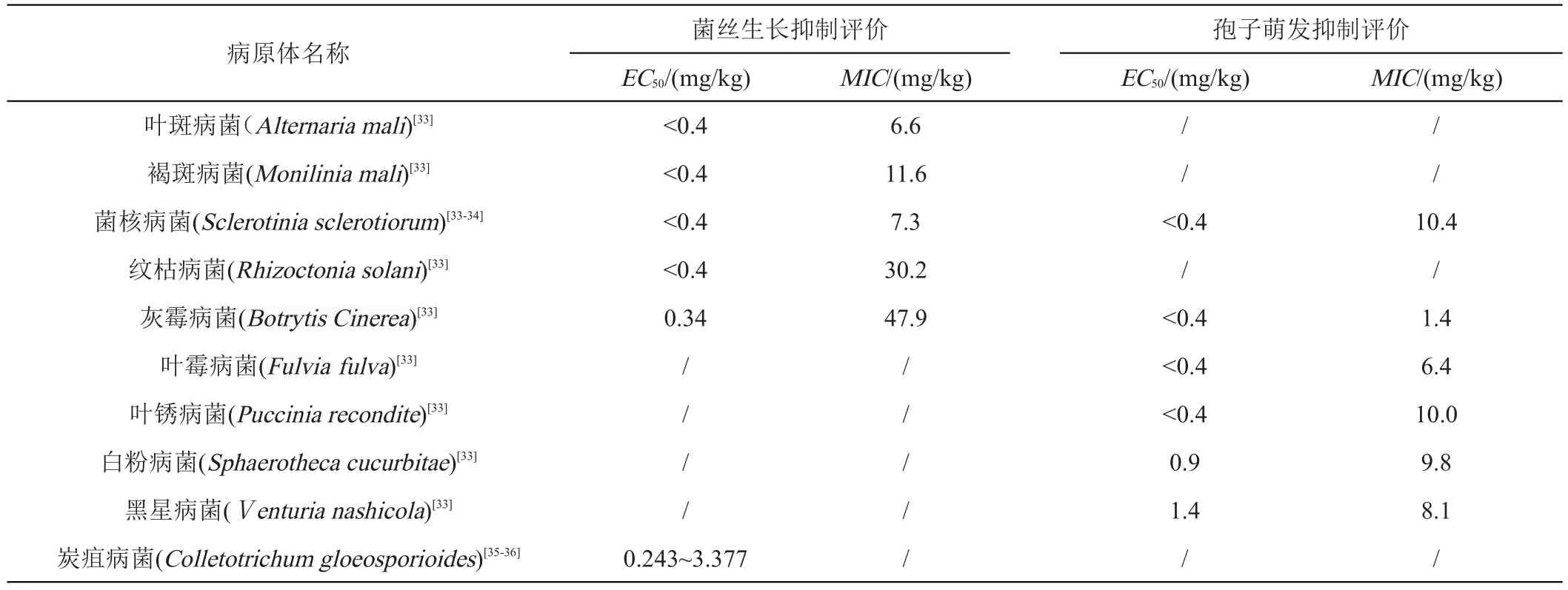
表1 吡噻菌胺对靶标病原体的杀菌活性汇总
综上表明,吡噻菌胺具有广泛的抗真菌谱,对灰霉病、白粉病、菌核病和炭疽病等多种植物病害具有显著的防治效果,特别是对孢子萌发有很高的杀真菌活性;但对于纹枯病菌和灰霉病菌的菌丝生长抑制效果较差,这在农业生产过程中需要注意;且吡噻菌胺的预防率和治疗率随着浓度的增加而增大,相同浓度下保护效果优于治疗效果。目前,吡噻菌胺对映体对靶标病害的生物活性研究尚未见报道,后续研究建议从吡噻菌胺的关键靶标作用位点入手,系统揭示吡噻菌胺的对映体选择性生物活性差异及其机理。
3 吡噻菌胺的生态毒理研究
吡噻菌胺对非靶标生物的生态毒性是评定其风险等级的重要指标。研究表明,吡噻菌胺对于水生生物(鱼类、溞类、藻类等)和蚯蚓具有中等毒性,其中,鱼类和溞类的慢性水生毒性NOEC分别为0.051 mg/L和0.47mg/L;蚯蚓慢性生殖毒性NOEC浓度高于48mg/kg,生态暴露风险较高。吡噻菌胺对于哺乳动物、禽类和蜜蜂等环境生物相对安全(表2),哺乳动物和禽类的慢性毒性NOEC分别为278.0和206.8 mg/L,生态暴露风险较低[18]。吡噻菌胺对斑马鱼胚胎和幼鱼的急性毒性效应明显,在2.5~2.9 mg/L浓度下,会导致一系列畸形变化,并诱发卵黄囊水肿、心包水肿、色素沉着和膀胱充气失败;此外,在亚致死暴露条件下,吡噻菌胺对幼鱼的运动行为有明显的抑制作用,并造成幼鱼脂质代谢和黑色素沉积基因表达异常[37]。美国环保署(EPA)也指出吡噻菌胺对黑头鲦鱼在33天时的NOEC为510 μg/L,且黑头鲦鱼、虹鳟鱼和鲤鱼的在96 h的急性LC50为 290~570 μg/L[19,38],与上述研究结果一致[37-39]。吡噻菌胺的慢性毒性和致癌性研究发现,无论口服、经皮还是吸入途径进入体内,主要靶器官是肝脏,并观察到甲状腺滤泡上皮腺瘤、肝细胞腺瘤和狗胆囊水肿病理现象,未观察到不良反应水平(NOAEL)为20~54 mg/kg[40]。动物发育毒性表明,吡噻菌胺会造成母兔流产、体重减轻,以及胎儿体重降低,存活率、产仔数和妊娠子宫重量降低,生殖与发育毒性效应明显[40]。代谢研究指出,山羊肾脏代谢物二羟基-半胱氨酸-F-DO和母鸡肝脏代谢物二羟基-半胱氨酸-T-DO在大鼠中均未被鉴定,但其他主要代谢物(如PAM等)在大鼠体内均有发现,同时指出代谢物毒性几乎可以忽略,进一步表明吡噻菌胺对哺乳动物的毒性较低[13]。
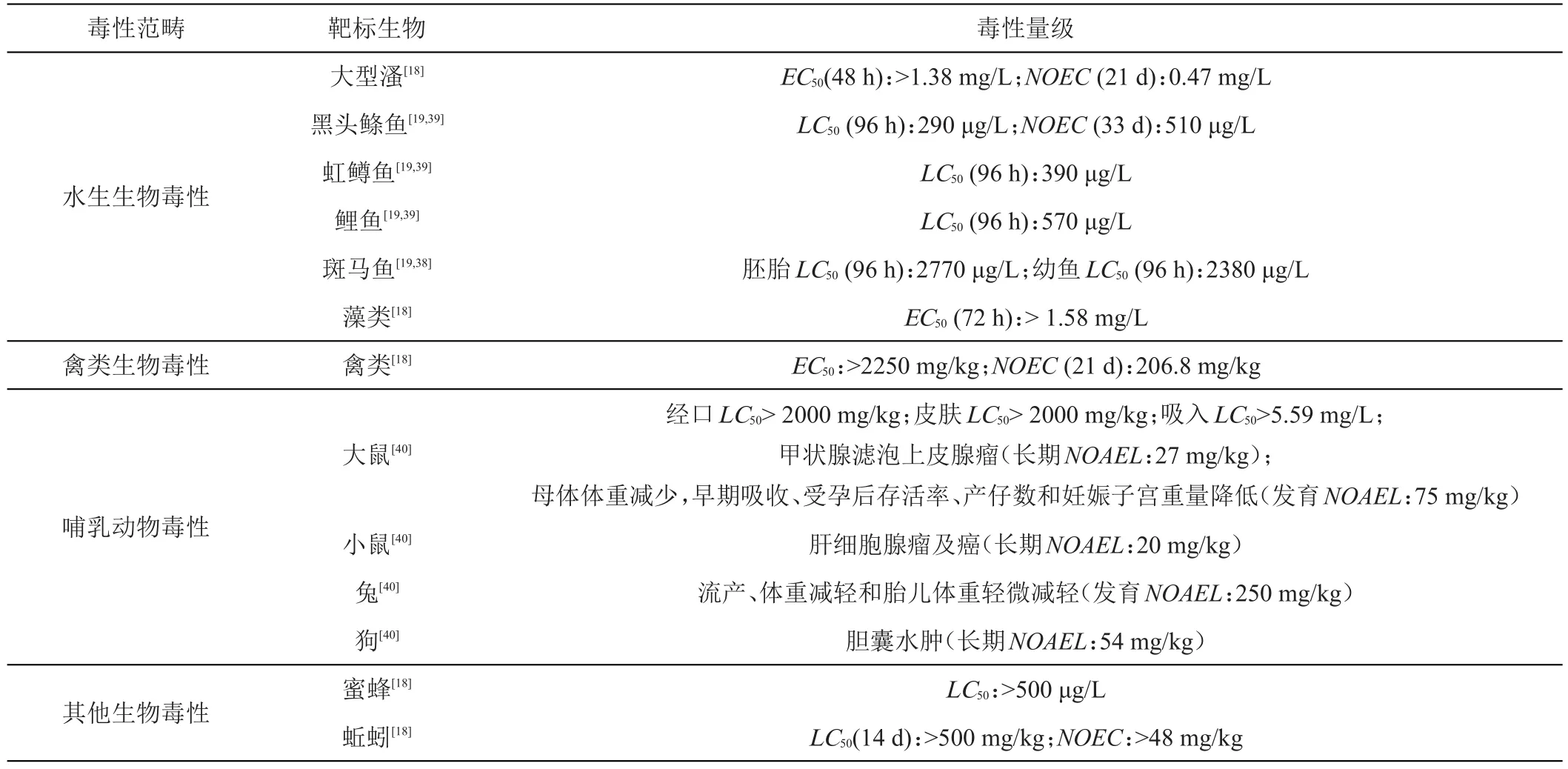
表2 吡噻菌胺对非靶标生物的毒性效应汇总
综上可见,吡噻菌胺的主要靶标器官是肝脏,对于哺乳动物和家禽的毒性较低,但对水生生物的急性毒性较高。此外,吡噻菌胺对映体选择性毒性研究已深入到细胞水平[40-41]。通过不同浓度吡噻菌胺对映体对人体肝癌细胞(HepG2)的毒性研究发现,不同构型的吡噻菌胺即使在相同浓度下,细胞活力大小及氧化应激性均有明显选择性差异(P<0.05)[42]。后续研究建议结合中国水环境的污染状况及对水生生物的毒性效应,深入到对映体层面,加强水生生态毒理学研究,以期为其水生生态风险评估体系的完善提供理论依据。
4 吡噻菌胺的分析方法学研究
分析方法是痕量追踪吡噻菌胺及其代谢物的有效手段,也是其生态环境安全评价的基石[43]。农药残留专家联席会议(JMPR)指出,植物源产品中用于制定吡噻菌胺的MRLs仅需要考虑吡噻菌胺母体农药,而膳食暴露风险评估则需要考虑吡噻菌胺及其代谢物PAM,以吡噻菌胺表示;动物源产品中用于制定吡噻菌胺的MRLs和膳食暴露风险评估均需要考虑吡噻菌胺及其代谢物PAM,以吡噻菌胺表示[13]。表3对当前吡噻菌胺的分析方法进行了汇总,通过液相色谱-串联质谱(LC-MS/MS)结合固相分散萃取技术建立了果蔬中吡噻菌胺的分析方法,该方法在0.5~500.0 μg/L具有良好的线性关系(R2≥0.9980),检出限(LOD)和定量限(LOQ)分别为0.2~1.7和0.5~5.0 μg/kg,平均回收率和相对标准偏差(RSD)分别为71.4%~121.3%和0.8%~17.2%[44]。也有研究通过1,1,2,2-四氯乙烷分散液液微萃取法结合LC-MS/MS建立了吡噻菌胺在西瓜基质中的分析方法,LOQ达到0.1µg/kg,该方法特异性、线性(0.1~100 µg/kg)、准确度(平均回收率,72.0%~111.6%)和精密度(RSD,3.4%~14.1%)也符合农药痕量分析的要求[45]。还有研究采用丙酮/水、乙腈/水进行萃取,建立了吡噻菌胺母体及其主要代谢物PAM的LCMS/MS联合分析方法,LOQ为10µg/kg[13,40]。
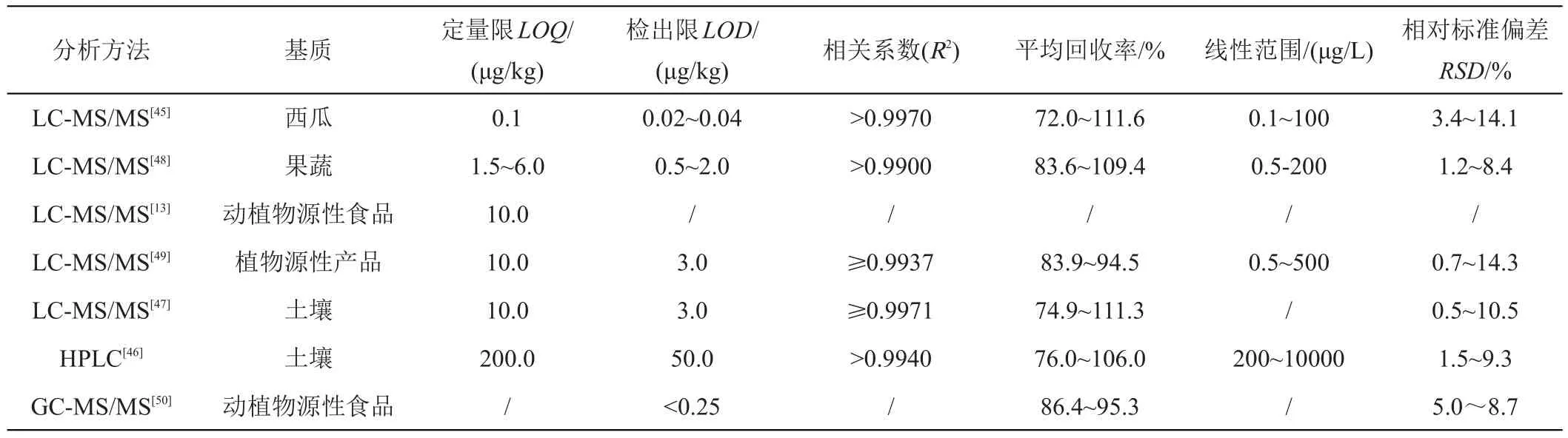
表3 吡噻菌胺的分析方法汇总
目前已有研究利用正相液相色谱法(NPLC)结合纤维素-三(3,5-二甲基苯基氨基甲酸酯)手性固定相(Chiralcel OD-H)对吡噻菌胺对映体进行手性分离,两对映体在20 min内实现基线分离,LOQ为0.2 mg/kg[46]。还有研究利用电子圆二色谱法鉴别了R-(-)-吡噻菌胺和S-(+)-吡噻菌胺,采用纤维素-三(3,5-二甲基苯基氨基甲酸酯)手性固定相(Superchiral S-OD)结合LC-MS/MS建立了土壤中吡噻菌胺的手性分离分析方法,两对映体的LOQ达到10 μg/kg[47]。综上可见,无论手性还是非手性分析方法学研究多集中在吡噻菌胺母体,其主要代谢物PAM的研究较少,推测可能由于合成路径难或稳定性差导致,这成为吡噻菌胺在动植物源食品中膳食暴露风险评估的瓶颈,也成为吡噻菌胺后续分析研究的突破点之一。
5 吡噻菌胺的环境行为研究
阐明吡噻菌胺在生态环境中的行为归趋对于其科学合理使用和暴露风险评估至关重要。目前,吡噻菌胺的环境行为研究主要集中在动植物体和土壤介质中,涉及代谢[13]、转化[46]和降解[46-47]等方面。利用同位素示踪法对葡萄、甘蓝、西红柿、小麦和油菜叶面施用吡噻菌胺后研究发现,植物体内残留量以母体为主,残留量分别为21%、20%~34%、45%~46%、19%、11%;主要代谢物是PAM,总放射性残留物(TRR)含量分别为14%、11%、6%、6%、1%[13]。不同植物体中吡噻菌胺的代谢量差异可能与植物体内关键酶、栽培模式,以及农药原始积累量密切相关[51]。随后通过吡噻菌胺在大鼠体内的吸收、分布、代谢和排泄研究发现,吡噻菌胺的排泄涉及胆汁、粪便和尿液途径,其中粪便是主要的排泄途径,给药24 h后排泄率达到74.8%~85.0%,主要代谢反应为烷基侧链末端甲基部分的N-去甲基化和氧化为羧酸[13]。山羊和母鸡体内的代谢研究也指明吡噻菌胺的主要代谢物为PAM[13]。
吡噻菌胺在不同培养环境、不同土壤类型中的降解速率和对映体选择性也存在差异。通过向土壤中定量添加吡噻菌胺外消旋体和手性单体进行室内培养发现,在未灭菌条件下吡噻菌胺对映体在土壤中的降解趋势符合一级动力学模型,酸性、中性和碱性土壤中的降解半衰期依次增大,分别为36.7~58.7、42.1~59.8和48.3~59.6天;而在灭菌条件下吡噻菌胺的降解速率为酸性>中性>碱性,降解率不超过15%。尚未发现吡噻菌胺对映体间转化,说明在土壤介质中吡噻菌胺的构型稳定[46]。还有研究指出S-(+)-吡噻菌胺在土壤中优先降解导致R-(-)-吡噻菌胺相对富集[47]。吡噻菌胺对映体选择性差异与培养条件、土壤微生物、土壤类型、pH值等因素密切相关。后续应加强吡噻菌胺在生态环境和水生生物链中的行为特征研究,系统揭示其对映体选择性行为特征差异的分子机制。
6 展望
以三氟乙酰乙酸乙酯为原料的合成路径是目前吡噻菌胺最优的合成方法,收率高达70%,同时发现其主要代谢产物PAM,开发更加简单、廉价、高效的合成方法也是后续研究的主要方向之一。
吡噻菌胺具有广泛的抗真菌谱,对灰霉病、白粉病、菌核病和炭疽病等多种植物病害具有显著的防治效果,特别是对孢子萌发有很高的杀真菌活性,但对于纹枯病菌和灰霉病的菌丝生长抑制效果较差;吡噻菌胺的预防率和治疗率呈现显著的剂量依赖效应,相同浓度下保护效果优于治疗效果。后续研究建议从吡噻菌胺的关键靶标作用位点入手,系统揭示吡噻菌胺的对映体选择性生物活性差异及其机理。
吡噻菌胺的主要靶标器官是肝脏,主要代谢途径是烷基侧链末端甲基部分的N-去甲基化和氧化为羧酸;吡噻菌胺对哺乳动物毒性较低,水生生态毒性较高,对映体间的细胞活力及氧化应激差异显著。后续研究建议结合中国水环境的污染状况及对水生生物链的毒性效应,对映体水平深入开展吡噻菌胺及其代谢物的水生生态毒理学研究,建立科学精准的风险评估体系,降低其对生物安全和人类健康的潜在风险。
通过LC-MS/MS结合分散固相萃取法、液液微萃取法是当前吡噻菌胺主流的痕量分析方法,LOQ达到0.1 μg/kg,能够有效追踪生物样本中吡噻菌胺及其代谢物。未来应加强研究不同环境因子对吡噻菌胺对映体降解的影响,确定高效低风险的对映体构型,这对于光学纯手性单体农药创制与应用具有重大意义。

