人体肘窝部皮肤菌群培养方法的建立及其在特应性皮炎疾病辅助诊断中的应用探索
郑敏玲 罗海敏 冯俊慧 张彩云 林颖 李文均 屈平华
1广东省妇幼保健院检验科,广州 511442;2广东省中医院检验医学部,广州 510006;3广州中医药大学第二临床医学院,广州 510006;4广东省中医院大学城医院皮肤科,广州 510006;5中山大学生命科学学院,广州 510275
特应性皮炎(atopic dermatitis,AD)通常被认为是一种全身性的系统性疾病,常合并过敏性鼻炎和哮喘等其他特应性疾病[1]。AD的发病机制复杂,其发生发展与遗传、环境和免疫等多种因素相关;而在临床表现上,AD以反复发作的慢性湿疹样皮疹及显著的皮肤干燥和瘙痒为主要特征,部分患者瘙痒剧烈且病程绵长,严重影响其身心健康[2]。流行病学数据显示,AD的患病率在全球范围内呈现逐年升高的趋势[3];而在中国,近10年AD患病率的增长非常迅速,部分城市婴儿AD患病率可达30.48%[4-5]。
近年来,人们通过高通量测序技术,获得了大量微生物与疾病和健康相关联的信息[6]。研究发现,人体皮肤是一个特殊的生态系统,表现为酸性、干燥、高盐和富含不利于大多数微生物生长的特殊脂质成分。尽管环境条件恶劣,但人体皮肤表面还是存在一定数量的微生物,且在一定条件下以“菌株”的水平保持稳定[7]。在正常条件下,人体皮肤表面微生物可与人体宿主形成稳定的互利关系。而皮肤微生态失衡,将驱动皮肤表面的菌群结构发生变化,并与皮肤疾病的发生发展密切相关[8]。因此,人体表面的皮肤菌群种类和结构,也可以作为人体皮肤健康和皮肤疾病状态的重要指标。目前,有文献建立了基于25个菌属的皮肤健康微生物指数,其可以识别儿童AD的皮肤易感状态,以及儿童AD的疗效评价指导[9]。然而,尽管皮肤微生物群在维护皮肤健康和AD疾病发生发展中具有重要意义,但在目前,针对人体皮肤菌群的培养条件和培养方法,还缺乏系统性的指导文件。本研究拟以AD好发的肘窝部皮肤为研究对象,以健康皮肤为对照,初步探索人体皮肤菌群的培养方法,并结合临床资料,探讨微生物定量培养在皮肤健康评价和辅助AD临床诊断的应用价值,从而为AD诊断和治疗提供微生物学依据。
资料与方法
1、一般资料
纳入2019年9月至2020年3月就诊于广东省中医院皮肤科的AD患者34例,其中男性21例,女性13例,年龄(14.43±8.03)岁;健康志愿者26例,其中男性12例,女性14例,年龄(29.38±7.47)岁。根据前瞻性试验性研究方案原则,随机选取符合纳入标准和排除标本的研究对象。
健康对照组的纳入标准:没有合并其他皮肤疾病或有明确感染指征的患者;没有接受全身免疫抑制剂和糖皮质激素治疗的患者(包括系统及局部用药);没有其他心肺基础疾病的患者。
AD组的纳入和排除标准。⑴纳入标准:符合Williams标准[10],且近1个月内无抗生素、抗真菌及糖皮质激素药物应用史,1周内未进行任何局部治疗(除了润肤剂)。⑵排除标准:合并其他皮肤疾病或有明确感染指征的患者;接受全身免疫抑制剂和糖皮质激素治疗的患者(包括系统及局部用药);有其他心肺基础疾病的患者。
AD严重程度的评估:采用三项严重程度评分(Three-Item Severity Score,TISS)标准,基于红斑、水肿和剥脱,每个评分从0到3分;总和为0分,无湿疹;1~2分,轻度;>2~4分,中度;>4~6分,重度;>6,极重度[11]。
本项研究已经得到广东省中医院医学伦理委员会批准,伦理批号为BE2019-165-01。所有研究对象或其亲属已知情并签署知情同意书。
2、肘窝部皮肤菌群分离条件的初步探索
无菌采样拭子施加稳定压力擦拭受试者肘窝部4 cm×4 cm的固定面积皮肤,在采样点来回约100次(约2 min),然后置于2 ml无菌生理盐水中。将原液稀释成10-1、10-2、10-3、10-4、10-5、10-6、10-7和10-8等梯度,再吸取100 μl样本分别涂布于血平板、巧克力平板、BCYEα和R2A平板,放置32℃培养箱培养2~7 d,初步估算其细菌数量和最适应用于菌落计数的稀释度。
在适宜菌落计数的样品稀释度下,分别置于:⑴8、10、20、28、32、35、37、40℃的温度环境;⑵pH为4、5、6、7、8、9、10的酸碱度环境;⑶0.5%、1.0%、2.0%、3.0%、4.0%、5.0%、6.0%、7.0%、8.0%、9.0%、10.0%NaCl(w/v)的浓度环境;⑷普通大气环境、5%CO2袋和厌氧袋的气体环境。比较上述状态下细菌生长的数量和种类,以探索皮肤细菌培养的最适稀释度、最适生长温度、最适pH值、最适盐浓度和最适气体需求。
3、肘窝部皮肤细菌培养和定量计数
3.1、样品采集 采用上述采集方法进行采集,并在2 h内进行样本处理并接种相应培养基。
3.2、定量培养的皮肤菌群的分离培养 参考上述探索的皮肤菌群分离培养条件,取10 μl来源于AD组样本和50 μl源于健康对照组样本分别涂布于血平板,32℃、5%CO2培养2~7 d。
3.3、菌种鉴定和菌落计数 选取平板上一定面积区域的全部菌株,优先采用Vitek MS鉴定仪进行菌种鉴定,具体操作参考文献[12],然后统计一定面积区域每类细菌的总数,按照比例计算出单位面积全部细菌的分布密度和金黄色葡萄球菌的分布密度。而对于Vitek MS不能鉴定的菌株,采用裂解法来提取待测菌株的DNA,用1%琼脂糖凝胶电泳检测DNA样品的纯度和浓度;使用16S rDNA通用引物27F(5’-AGA GTT TGA TCM TGG CTC AG-3)、1492R(5’-GGT TAC CTT GTT ACG ACT T-3’)对细菌进行聚合酶链式反应(PCR)扩增,并将测序序列递交上传至NCBI BLAST(https://blast.ncbi.nlm.nih.gov/)数据库上进行比对分析[13]。
4、统计学方法
采用统计软件SPSS 23.0对相关资料统计分析,服从正态分布的计量资料采用均数±标准差(±s)表示,不服从正态分布的计量资料采用M(P25,P75)表示;组间差异比较,若服从正态分布且方差齐,则采用独立样本t检验分析,若不符合,则采用Kruskal-WallisH检验;本研究统计学分析中定义P<0.05为差异有统计学意义。
结果与分析
1、受试者肘窝部局部皮肤性状
本次研究共纳入成人AD患者34例,其中男性21例,女性13例;健康体检者26例,其中男性12例,女性14例。通过初步皮肤性状分析发现,健康成人皮肤普遍表现光滑、湿润和有弹性;而AD患者患部皮肤主要表现为干燥、色泽暗淡和有破损,其发病的好发部位主要为四肢、肘窝、腘窝、面颊颈部和腹部,以肘窝部为主,部分有糜烂渗出和抓后渗液现象。按严重程度进行评分,34例AD患者,包括无湿疹10例、轻度10例、中度9例、重度5例、极重度0例。
2、人体肘窝部皮肤细菌的分离培养条件探索结果
本研究选取8名健康人和8例AD患者进行了肘窝部皮肤细菌的分离培养条件探索。从培养结果来看,人体肘窝部皮肤细菌普遍在有氧环境条件生长良好,其分离培养的适宜生长温度是28~32℃,适宜pH值为6~8,适宜盐浓度为0.5%~5.0%。在pH<6和pH>8的条件,各种可培养细菌数量明显降低;而在35℃和5.0%以上盐浓度的培养条件下,可培养细菌数量也明显降低,且一些革兰阴性杆菌无法生长。
在培养基的选择上,寡营养的R2A和BCYEα培养基相对于营养丰富的血平板和巧克力平板,更有利于革兰阴性杆菌的检出;但血平板和巧克力平板,能检出的细菌种数和数量,相对于R2A和BCYEα培养基多;且巧克力平板相对于血平板,更有利于嗜血杆菌的检出。
在细菌数量上,在不同的个体之间,尤其是一些健康志愿者和AD患者之间,其细菌数量差异巨大;健康人肘窝部皮肤菌落计数多为10~1000 cfu/cm2,而某些AD患者金黄色葡萄球菌数量>105cfu/cm2,需要稀释到1000甚至更高倍数才能进行准确的菌落计数;见图1。
3、肘窝部皮肤的细菌培养和定量计数比较
3.1、肘窝部皮肤在属水平的培养结果比较 本研究在34例AD患者和26例健康成人中,经Vitek MS鉴定仪和16S rRNA基因测序鉴定,共分离到20多个菌属,包括葡萄球菌属(Staphylococcus)、莫拉菌属(Moraxella)、库克菌属(Kocuria)、芽胞杆菌属(Bacillus)、梭菌属(Clostridium)、微球菌属(Micrococcus)、链球菌属(Streptococcus)、念珠菌属(Candida)、假单胞菌属(Pseudomonas)、窄食单胞菌属(Stenotrophomonas)、鞘氨醇单胞菌属(Sphingomonas)、皮肤杆菌属(Cutibacterium)、皮杆菌属(Dermabacter)、副球菌属(Paracoccus)、玫瑰单胞菌属(Roseomonas)、奇异球菌属(Deinococcus)、短杆菌属(Brevibacterium)、短波单胞菌属(Brevundimonas)、微杆菌属(Microbacterium)、甲基杆菌(Methylobacterium)、冢村菌属(Tsukamurella)、棒杆菌属(Corynebacterium)、甲基红杆菌(Methylorubrum)、新鞘氨醇杆菌属(Novosphingobium)、鞘脂菌属(Sandaracinobacter)、施莱格尔菌属(Schlegelella)、叶杆菌属(Phyllobacterium)等。
26例健康志愿者皮肤菌群相对于AD患者的物种多样性更为丰富,以上20多个菌属均有检出,其中葡萄球菌属是健康对照组肘窝部最常见的菌属,检出率为100.0%;其次为微球菌属、莫拉菌属、玫瑰单胞菌属和考克菌属,其在健康对照组的肘窝部皮肤中检出率分别为34.6%、30.8%、26.9%和23.1%。
34例AD患者肘部共分离到7个菌属,其中以葡萄球菌属最常见,AD皮损组的检出率为95.8%,而AD非皮损组的检出率为33.3%;微球菌属、考克菌属、念菌菌属、芽孢杆菌属和短杆菌属检出率分别为11.8%、5.8%、2.9%、2.9%和2.9%。
3.2、肘窝部皮肤在种水平的培养结果比较 从检出的菌种种类的多样性来看,不同健康者肘窝部皮肤的菌种种类完全不同,部分健康者的肘窝部皮肤表现为菌群种类单一的人葡萄球菌,而某一健康者的肘窝部皮肤检出23个已知菌种和9个未能确切鉴定的潜在新种。
人葡萄球菌是健康人体中最常见的定植菌种,其检出率为92.3%;其次为表皮葡萄球菌(Staphylococcus epidermidis)、头葡萄球菌(Staphylococcus capitis)、藤黄微球菌(Micrococcus luteus)、粘 液 玫 瑰 单 胞 菌(Roseomonas mucosa)和奥斯陆莫拉菌(Moraxella osloensis),其在健康对照组肘窝部皮肤中检出率分别为69.2%、34.6%、30.8%、30.8%、26.9%和23.1%。
金黄色葡萄球菌是AD患者肘窝部皮肤中最常见的定植菌种,AD皮损组的检出率为95.8%,而AD非皮损组的检出率为30.0%;其次为表皮葡萄球菌,AD皮损组的检出率为25.0%,而AD非皮损组的检出率为50.0%;对于整个AD组,藤黄微球菌的检出率为11.1%。此外,还有分离到头葡萄球菌、溶血葡萄球菌、嗜根考克菌、人葡萄球菌、无乳链球菌、蜡样芽胞杆菌、干酪短杆菌和白色念珠菌等,但检出率均低于10.0%。
3.3、AD患者和健康志愿者肘窝部皮肤菌群定量细菌培养结果的比较 对AD患者和健康志愿者肘窝部皮肤菌群定量细菌培养结果进行比较发现,健康对照组肘窝部皮肤菌群微生物菌落计数普遍在40.00~50000.00 cfu/cm2(中位数为325.45 cfu/cm2),而AD皮损组患者微生物菌落计数普遍在112.60~125000.00 cfu/cm2之间(中位数为1346.88 cfu/cm2),AD非皮损组患者微生物菌落计数普遍在50.00~6250.00 cfu/cm2之间(中位数为125.00 cfu/cm2),这3组的微生物计数总体差异有统计学意义(H=15.54,P<0.05);成对比较显示,AD皮损组微生物菌落数明显高于AD非皮损组,差异有统计学意义(H=24.25,P<0.05);AD皮损组微生物菌落数也明显高于健康对照组,差异有统计学意义(H=13.41,P<0.05),但是AD非皮损组微生物菌落计数与健康对照组差异无统计学意义(H=-10.84,P>0.05)(表1)。而在微生物种类上,这3组检出的金黄色葡萄球菌的分布密度总体差异有统计学意义(H=13.136,P<0.05);成对比较显示,AD皮损组皮肤中金黄色葡萄球菌的检出和数量均显著高于AD非皮损组和健康对照组,差异均有统计学意义(H=12.03,P<0.05;H=16.28,P<0.05),AD非皮损组和健康对照组检出的金黄色葡萄球菌的分布密度差异无统计学意义(P>0.05)(表2)。
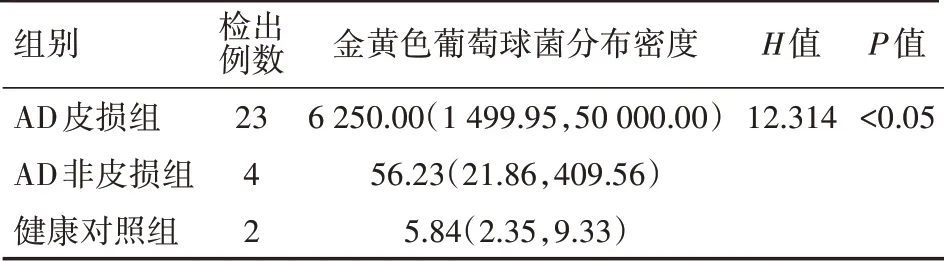
表2 AD皮损组、AD非皮损组与健康对照组金黄色葡萄球菌分布密度的比较[cfu/cm2,M(P25,P75)]
根据Spearman相关性,分析,皮损患者中检出的金黄色葡萄球菌的分布密度与AD的严重程度呈显著正相关(r=0.411,P=0.046),见图2。
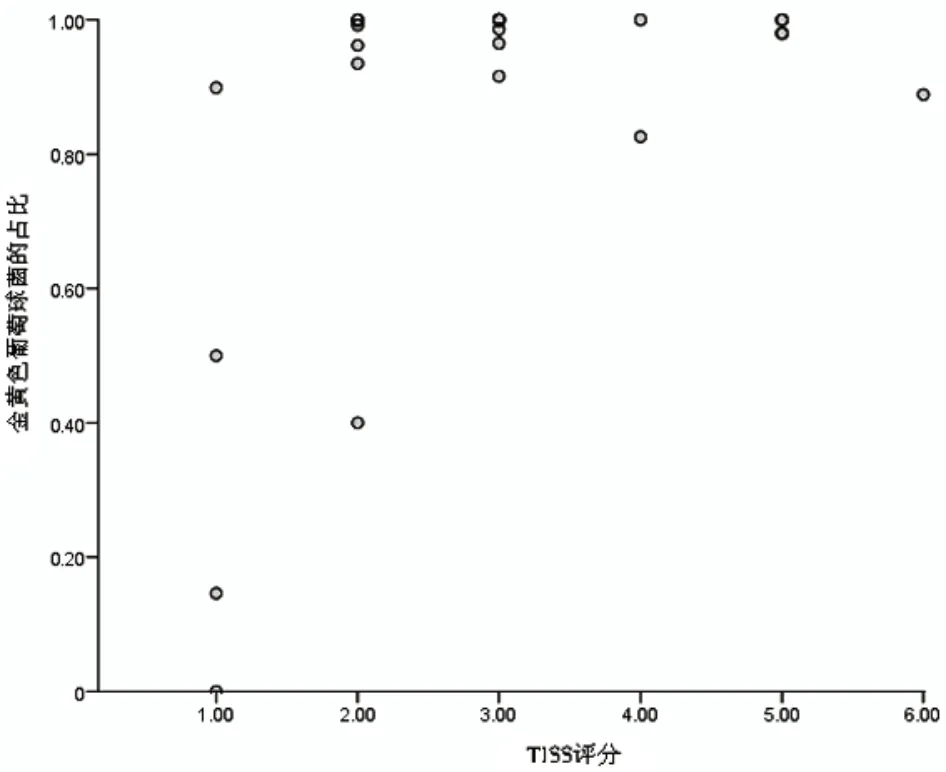
图2 皮损患者中金黄色葡萄球菌比例与AD的严重程度相关性分析
讨论
近年来,高通量测序技术日益成为人体微生态研究的重要手段。然而,由于人体皮肤的生态环境较为特殊,其正常状态下单位面积的皮肤微生物总量普遍较低,故常规皮肤采样方法难以达到宏基因组测序的DNA样本浓度要求,从而限制了16S rRNA基因扩增子测序技术和宏基因组测序技术在皮肤微生态研究中的应用[14]。因此,分离培养技术仍然是当前皮肤微生态的重要手段,并且该技术还是探索关键微生物在疾病中作用和致病机理的重要前提。
近年来,随着高通量快速鉴定技术的发展,尤其是MALDI-TOF质谱技术和在临床实验室的应用,为对培养基生长的所有菌落进行鉴定和计数提供了可能,也同时为人体皮肤微生态研究提供新的思路和方法。目前,有一项前瞻性研究,从17名健康志愿者的干燥部位(前臂)、湿润部位(肘窝)和皮脂部位(前额)采集皮肤样本,采用14种培养条件,并最终分离到800多种微生物(其中包括30余个细菌属和14个真菌属),从而为皮肤细菌的培养组学方法建立奠定了基础[15]。本文在该文献的基础上,以健康志愿者皮肤为对照,对AD好发的肘窝部皮肤进行了培养组学的尝试。从研究结果来看,人体肘窝部皮肤菌群培养的最适宜生长温度为28~32℃,最适pH值为6~7,最适盐浓度范围为0.5%~5.0%,其中以血平板和巧克力平板检出细菌种类和数量最多;并且,采用单一血平板,即从26例健康志愿者的肘窝部皮肤中培养出20多个菌属,且血平板会比巧克力平板更利于观察菌落形态,例如溶血环等特征,从而大大简化了流程,并提高了分离效率。
本研究初步探索了人体肘窝部皮肤菌群的培养条件,并基于此,初步建立起了人体肘窝部皮肤菌群培养方法,且分离出此部位绝大部分的优势菌种,这与采用16S rDNA扩增子测序的结果一致[16],即以葡萄球菌属为主,而AD患者主要以金黄色葡萄菌为主,健康人群以凝固酶阴性葡萄球菌为主,例如人葡萄球菌、表皮葡萄球菌等,且比对AD组和健康对照组皮肤菌群的培养结果,在葡萄球菌属方面,呈现出此消彼长的现象。此外本研究基于培养获得AD好发部位的微生物学特征与文献基于宏基因组获得与AD具有较强关联的皮肤B型具有较好的一致性,即是痤疮皮肤杆菌、皮生球菌属和甲基杆菌属减少,葡萄球菌属(如表皮葡萄球菌、头状葡萄球菌、金黄色葡萄球菌)的丰度增加[17]。另外,我们同时还对健康对照组、AD皮损患者和AD非皮损患者的肘窝部皮肤进行定量细菌培养分析,研究表明皮损患者中检出的金黄色葡萄球菌的占比与AD的严重程度呈显著正相关,这也与既往文献报道一致[18]。这也为后续的个性化治疗提供了微生物学依据。
总之,AD是一种与皮肤菌群失调密切相关的慢性复发性和难治性的皮肤疾病,而金黄色葡萄球菌可作为AD严重程度和疗效观察的一个重要监测指标。本研究中初步建立的AD肘窝部皮肤菌群的定量微生物培养方法,操作简单、方便快捷,可快速获得AD患者肘窝部皮肤菌群的关键微生物分布信息,并用于患者皮肤损伤的严重程度评价,能够为AD的临床治疗和疗效评价提供判断依据。
利益冲突所有作者均声明不存在利益冲突

