VV-ECMO治疗重症呼吸衰竭患者并发血流感染的危险因素及病原菌分析
韩雨澎,冯瑞霞,崔晓娜,周瑶瑶,刘小军
静脉—静脉体外膜肺氧合(venous-venous extracorporeal membrane oxygenation, VV-ECMO)是一种为常规治疗难以维持氧合的重症呼吸衰竭患者提供呼吸支持的高级生命支持装置,其主要适应证为重症肺炎、急性呼吸窘迫综合征(ARDS)、慢性阻塞性肺疾病等病因引起的重症呼吸衰竭[1-3]。近年来也用于重症新冠肺炎患者临床救治工作中[4-5]。血流感染(bloodstream infection,BSI)是VV-ECMO辅助治疗过程中一种潜在的致命并发症,严重的BSI会加重患者病情,显著增加临床死亡风险[6-7]。现探讨VV-ECMO辅助治疗患者并发血流感染的危险因素及病原菌特点,以期为临床提供理论依据,报道如下。
1 资料与方法
1.1 临床资料 收集2017年10月—2021年10月郑州大学第二附属医院重症医学科收治行VV-ECMO辅助治疗并确诊急性呼吸衰竭患者90例临床资料,根据患者是否并发血流感染,分为血流感染组30例和血流未感染组60例。2组患者在性别、体质量指数(BMI)、入院时急性生理学与慢性健康状况评分Ⅱ(APACHE Ⅱ)、原发疾病、合并基础疾病及入院时血红蛋白、血乳酸、总胆红素水平等指标比较,差异均无统计学意义(P>0.05)。血流感染组患者年龄、ECMO上机时长、机械通气总时长、ICU住院时长、ECMO置管处渗血、上机时随机动脉血糖水平均大于血流未感染组(P<0.05),见表1。本研究经医院伦理委员会批准(2022171),患者家属均知情同意并签署知情同意书。
1.2 病例选择标准 (1)诊断标准:VV-ECMO治疗患者并发的血流感染是一种获得性院内感染,其诊断标准为ECMO辅助治疗开始48 h后至ECMO撤机48 h内发生的ECMO相关感染,且血液细菌学培养阳性[8]。(2)排除标准:①VV-ECMO治疗持续时间<48 h的患者;②ECMO上机治疗后48 h内及撤机48 h后发生血流感染的患者;③临床资料不完整的患者。
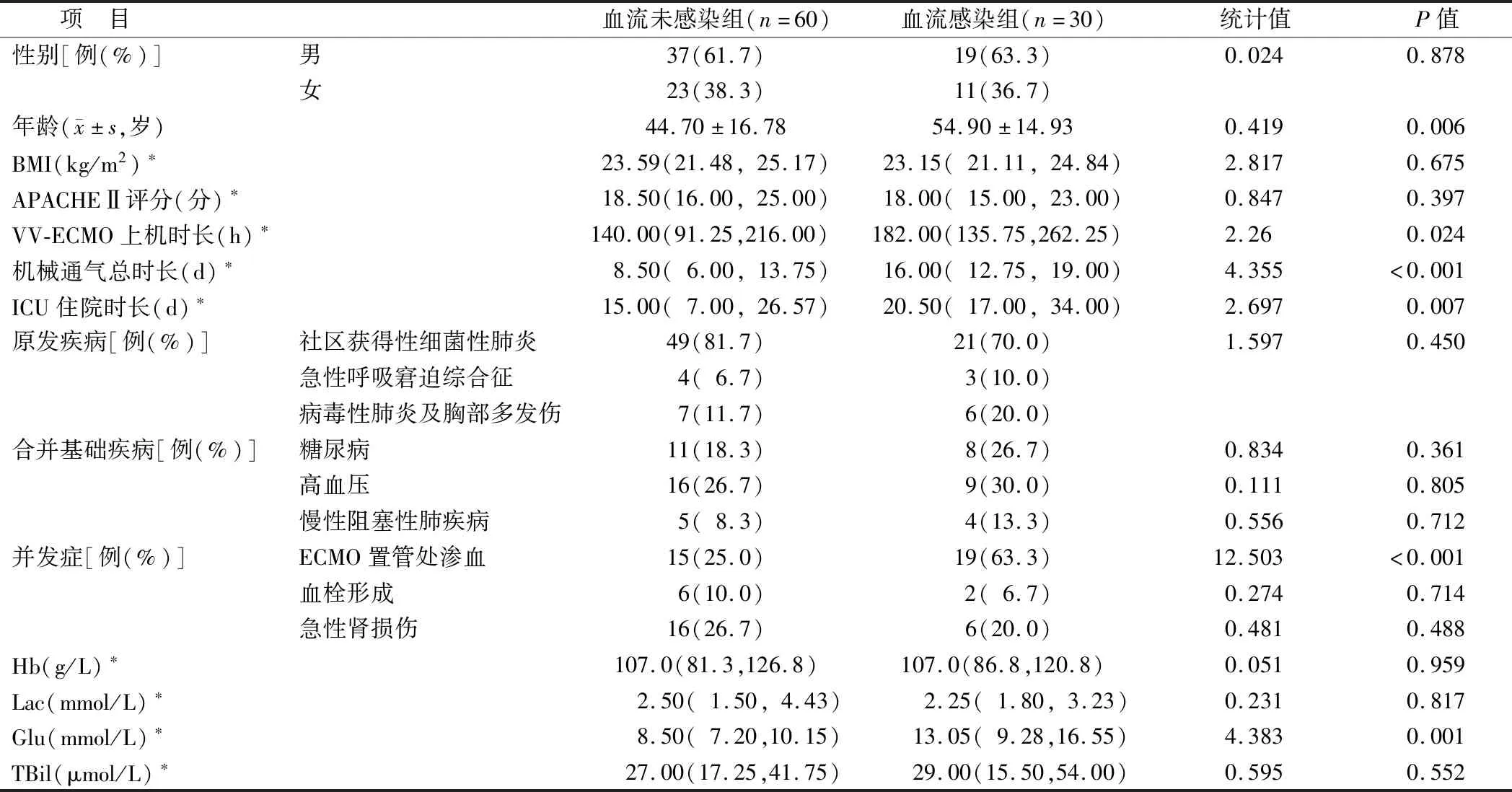
表1 血流未感染组及血流感染组患者临床资料比较Tab.1 Comparison of clinical data between non-infection group and bloodstream infection group
1.3 治疗方法 VV-ECMO上机方案参考2019年体外膜肺氧合治疗成人重症呼吸衰竭推荐意见[8],VV-ECMO 上机采用Seldinger经皮穿刺技术,用穿刺扩张管对穿刺部位(颈部及腹股沟区域)皮肤及皮下组织逐步扩张,在超声引导下行一侧股静脉穿刺置管为引血端及一侧颈内静脉穿刺置管为输入端;最后将ECMO系统管路用0.9%氯化钠溶液冲洗并与血流管路连接,建立VV-ECMO系统,并逐渐提高ECMO离心泵转速至2 400~2 800 r/min,维持ECMO血流量2~4 L/min。期间常规监测活化部分凝血活酶时间(APTT 40~60 s),可依据APTT结果调整肝素抗凝用量。此外每间隔4 h复查1次血气分析,据此调整氧流量及血液流量。
1.4 观察指标与方法
1.4.1 血流感染病原菌检测:当患者出现疑似血流感染临床症状时,抽取患者静脉血液送检验科进行血培养,VV-ECMO辅助治疗期间定期复查血培养,若2次血培养结果相同则视为同一病原菌感染。
1.4.2 血气指标检测:VV-ECMO上机成功后,即时抽取患者桡动脉穿刺置管处血液标本2 ml,以CEM3500型血气分析仪(美国沃芬公司)检测患者VV-ECMO上机时的即时血气指标:动脉血pH、二氧化碳分压(PaCO2)、氧分压(PaO2)及氧饱和度(SaO2)。
1.4.3 炎性指标检测:VV-ECMO上机后24 h内抽取患者静脉血液标本5 ml,使用Cobas e801全自动电化学发光仪(美国罗氏公司) 检测降钙素原(PCT)、白介素-6(IL-6), Cobas 702全自动生化仪检测C-反应蛋白(CRP),试剂均为罗氏配套试剂盒;BC-11型全自动血液分析仪(中国迈瑞公司)检测白细胞计数(WBC),以上操作均在采血2 h内完成。
2 结 果
2.1 VV-ECMO辅助治疗急性呼吸衰竭患者并发血流感染的病原菌分析 VV-ECMO辅助治疗期间并发血流感染患者30例,血培养出33株病原菌。细菌血流感染32株,其中革兰阴性杆菌18株(54.5%)、革兰阳性杆菌3株(9.1%)、革兰阳性球菌11株(33.3%);真菌感染1株(3.0%),为白色念珠菌。革兰阴性杆菌中最常见的菌种为肺炎克雷伯杆菌(27.2%,9/33)及鲍曼不动杆菌(18.2%,6/33),最常见的革兰阳性球菌为屎肠球菌(9.1%,3/33),见表2。
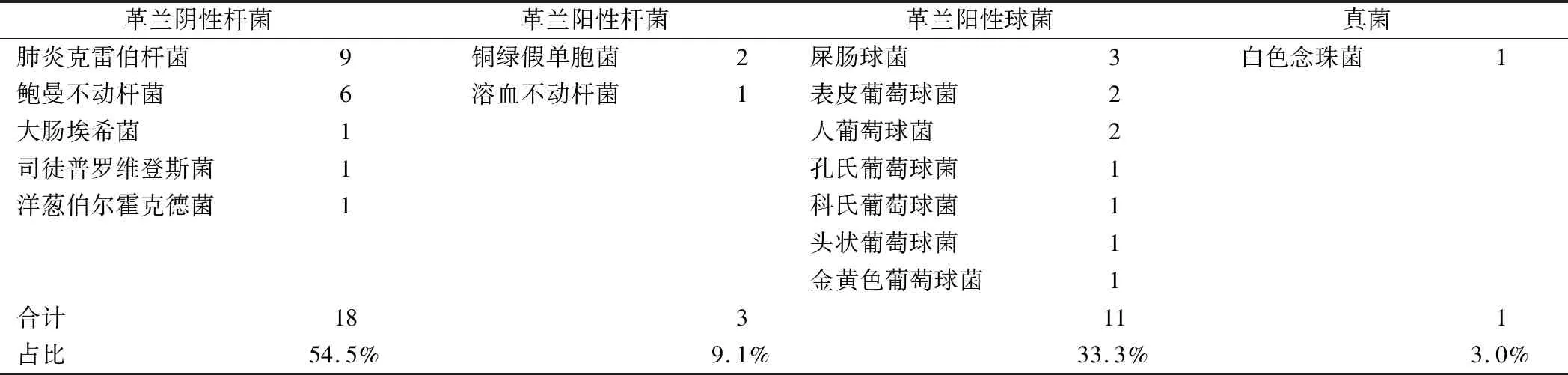
表2 VV-ECMO治疗患者血流感染病原菌分析 (株)Tab.2 Pathogen analysis of bloodstream infection in patients treated with VV-ECMO
2.2 2组动脉血气指标比较 2组患者动脉血pH、PaCO2、PaO2、SaO2水平比较,差异均无统计学意义(P>0.05),见表3。

表3 2组患者ECMO上机后动脉血气分析指标比较 [M(Q1,Q3)]Tab.3 Comparison of arterial blood gas analysis indexes between the two groups after ECMO on the machine
2.3 2组血清炎性指标比较 2组患者IL-6、PCT、CRP、WBC水平比较差异均无统计学意义(P>0.05),见表4。

表4 血流未感染组及血流感染组患者炎性指标比较 [M(Q1,Q3)]Tab.4 Comparison of inflammatory indexes between non-infection group and bloodstream infection group
2.4 VV-ECMO辅助治疗并发血流感染的二元Logistic回归分析 较长的机械通气时长、动脉血糖水平、合并穿刺置管处出血是VV-ECMO治疗呼吸衰竭患者并发血流感染的独立危险因素(P<0.05),见表5。
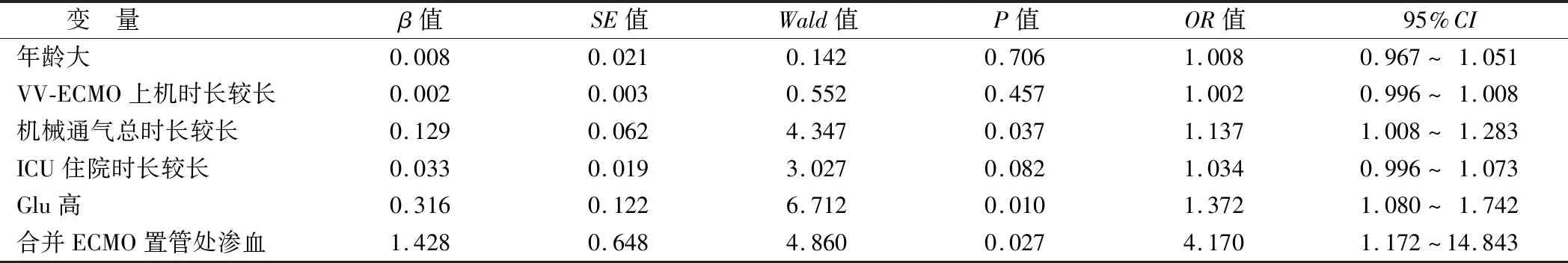
表5 VV-ECMO治疗急性呼吸衰竭患者并发血流感染危险因素的二元Logistic回归分析Tab.5 Binary logistic regression analysis of risk factors for bloodstream infection in patients with acute respiratory failure treated with VV-ECMO
3 讨 论
ECMO辅助治疗过程中并发血流感染是由于上机时穿刺置管的管径较粗、置管时损伤较大,暴露于体外的管路较长,连接膜肺及泵的接口较多,以及长期留置中心静脉导管等多种因素导致。ECMO术后并发的血流感染会加重患者病情,延长ECMO上机时间,增加患者的住院费用负担,也与患者撤机失败风险增加直接相关[6,9-10]。且既往研究指出VV-ECMO治疗患者由于其原发疾病特点较静脉—动脉体外膜肺氧合(venous arterial extracorporeal membrane oxygenation,VA-ECMO)治疗患者更易并发血流感染[11-12],因此探究VV-ECMO治疗患者并发血流感染的危险因素及常见感染病原菌种类,对于VV-ECMO术后血流感染的预防及早期经验性治疗具有重要临床价值。
本研究纳入的90例患者接受VV-ECMO治疗过程中并发血流感染几率为33.3%,与既往研究报道范围相符[12-13],血流感染组患者血培养阳性病原菌33株,其中32株为细菌血流感染,1株为真菌(白色念珠菌)血流感染,革兰阴性杆菌菌属中肺炎克雷伯杆菌及鲍曼不动杆菌的占比最高(45.5%)。既往研究报道也指出,ECMO相关院内感染以革兰阴性菌属多见,这可能与ECMO治疗患者接触抗生素暴露过多及肠黏膜功能受损相关[14-16],这一结论在本研究中仍然成立。最近的一项国外研究表明院内收治VV-ECMO治疗患者血流感染最常见病原菌依次为屎肠球菌(23.8%,9/38)[17],而本研究结果最常见病原菌为肺炎克雷伯杆菌(27.2%,9/33),这可能是由于选取患者人群不同造成的,本研究患者均收治于重症医学科,而肺炎克雷伯杆菌及鲍曼不动杆菌正是重症监护病房中机械通气患者并发院内感染的常见致病菌[18]。
应激性高血糖与多种疾病的重症患者发生感染关系密切[19-21],而重症监护病房收治的呼吸系统疾病重症患者早期由于体内感染因素存在,会导致机体内部激素水平和炎性因子分泌水平发生变化,常导致患者出现应激性高血糖。VV-ECMO系统建立时较高的即时动脉血糖水平也是一种机体在病理状态下的应激性反应,应激性增高的血糖会降低患者机体白细胞动员、趋化和吞噬活性, 削弱机体保护屏障,从而增加感染的几率[22-23]。
本研究中VV-ECMO治疗患者均采用呼吸机机械通气,据既往研究报道机械通气时置入的气管插管可刺激患者呼吸道分泌物增加,加之气管插管管路内的环境较为温热潮湿,可为细菌增长、生殖提供场所,导致感染的发生[24]。 此外,随着机械通气时长增加,患者呼吸系统的生理屏障作用受到损害,呼吸道纤毛运动等排出异物和清除病原菌的功能下降,也会增加患者并发呼吸机肺炎及全身感染的几率[25]。
ECMO系统运行会导致患者体内血流动力学紊乱,机体凝血功能异常,且 ECMO治疗期间普遍使用肝素抗凝,会造成ECMO治疗期间急性出血事件的发生,文献报道其发生率约为38.3%[26]。ECMO治疗期间穿刺置管处及气管切开处发生渗血时,带有血液的伤口敷料给病原菌的生长繁殖提供了环境[27],这无疑增加了患者并发血流感染的风险。
综上所述,VV-ECMO术后并发血流感染几率较高,临床医师应提高对VV-ECMO治疗患者术后并发血流感染的警惕,通过早期预防和治疗VV-ECMO术后血流感染,降低患者临床死亡风险。由于本研究是一项单中心回顾性研究,纳入样本量小,具有局限性,能否通过早期预防性使用广谱革兰阴性菌抗生素来预防VV-ECMO术后血流感染的发生,仍需大量的前瞻性研究来证实。
利益冲突:所有作者声明无利益冲突
作者贡献声明
韩雨澎:文章构思,统计学处理,论文撰写;冯瑞霞、崔晓娜、周瑶瑶:数据收集整理;刘小军:设计研究方案,可行性分析,监督管理研究过程

