三维适形放射治疗不同大体肿瘤体积的原发性肝癌患者疗效研究*
张 凯,刘培培,饶石磊,王 琦,岳 恺,王 旸,杨 峥,张 松
三维适形放射治疗(three-dimensional conformal radiotherapy,3DCRT)已被广泛用于治疗PLC患者[1-3]。对于局限于肝内不能切除的PLC患者,行肝动脉化疗栓塞(TACE)联合3DCRT治疗是有效的降期转化治疗方法[4]。研究显示,肿瘤体积是影响恶性肿瘤患者生存的独立预后因素,但关于大体肿瘤体积(gross tumor volume,GTV)是否会对PLC患者预后产生影响需要进一步明确[5]。本研究采用3DCRT治疗不同GTV的PLC患者,观察了疗效及血清甲胎蛋白(alpha-fetoprotein,AFP)、甲胎蛋白异质体L3(alpha-fetoprotein heterogeneity L3,AFP-L3)、高尔基体糖蛋白73(Golgi protein 73,GP73)、血管内皮生长因子(vascular endothelial growth factor,VEGF)和基质金属蛋白酶(matrix metalloproteinase,MMP)水平变化,现报道如下。
1 资料与方法
1.1 一般资料 2018年1月~2020年12月我院收治的PLC患者75例,男49例,女26例;年龄为35~68岁,平均年龄为(56.1±8.5)岁。诊断符合《原发性肝癌诊疗规范(2017年版)》[6]标准,经穿刺组织病理学检查诊断胆管细胞癌6例,肝细胞癌69例。肝功能Child-Pugh A级63例,B级12例。TNM Ⅱb期25例,Ⅲa期31例,Ⅲb期19例。排除标准:伴有严重的其它器官疾病、血液系统疾病、自身免疫功能缺陷性疾病、其他类型恶性肿瘤、Child-Pugh C级、肿瘤肝外转移、门静脉血栓/癌栓形成或门静脉主干完全阻塞且无侧支循环形成。根据GTV的不同,分为A组(<125 cm3)20例、B组(126~999 cm3)37例和C组(>1000 cm3)18例,三组一般资料比较,无统计学差异(P>0.05),具有可比性。本研究经我院医学伦理委员会审核批准,患者及其家属签署知情同意书。
1.2 治疗方法 使用瑞典ELEKTA公司生产的立体定向体部X射线放射治疗系统(Precise直线加速器)行3DCRT治疗。患者取仰卧位,双前臂交叉置于头部上方,体架上标记位置并嘱患者平静呼吸,行CT扫描。以气管隆突平面至肝脏下缘为扫描范围,将数据传输至治疗计划定制系统,应用图像重建技术计算临床靶体积和肿瘤体积等参数。将临床靶体积向3个维度分别外扩4~6 mm为治疗靶区。对其他正常器官和邻近器官,照射剂量不超过其耐受剂量。选择5~8个非共面照射野,总剂量为50~60 Gy,3~5 Gy,3次/w,治疗4~6 w。在治疗结束后,采用电话或门诊复诊方法随访12 m,以死亡或失访为随访的终点。
1.3 疗效评价 在治疗前和治疗结束后4 w,行腹部三维CT重建评定GTV。使用PHILIPS Ingenuity 64排CT机,先行腹部CT平扫和增强扫描,应用医学图像分析软件(Myrian XP Liver,法国Intrasense 公司) 生成肝脏三维重建模型,计算时包括胆道结构但不包括肝下腔静脉、胆囊和肝内血管结构的主要分支,由图像分析软件自动计算GTV。参考实体瘤疗效评价标准1.1(response evaluation criteria in solid tumors,RECIST 1.1)评估疗效[7]。客观缓解率(objective remission rate,ORR)=(CR+PR)/总例数×100%
1.4 血清指标检测 采用ELISA法检测血清AFP、AFP-L3、GP73、VEGF和MMP水平(上海研谨生物科技有限公司)。
1.5 不良反应评价 根据美国国立癌症研究所事件通用术语标准3.0(National Cancer Institute-Common terminology criteria for adverse events 3.0, NCI-CTC 3.0)[8]统计不良反应。
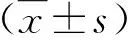
2 结果
2.1 三组近期疗效比较 在治疗后4 w末,A组ORR显著高于C组(P<0.05),而A组与B组之间或B组与C组之间ORR比较差异无统计学意义(P>0.05,表1)。
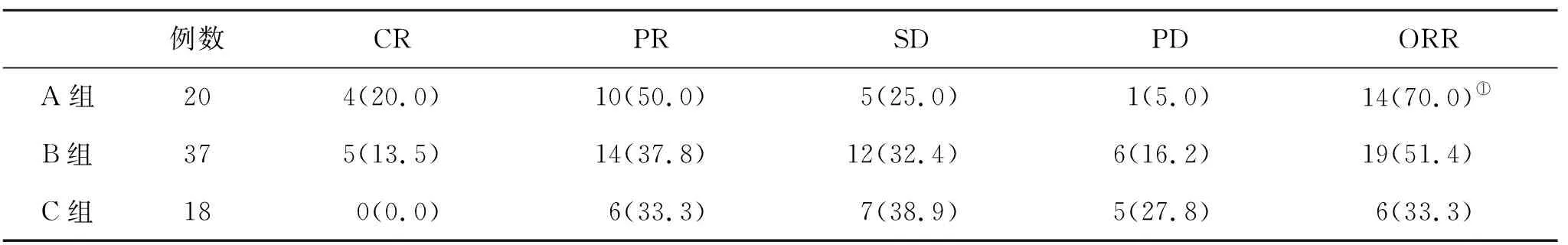
表1 三组近期疗效[n(%)]比较
2.2 三组血清指标比较 在治疗后4 w末,A组血清AFP、AFP-L3、GP73、VEGF和MMP水平显著低于B组或C组(P<0.05),而B组上述血清指标显著低于C组(P<0.05,表2)。

表2 三组血清指标比较
2.3 三组不良反应发生率比较 A组胃肠道反应、骨髓抑制、转氨酶升高和放射性肝损伤发生率显著低于C组(P<0.05),而A组与B组之间和B组与C组之间不良反应发生率比较差异无统计学意义(P>0.05,表3)。

表3 三组不良反应发生率[n(%)]比较
2.4 三组生存率比较 在随访期间,A组失访2例,B组失访3例,C组失访1例。A组死亡5例,其中1例因消化道出血死亡、4例因肝衰竭死亡;B组死亡16例,其中3例因消化道出血死亡、11例因肝衰竭死亡、2例因肺转移死亡;C组死亡10例,其中2例因消化道出血死亡、7例因肝衰竭死亡、1例因肺转移死亡。A组、B组和C组1 a累积生存率分别为72.2%(13/18)、52.9%(18/34)和41.2%(7/17),其中A组1 a累积生存率显著高于C组(Log-rankx2=4.813,P=0.028),而A组与B组之间和B组与C组之间1 a累积生存率比较差异无统计学意义(Log-rankx2=1.890,P=0.169;x2=1.467,P=0.226)。
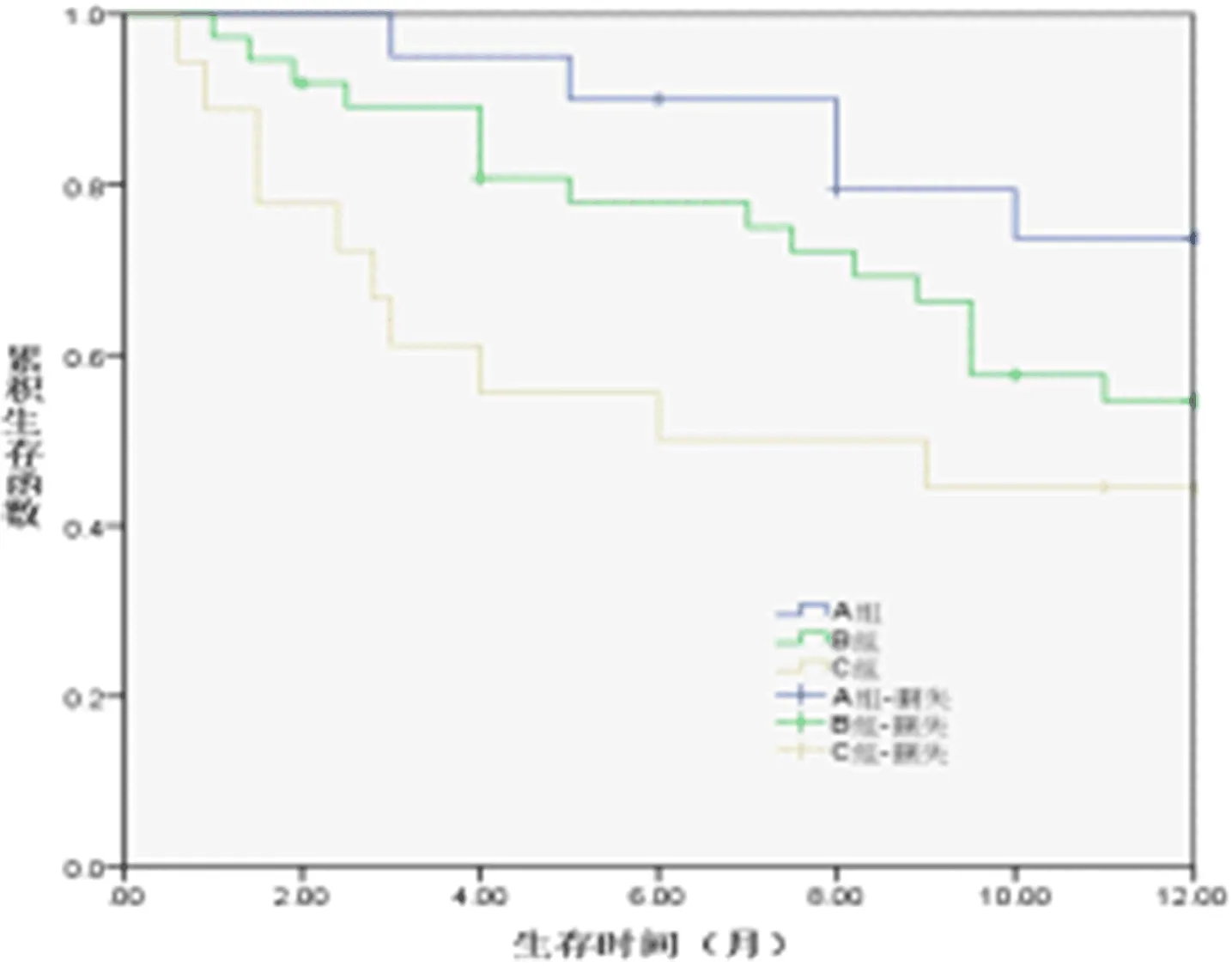
图1 三组Kaplan-Meier生存分析曲线
3 讨论
目前,手术是治疗PLC患者的主要根治性手段,但术后肿瘤复发率较高,且已成为影响疗效的主要因素[7-9]。随着医学科技的不断发展,放疗对于PLC患者治疗的安全性和有效性已得到广泛的证实,尤其是3DCRT治疗,近年来国内外研究已肯定了其治疗PLC患者的临床效果,认为采用立体定向等关键技术,实施共面和非共面多弧照射,能确保放射高剂量区的空间分布与肿瘤形态保持一致,高效控制病灶,改善患者预后[10-12]。
有研究显示,大体肿瘤体积可评估癌症患者放疗后的疗效[13]。还有研究发现,肿瘤体积是立体定向放射治疗非小细胞肺癌脑转移后局部控制的预测因素[14],我们推测GTV在一定程度上也可预测PLC患者在3DCRT治疗后的疗效。当GTV较大时,肿瘤负荷较大,并且乏氧细胞多,放疗敏感性较差,故近期疗效较差。当GTV较大时,常常提示临床分期晚且侵犯范围广泛,为使肿瘤完全坏死,故所需放疗剂量就越高,因而损伤正常肝组织和周围重要器官的可能性就越大,致使不良反应加重。但本研究中A、B组之间和B、C组之间ORR、不良反应发生率比较无明显差异,推测可能与样本量偏小有关。
本研究结果显示,在治疗后4 w末,A组血清AFP、AFP-L3、GP73、VEGF、MMP水平明显低于B、C组,而B组上述血清指标亦明显低于C组,提示针对接受3DCRT治疗的PLC患者,GTV较小时更利于降低血清肿瘤标志物水平。AFP是一种糖蛋白,生理状况下多由肝细胞和卵黄囊分泌形成,出生14 d后迅速消失,故正常人血清AFP往往低于20 ng/ml;发现癌变或肝脏再生时,易激活AFP,导致血清中的AFP水平呈异常高表达[15]。AFP-L3是临床较为常用的PLC肿瘤标记物,在PLC患者血清中往往呈异常高表达状态[16]。GP73属PLC新型血清肿瘤标志物,主要由胆管上皮细胞分泌,通常健康机体肝细胞几乎不表达或呈低表达状态,发生癌变后血清中的GP73水平往往呈异常高表达,多提示肝脏储备功能下降,肝损伤和肝纤维化程度加重,与抗肿瘤效果具有高度一致性[17]。VEGF作为现阶段已知最强的肿瘤血管内皮细胞增殖和分裂刺激因子,可结合血管内皮表面的血管内皮细胞生长因子受体2,调控内皮细胞生长、迁移、管状形成以及新生血管形成,在肿瘤发生及肿瘤细胞迁移过程中意义重大[18]。推测造成本结论的原因,PLC患者在接受3DCRT治疗时GTV越小,预示着肿瘤细胞数量越少,所需放疗剂量越低,因而对肝脏的损伤越小,且使肿瘤完全坏死的可能性越高,更利于降低血清肿瘤标志物水平,其具体机制仍有待研究。
本研究结果显示,A组1 a累积生存率明显高于C组,提示GTV与PLC患者3DCRT治疗后生存有关,GTV越小时患者生存获益更为明显。肿瘤体积是局部晚期肝细胞癌患者生存的独立危险因素,小体积肿瘤行大剂量放疗能使患者生存获益,而肿瘤体积较大者行高剂量照射会加重不良反应,且并未体现出生存优势[19]。还有研究指出,立体定向放射治疗Ⅰ期非小细胞肺癌患者预后与肿瘤体积缩小有关[20]。因此,推测GTV在一定程度上可预示PLC患者放疗后生存,该值越小,患者生存获益更为显著。

