慢加急性乙型肝炎肝衰竭患者血清聚集素水平变化及其临床意义探讨*
王明强,牛垚飞,王生锋
当肝脏受到病毒、药物、酒精等诸多理化因素的刺激后引起损伤时,可造成肝细胞大量坏死,导致其合成、代谢、分泌、生物转化和免疫防御等功能发生障碍,进而表现为凝血功能异常、黄疸、腹水、肝性脑病等临床症候群,称为肝功能衰竭[1,2]。临床表现以极度乏力、严重的消化道症状,如食欲下降、腹胀、恶心、呕吐和神志改变等。乙型肝炎病毒(HBV)感染是我国引起肝衰竭的首要病因[3]。慢加急性乙型肝炎肝衰竭(hepatitis B virus-related acute-on-chronic liver failure,HBV-ACLF)是国内ACLF的常见类型,病情凶险、进展较快,病死率高[3,4]。聚集素(clusterin)是由人肝细胞高尔基体分泌的,具有保护细胞免受各种应激源诱导的细胞凋亡[5,6]。研究发现在线粒体细胞凋亡途径中聚集素能稳定Ku70-Bax复合物,阻止凋亡蛋白Bax结合到线粒体外,降低细胞毒作用,能防止细胞死亡[7,8]。当肝细胞大量坏死时,直接导致簇合蛋白的合成减少。聚集素水平可直接反映肝脏细胞凋亡程度[9]。本研究旨在探讨血清聚集素水平变化对评价HBV-ACLF患者病情严重程度和预后的价值。
1 资料与方法
1.1 研究对象 2019年1月~2021年1月我院收治住院的HBV-ACLF患者48例,男性31例,女性17例;平均年龄为(45.3±11.8)岁。HBsAg持续阳性超过6个月,符合肝衰竭诊治指南(2018年版)的诊断标准[10]。排除标准:其他类型的肝炎病毒感染;酒精性肝炎、自身免疫性肝病或食物或药物中毒等导致的肝衰竭;施行肝移植;肝脏原发或继发性恶性肿瘤;合并严重的器质性疾病;妊娠或哺乳期妇女。另选择同期入院诊治的慢性乙型肝炎(CHB)患者60例(男45例,女15例,平均年龄为33.3±7.8岁)纳入研究。本研究符合医院医学伦理委员会关于临床科研的基本要求。
1.2 检测与计算 使用美国贝克曼-库尔特公司的LH-750全自动血细胞分析仪检测血常规;使用瑞士罗氏公司Cobas 8000型全自动生化分析仪检测血生化指标;使用深圳雷杜公司生产的RAC-030型全自动凝血分析仪检测凝血功能指标。根据凝血酶原活动度(PTA)水平,定义HBV-ACLF的严重程度,早期:30% 2.1 HBV-ACLF与CHB患者临床资料比较 HBV-ACLF组与CHB组外周血白细胞(WBC)计数、血小板(PLT)计数、谷丙转氨酶(ALT)、谷草转氨酶(AST)、总胆红素(TBIL)、白蛋白(Alb)、PTA、聚集素和MELD评分等差异具有统计学意义(P<0.05,表1)。 表1 两组临床资料【】比较 2.2 不同HBV-ACLF亚组患者血清聚集素水平比较 根据HBV-ACLF患者病情严重程度、有无感染和预后结局的不同分组,结果发现早期、中期与晚期,无感染与感染和生存与死亡的HBV-ACLF患者血清聚集素水平存在显著性差异(P<0.05,表2)。 表2 不同亚组HBV-ACLF患者血清聚集素水平比较 2.3 不同预后结局的HBV-ACLF患者临床资料比较 生存与死亡的HBV-ACLF患者年龄、血清TBIL、Alb、PTA、MELD评分、肝性脑病和肝肾综合征发生率等差异具有统计学意义(P<0.05,表3)。 表3 生存、死亡HBV-ACLF患者临床资料【】比较 肝衰竭受多种因素的影响,其发病机制较为复杂,主要与各种因素对肝脏细胞的直接损伤或间接损伤有关。大量研究发现肝炎病毒感染与肝衰竭关系密切[12]。国内ACLF的诊断标准为在慢性肝病基础上短时间内肝功能出现急性或亚急性失代偿性进展,临床表现为极度乏力、严重的消化道症状、进行性加深的黄疸,血清总胆红素水平升高大于正常值上限10倍或每日上升大于17.1 μmol/L,同时存在明显的出血倾向(PTA<40%或INR>1.5)[13]。同时,需要排除其他病因导致的凝血功能障碍、失代偿性腹水及伴或不伴有肝性脑病的发生。 聚集素由人肝细胞分泌,参与机体组织的重建、脂质运输、补体调节和细胞凋亡等。研究表明严重肝损伤可直接导致聚集素合成减少。本研究结果也得出相似的结论,在HBV-ACLF患者血清聚集素水平相对于CHB患者明显降低,与ACLF发生时大量的肝细胞坏死是相对应的。同样地,分析不同预后结局的HBV-ACLF患者时发现死亡组患者血清聚集素水平也显著低于生存组,提示血清聚集素水平与HBV-ACLF患者的病情严重程度呈显著的负相关趋势。当HBV-ACLF患者病情越重时,血清聚集素水平越低,肝细胞坏死程度越严重,预后愈差。有报道称血清聚集素、PTA和血清总胆红素水平是预测HBV-ACLF患者预后的独立因素[14]。该研究进一步应用受试者工作特征曲线下面积评价上述三项因素诊断HBV-ACLF的效能,结果表明相对于PTA和血清总胆红素水平,血清聚集素判断HBV-ACLF患者预后的诊断效能与它们相当,表明了血清聚集素水平确实可以作为HBV-ACLF患者潜在的生物标志物应用于临床。 另外,本研究比较了HBV-ACLF与CHB患者血常规和血生化指标,结果发现WBC计数、PLT计数、血清ALT、AST、TBIL、Alb、PTA和MELD评分等差异具有统计学意义。上述指标的差异性结果表明了HBV-ACLF患者病情较为严重。接着,我们按照病情的严重程度和感染情况将HBV-ACLF患者分为不同的亚组,在比较不同亚组血清聚集素水平时发现随着病情阶段的进展,血清聚集素水平显著降低,说明处于较为严重肝损伤的患者,肝脏聚集素合成能力显著下降。经过积极的内科治疗,再次随访HBV-ACLF患者,根据患者预后结局分为生存组与死亡组,发现两组患者多项血生化指标无明显异常,而血清总胆红素、PTA和MELD评分等存在显著性差异。先前的研究报道称血清总胆红素、PTA和MELD评分的变化是评价HBV-ACLF患者预后的重要因素。此外,生存组与死亡组HBV-ACLF患者年龄存在显著性差异,随着年龄的增长,肝脏再生能力下降,患者预后愈差。在HBV-ACLF患者病情发展阶段常出现严重的并发症,例如肝性脑病、肝肾综合征和消化道出血等[15,16]。本研究发现生存组肝性脑病和肝肾综合征发生率显著低于死亡组,这些结果也与先前的研究结论相一致。 肝移植是目前肝衰竭患者最有效的治疗方法之一[17,18]。据既往的研究报道称施行肝移植治疗后,肝衰竭患者5 a生存率约为70%[19]。另外,人工肝支持系统对肝衰竭患者的病情和转归也有一定的积极的影响[20]。为了更加客观地评价血清聚集素对HBC-ACLF患者预后的影响,本研究在未施行人工肝治疗或在人工肝治疗前采集血液标本,可以尽可能地避免了治疗干扰对血清凝集素水平的影响。 综上所述,HBV-ACLF患者血清聚集素水平显著降低,病情越严重,其水平越低,预后越差,是否可以作为一种潜在的生物标志物以评估HBV-ACLF患者病情的严重程度和预后,值得扩大研究。由于检测方法的标准化困难、试剂来源不同和HBV-ACLF患者病情变化快,选择病例的病情、分期和治疗干扰等都将严重影响血清凝集素水平检测的准确性,给临床应用带来一定的局限性和片面性。对有可能向肝衰竭病情发展的前期和早期患者进行血清凝集素水平的监测,可能有助于预测病情变化。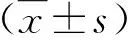
2 结果
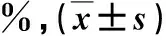

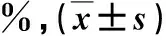
3 讨论

