扩散峰度成像对上皮性卵巢癌分型的鉴别诊断
马丽颖 孙美玉 王成艳 崔淑丽 李宝 陈丹
卵巢癌早期症状不典型且缺乏明确的筛查工具,是导致病人死亡的主要原因之一,其中上皮性卵巢癌(epithelial ovarian carcinoma,EOC)占卵巢癌的90%~95%[1]。基于近年对免疫组织化学、形态学和分子遗传学的研究,2012年Bodurka等[2]提出了EOC的二元论模型,将其分为Ⅰ型(低级别和高分化)和Ⅱ型(高级别)。Ⅰ型EOC占全部EOC的25%,包括低级别浆液性癌、黏液性癌、子宫内膜样癌、透明细胞癌及癌前病变(交界性肿瘤)[2],好发于年轻人,交界性肿瘤占一半以上,以浆液性交界性肿瘤最常见,被认为是低级别浆液性癌的前体[3]。Ⅰ型EOC生长缓慢,基因稳定,预后较好,发现时肿瘤多处于Ⅰ期(肿瘤局限于卵巢),晚期可见扩散。因此,当Ⅰ型EOC局限于卵巢时,同侧卵巢切除术是有效的治疗方法;而扩散到卵巢以外部位时,采用传统治疗方法并联合使用丝裂原活化蛋白激酶抑制剂可延长晚期Ⅰ型EOC病人的无病生存期并提高总体生存率[4]。Ⅱ型EOC占全部EOC的75%,包括高级别浆液性癌、子宫内膜样癌、恶性混合中胚层肿瘤(癌肉瘤)和未分化癌,75%以上的病人在发现肿瘤时已处于中晚期(Ⅱ~Ⅳ期)。Ⅱ型EOC基因不稳定,生长迅速,侵袭性较强,预后差,其死亡病例占所有卵巢癌的90%。Ⅱ型EOC治疗方法与Ⅰ型EOC不同,主要采用细胞减灭术联合术后化疗,对于不适合手术者可先行新辅助化疗[5]。由于Ⅰ型和Ⅱ型EOC具有不同的临床特征和治疗方式,因此术前准确预测EOC分型对临床制定个体化治疗方案、指导临床用药及评估预后等具有重要意义。
MRI是术前无创性识别卵巢肿瘤形态特征的有力工具,其软组织分辨力较高,显示卵巢及其周围结构较清晰,有助于卵巢病变的诊断及鉴别诊断[6]。MRI除了形态学成像技术外,还包括扩散加权成像(DWI)、扩散峰度成像(diffusion kurtosis imaging,DKI)等多种功能成像。DWI是假设水分子的运动是按照高斯分布的,间接反映组织的微观结构特征[7]。实际上由于细胞膜和其他细胞器等微观结构的存在,水分子在活组织中呈非高斯分布,由此发展而来的DKI序列采用多b值成像,能够更准确地反映组织结构变化[8]。DKI在盆腔疾病(如直肠、前列腺等疾病)的诊断中也具有良好的应用价值[9]。由于Ⅰ型与Ⅱ型EOC的组织内微观结构及异质性不同,应用DKI可能有助于评估EOC分型。本研究旨在探讨DKI对EOC分型(Ⅰ型/Ⅱ型)的鉴别诊断价值。
1 资料与方法
1.1 研究对象 回顾性纳入2012年1月—2021年7月于大连医科大学附属第一医院经手术病理证实的EOC病人45例,年龄17~80岁,平均(50±13)岁。纳入标准:①经手术病理确诊的EOC;②盆腔MRI影像资料完整;③无盆腔手术史。排除标准:①盆腔MRI检查前已行放化疗;②运动伪影较重造成影像不清晰,无法满足影像诊断要求。根据术后病理分型对EOC病人分组,Ⅰ型组24例[年龄17~80岁,平均(48±14)岁],Ⅱ型组21例[年龄28~77岁,平均(52±11)岁]。
1.2 设备与方法 采用美国GE 1.5 T Signa HDXT扫描设备,体部8通道相控阵线圈。扫描范围从髂骨上缘至耻骨联合水平。扫描序列包括常规T1WI、抑脂T2WI、DWI、增强(DCE)扫描及DKI。动态增强扫描采用肝脏容积加速采集成像(liver acquisition with volume acceleration,LAVA)。DWI的b值选择0、600 s/mm2。DKI的b值选择0、1 000和2 000 s/mm2,在30个正交方向施加扩散梯度。扫描序列及其参数详见表1。
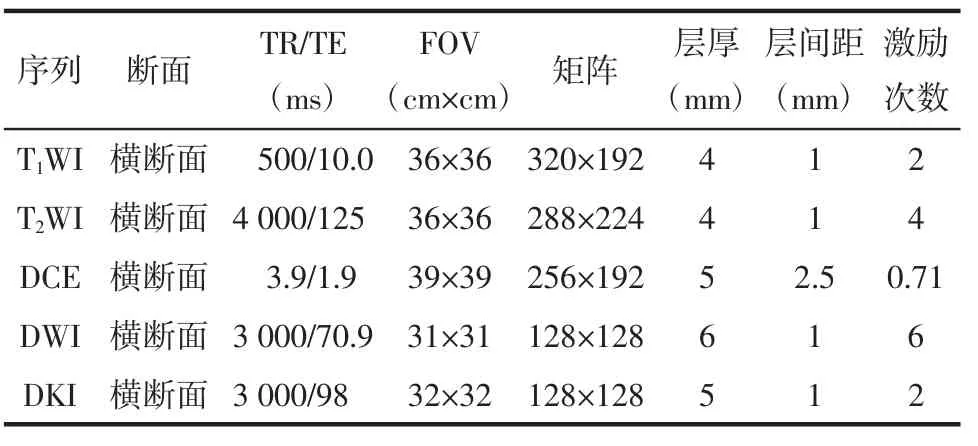
表1 MRI扫描序列及参数对照
1.3 影像分析 影像传至GE ADW 4.6工作站,应用Functool工具包中的DKI软件对影像进行后处理。由2名分别有4年和9年盆腔MRI诊断经验的医师独立进行影像分析。参照脂肪抑制T2WI、T1WI、DWI及增强影像,在DKI后处理影像上,选取肿瘤病灶实性部分最大层面手动勾画兴趣区(ROI),勾画范围不超过肿瘤的边缘,避开明显囊变坏死、血管及出血区域。由2位医师在ROI上分别独立测量DKI的平均扩散峰度(MK)、平行扩散峰度(Ka)、垂直扩散峰度(Kr)、平均扩散系数(MD)、平行扩散系数(Da)、垂直扩散系数(Dr)、各向异性分数(FA)和峰度各向异性分数(FAk)3次,取平均值作为各医师的测量结果,再选取2名医师测量结果的均值作为最终测量结果。
1.4 病理分型及分期标准 病理分型:Ⅰ型EOC包括低级别浆液性癌、透明细胞癌、黏液性癌、子宫内膜样癌和交界性肿瘤;Ⅱ型EOC主要由高级别子宫内膜样癌、浆液性癌、未分化癌和癌肉瘤组成。根据国际妇产科联合会(International Federation of Gynecology and Obstetrics,FIGO)分期标准将EOC分为Ⅰ~Ⅳ期。
1.5 统计学方法 采用SPSS 22.0软件进行数据分析。符合正态分布的计量资料以均数±标准差(±s)表示,2组间比较采用独立样本t检验;非正态分布的计量资料以中位数[M(P25,P75)]表示,2组间比较采用Mann-WhitneyU检验。计数资料以例(%)表示,2组间比较采用Fisher确切概率检验。采用组内相关系数(ICC)分析2名观测者测量DKI各参数的一致性,ICC<0.4表示一致性差,0.4≤ICC<0.75表示一致性中等,ICC≥0.75表示一致性良好。采用受试者操作特征(ROC)曲线分析差异有统计学意义参数的鉴别诊断效能,分别计算其ROC曲线下面积(AUC),确定各参数诊断Ⅱ型EOC的阈值和对应的敏感度、特异度、阳性预测值(PPV)、阴性预测值(NPV)和准确度。P<0.05为差异有统计学意义。
2 结果
2.1 2组间临床、病理及影像资料比较2组间病理类型、分化程度、分期的差异均有统计学意义(均P<0.05)。Ⅰ型中交界性肿瘤占比最高(50.0%),Ⅱ型中浆液性癌占比最高(61.9%);Ⅰ型中的高分化癌占50%,Ⅱ型多为中低分化癌(76.2%);Ⅰ型多数处于Ⅰ期(79.2%),Ⅱ型多数处于Ⅲ期(57.1%)。MRI影像上,Ⅰ型病灶多表现为囊性(41.7%)或囊实性(33.3%),Ⅱ型多表现为实性(52.3%);Ⅱ型(66.7%)腹水发生率高于Ⅰ型(29.2%)(均P<0.05)。2组间其他参数差异均无统计学意义(均P>0.05)。详见表2、3。2.2 2名观察者间的一致性分析2名观测者测量各参数值的一致性均较好(均ICC≥0.75),见表4。2.3 2组间DKI参数的比较 Ⅰ型的MK、Ka和Kr值低于Ⅱ型,而MD、Da、Dr值高于Ⅱ型(均P<0.05),详见表5和图1、2。

图1 病人女,80岁,Ⅰ型EOC(右侧卵巢交界性浆液性肿瘤)。A-C图分别为横断面T2WI影像、横断面T1WI增强动脉期影像、冠状面T1WI增强延迟期影像;D-K图分别为MK、Ka、Kr、MD、Da、Dr、FA、FAk参数伪彩图,病灶MK=0.667,Ka=0.649,Kr=0.647,MD=2.030 μm2/ms,Da=2.330 μm2/ms,Dr=1.890 μm2/ms,FA=0.143,FAk=0.130。L图为病理图,镜下可见肿瘤以乳头状和腺管状结构为主,腺管局部融合呈筛状,部分腺腔内为乳头状结构,乳头结构复杂,细胞层次增多,细胞核大,核浆比例失调。病理结果为右侧卵巢交界性浆液性肿瘤(HE,×100)。

表2 2组间临床及病理资料比较 例(%)

表4 2名观察者测量DKI各参数的一致性分析
2.4 DKI参数鉴别诊断Ⅰ型和Ⅱ型EOC的效能 各参数鉴别Ⅰ型与Ⅱ型的AUC由大到小依次为MK、Kr、Ka、Dr、MD、Da。其中,MK阈值为0.504时鉴别诊断的AUC最大,诊断敏感度、NPV、准确度最高,而特异度、PPV较低;Da阈值为2.190时鉴别诊断的AUC最小,诊断敏感度、NPV最低,而特异度、PPV最高(表5)。各参数的ROC曲线见图3。

图3 DKI参数鉴别Ⅰ型与Ⅱ型EOC的ROC曲线
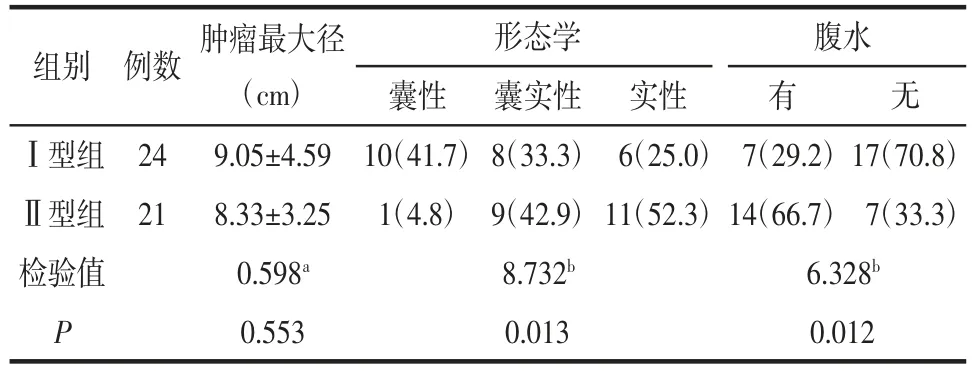
表3 2组间影像资料比较

表5 DKI参数鉴别诊断Ⅰ型和Ⅱ型EOC的效能
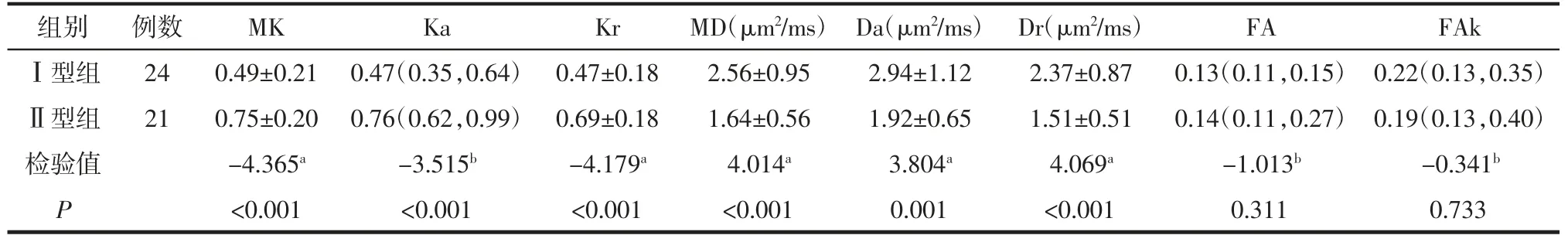
表5 2组间DKI参数的比较
3 讨论
卵巢癌是妇科常见的恶性肿瘤,发病率仅次于宫颈癌和子宫内膜癌,约65%的卵巢癌病人在第1次就诊时已处于晚期,晚期病人的5年生存率仅为20%~30%,而早期诊断和治疗可使病人5年生存率提高至90%,EOC占卵巢恶性肿瘤的90%~95%,具有高复发率、高转移率、低生存率的特点,严重威胁女性生命安全[10-11]。Ⅰ型和Ⅱ型EOC的临床特点和治疗方式不同,术前准确判断EOC分型,有助于临床医生设计和调整治疗方案,对提高病人生存率至关重要。
本研究发现,临床、病理及常规MRI特征对评估EOC分型有一定价值。有文献[12]报道Ⅰ型EOC在年轻人群中比Ⅱ型更常见。而本研究结果显示,2组EOC病人年龄差异无统计学意义,分析原因可能与本研究中Ⅰ型EOC中交界性肿瘤中年人居多有关。目前CA-125被认为是早期筛查卵巢癌的重要肿瘤标志物,也是预测治疗后复发的重要工具[13]。通常Ⅱ型EOC病人CA-125水平高于Ⅰ型,部分原因可能在于Ⅱ型比Ⅰ型EOC病人的FIGO分期更晚,肿瘤恶性程度更高[14]。本研究中2组间CA-125水平的差异无统计学意义,分析原因可能是与样本量较小有关,后续有待增加样本量进一步研究探索。本研究还发现,Ⅰ型EOC中交界性肿瘤占50.0%,Ⅱ型EOC中浆液性卵巢癌占绝大多数(61.9%),与文献[12]报道的Ⅰ型EOC中交界性肿瘤常见,Ⅱ型EOC中多数为高级别浆液性癌的结果一致;另外,Ⅰ型EOC的分化程度高于Ⅱ型,这点与Ⅰ型与Ⅱ型EOC的定义及病理分型相符合。本研究还显示,FIGO分期Ⅱ期病人中60.0%(6/10)为Ⅱ型,Ⅲ期病人中92.3%(12/13)为Ⅱ型,Ⅳ期均为Ⅱ型,FIGO分期Ⅰ期病人中95.0%(19/20)为Ⅰ型,提示Ⅱ型组比Ⅰ型组的FIGO分期更晚,与文献[14]报道结果基本一致。向等[15]研究发现Ⅰ型EOC病灶的最大直径大于Ⅱ型,而本研究中Ⅰ型EOC肿块最大径有大于Ⅱ型的趋势,但2组间肿瘤最大径差异无统计学意义。Qian等[16]研究发现,肿瘤囊实性、腹水是Ⅱ型EOC的独立预测因子,Ⅱ型多为实性病变,而Ⅰ型中囊性和囊实性病变更常见;Ⅱ型发生腹水较Ⅰ型更常见。本研究中Ⅰ型病灶多表现为囊性(41.7%),Ⅱ型多表现为实性(52.3%),Ⅱ型(66.7%)腹水发生率高于Ⅰ型(29.2%),与Qian等[16]研究结果基本相符。
DWI因其扫描时间短且后处理简单,在临床应用最广泛,但信噪比和空间分辨率相对较低,对运动伪影较敏感。DWI假设水分子扩散运动处于理想状态(高斯分布),然而活组织中复杂的细胞结构导致水分子在真实生物组织中的扩散明显偏离了高斯分布,对反映病变表征可能具有一定的局限性[17]。体素内不相干运动和DKI可以深入反映人体组织的微观结构特征和功能信息,例如水分子的扩散和血液在组织中灌注。与传统DWI相似,体素内不相干运动也是假设水分子在组织中的扩散运动是高斯分布的,但其可选择多b值成像,当b值较低(<200 s/mm2)时,主要反映组织微循环灌注信息,随着b值的增加,微循环灌注的比例逐渐降低,可以反映水分子的真实扩散情况,但高b值会降低信噪比[18]。DKI是一种先进的DWI模式,可量化水分子扩散偏离高斯形式的情况,并提供校正的ADC值以及组织的扩散峰度,量化组织扩散偏离高斯模式的程度,更敏感地评估组织微结构的复杂性[19-20]。
DKI可以评估肿瘤的病理分级,反映组织的异质性。MK代表所有方向扩散峰度的平均值,Ka和Kr分别代表扩散张量长轴方向和垂直扩散张量长轴方向的扩散峰度平均值,Ka和Kr值与MK值类似,均可表现组织微观结构的复杂程度。Cao等[21]根据肝细胞癌的Edmondson-Steiner分类法将一级和二级肿瘤归为低级别组(45例),三级和四级肿瘤归为高级别组(29例),应用DKI评估肿瘤的病理分级,研究结果显示高级别组的MK值大于低级别组。本研究中,Ⅰ型EOC的MK、Ka和Kr值均低于Ⅱ型,与Cao等[21]对肝细胞癌病理分级研究结果类似,分析原因可能是由于Ⅱ型EOC更具增殖性、侵袭性和异质性,导致Ⅱ型中细胞增多、肿瘤细胞核质比增加和细胞外间隙变小,肿瘤微结构更复杂,组织异质性更明显。
MD、Da、Dr为DKI的扩散参数,主要反映组织内水分子扩散受限的程度。本研究中,Ⅰ型EOC的MD、Da、Dr值高于Ⅱ型,可能是由于Ⅱ型EOC有丝分裂活性较Ⅰ型高,细胞密度增大,核仁突出,核质比增大,膜结构丰富,胞内复合蛋白分子量增加,组织微环境更不均匀,导致Ⅱ型EOC组织中水分子的非高斯扩散更受限,故MD值减小。既往Wen等[22]对不同病理类型的直肠癌进行研究,对比16例黏液性腺癌和116例直肠腺癌,发现腺癌组MD值小于黏液性腺癌组,原因可能是由于黏液性腺癌含有丰富的细胞外黏蛋白,占肿瘤体积的50%以上,黏液数量增多,导致肿瘤细胞的密度减低,扩散受限程度减小,MD值升高;而直肠腺癌黏液数量少,细胞密度高,扩散受限明显,因而MD值减小。本研究结果与之类似。

图2 病人女,35岁,Ⅱ型EOC(左侧卵巢中分化子宫内膜样腺癌)。A-C图分别为横断面T2WI影像、横断面T1WI增强动脉期影像、冠状面T1WI增强延迟期影像;D-K图分别为MK、Ka、Kr、MD、Da、Dr、FA、FAk参数伪彩图,病灶MK=0.912,Ka=0.963,Kr=0.871,MD=1.320 m2/ms,Da=1.420 m2/ms,Dr=1.270 m2/ms,FA=0.085,FAk=0.108。L图为病理图,镜下可见大量异型细胞,核大、深染,染色质呈粗颗粒状,胞浆较为丰富,核浆比例大,异型细胞组成腺管,部分融合成筛状,向间质浸润生长。病理结果为左侧卵巢中分化子宫内膜样腺癌(HE,×100)。
FA是各向异性参数,反映了纤维结构中水分子扩散的各向异性程度,其值介于0~1,值越小,扩散越随机,越无方向性;FAk为峰度各向异性参数,与FA值相似。有文献[23]报道FA、FAk可以推断白质纤维的形状和髓磷脂的形成,正常情况下由于髓磷脂或细胞膜的限制,白质神经纤维排列有规律,神经纤维束排列紧密,水分子扩散的方向一致性较高,FA值较高,当白质神经纤维束受损时,如神经髓鞘的解体或不规则胶质细胞的增殖,可能导致水分子扩散环境的改变,在这种情况下,可能伴随着沿神经纤维轴突扩散参数(轴向扩散系数)的降低,即FA值减低,主要在神经系统应用广泛。本研究中Ⅰ型与Ⅱ型EOC的FA及FAk值差异无统计学意义,分析可能与2组EOC各向异性差异小有关。
本研究结果还显示,MK值鉴别Ⅰ型与Ⅱ型EOC的AUC(0.817)最大,敏感度及准确度也最高,可能是因为MK表示各方向离散峰度的平均值,它不依赖于组织结构的空间方向,并在同一梯度方向取多个b值的平均值,更真实、全面地反映组织结构的复杂性。
本研究尚存在一定局限性:①为回顾性分析且样本数量较小,Ⅰ型和Ⅱ型EOC 2组间的病例包括不同的组织病理学类型及FIGO分期,无法对其分组讨论;②勾画ROI时选定病灶实性部分最大的肿块层面,无法体现肿瘤组织的全部情况。后续将加大样本量做进一步研究证实所诊断的界值,并采用测量肿瘤全域的方法,更全面地评估肿瘤组织结构的异质性。
综上,DKI可以术前有效地鉴别Ⅰ型与Ⅱ型EOC,为临床选择合理的诊疗方案提供更多参考信息,其中定量参数MK的诊断效能更高,具有潜在价值。

