QSM评估多发性硬化缓慢扩大病变的研究进展
孙劼 谢颖滢 潘金彬 张宁男楠
多发性硬化(multiple sclerosis,MS)是一种免疫介导的中枢神经系统(central nervous system,CNS)炎性脱髓鞘疾病,该病危害性较大,具有终身性、进行性、致残性的特点,是影响中青年最常见的非创伤性致残疾病之一。有研究者[1]认为不伴有复发症状或活动性证据的疾病进展,是导致早期MS残疾加重的重要因素。目前,临床上识别MS进展仍然具有挑战性,对MS进展的认识往往是回顾性的。临床医生需基于数月甚至数年对病人的观察,依靠病人残疾程度逐渐增加作为证据来判定MS疾病进展[2]。根据MS的临床体征和影像学表现将病程分为3个基本阶段:①急性活跃阶段,指MRI上检出新发/增大或钆强化病变的特定时间段;②进展阶段,又称慢性活跃阶段,指病人出现临床神经功能持续性恶化,但MRI上病变无疾病活动性证据(钆强化)的疾病阶段;③慢性非活跃阶段,指无疾病活动和恶化证据的稳定阶段[3]。
缓慢扩大病变(slowly expanding lesion,SEL)因其具有随病程缓慢扩大的特点而命名[2,4],见于MS疾病慢性活跃阶段,伴随持续的轴突损伤和神经退行性变,亦称为慢性活动性病变或阴燃病变[5]。病理上可见SEL边缘围绕着激活的促炎型小胶质细胞[4],且小胶质细胞内可以检测到铁积累,这是MS进展的特征性改变[6-7]。有研究[8]发现MS病人的T2WI上所显示的1.6%~32%的病灶为SEL。定量磁化率图(quantitative susceptibility mapping,QSM)技术可以识别和定量监测铁沉积,以此来评估SEL边缘的小胶质细胞活性,是监测MS进展的重要影像学手段。本文就QSM用于SEL中的研究进展进行综述。
1 SEL
SEL病理表现可见病变中心存在不活跃的脱髓鞘改变,边缘环绕激活的促炎型小胶质细胞、大量轴突末端和少量髓鞘降解产物[2]。其中,激活的小胶质细胞为主要病理特征,所代表的病理过程被认为是导致MS进展阶段缓慢脱髓鞘及进行性临床恶化的关键事件[6],标志着MS的免疫机制从早期T和B细胞介导的适应性免疫,向小胶质细胞激活为主要特征的固有免疫转变[2,9]。MS进展阶段血脑屏障相对封闭,炎症细胞(T细胞、B细胞和浆细胞)局限在脑膜和大血管周围间隙,引发持续条件性炎症,进而激活促炎型小胶质细胞并分泌炎性因子,致髓鞘及少突胶质细胞崩解并释放游离铁。激活的小胶质细胞获取并负载游离的Fe3+,将其转化为Fe2+并随之沉积在SEL边缘。这一系列反应进一步加重了MS的氧化应激反应,导致线粒体功能障碍,神经中毒[10]。
此外,多项研究[4,8,11-13]采用免疫组化方法对SEL深入分析,使用铁离子标志物(二氨基联苯胺增强的铁氰化钾蓝和普鲁氏蓝染色)在SEL边缘检测到丰富的铁沉积,在含铁细胞内未检出非抗炎型标志物(如CD206),但能检测到特异性小胶质细胞标志物跨膜蛋白119,以及大量促炎型小胶质细胞标志物(如CD68、p22phox、诱导型-氧化氮合酶Ⅰ等)。由此可见,病变边缘激活的促炎型小胶质细胞是SEL的标志性特点,其负载的铁可以用于间接识别SEL。
2 QSM技术原理
QSM以梯度回波成像(gradient echo imaging,GRE)为基本序列,并在磁敏感加权成像(susceptibility-weighted imaging,SWI)基础上对相位图进行拟合得到局部组织场图,而后依靠微小的场强变化,利用反褶积方法将磁场进行复杂的由场到源的反演计算,直接绘制定量组织磁化率分布图,可以准确获得每个体素的相对磁化率,实现磁化率的定量测量[14]。QSM具有对磁场不均匀性特别敏感且不易受伪影干扰的特点。QSM以偏离主磁场的幅度作为其量化指标,一般用无量纲的百万分率(parts per million,ppm)或十亿分率(parts per billion,ppb)来表征其偏离程度。铁作为最常见的顺磁性物质,可以增加磁场的不均匀性,在QSM影像上表现为磁化率增高。尸检研究[15]显示,在尸体脑组织中提取多个采样组织并测量其铁含量,同时使用QSM扫描采样组织,发现采样组织的磁化率同检测铁含量呈正相关。因此,QSM能够准确定位和量化脑组织内的铁沉积。
3 QSM在评估SEL中的应用
3.1 辅助诊断疾病进展 虽然常规影像学手段无法监测MS进展,但QSM技术可以通过检测SEL边缘的铁沉积,对小胶质细胞的活化程度进行定量评估,从而辅助临床诊断MS疾病进展。QSM影像上,SEL表现为病灶边缘磁化率增高,呈环状高信号改变[8,11]。Kaunzner等[11]测量发现SEL边缘比核心的磁化率数值增高了约25ppb(ppb表示10-9),较非SEL增高约16ppb。QSM联合PET也可以检出SEL,Kaunzner等[11]在QSM上发现SEL边缘磁化率增高,该表现可与18 ku-转位蛋白(translocator protein,TSPO)示踪剂高度摄取共定位,且数值上呈正相关。这是因为TSPO可以优先与激活的小胶质细胞结合,TSPO高度摄取时能够提示小胶质细胞激活[11,16]。此外,Wisnieff等[17]采用高灵敏度元素分析激光烧蚀电感耦合等离子体质谱法(laser ablation inductively coupled plasma mass spectrometry,LA-ICP-MS)技术,在SEL边缘检测到丰富的铁元素,且能与CD68染色标记的小胶质细胞共定位;依照Langevin方程将SEL边缘的铁元素含量转换为磁化率,发现与QSM影像上SEL边缘磁化率相当。
3.2 随访及监测疾病进展 一些随访研究[12,18-20]发现,SEL的发生率或体积与MS病人神经退行性变和临床症状的恶化密切相关,表现为存在SEL的病人更易出现疲劳症状,或躯体残疾、认知障碍出现的时间窗更早且更加严重;SEL体积越大,病人脑体积萎缩和躯体残疾越严重。Absinta等[12]的临床研究证实,当MS病人有≥4个SEL时,其MS进展的发生率是无SEL病人的1.6倍,甚至在年轻(<50岁)病人中可提高到3.2倍。QSM技术可以对SEL随访评估,为病人的进行性脑损伤和残疾积累提供影像学层面的解释,从而辅助临床监测疾病进展。
多项研究[21-23]采用QSM获得MS病变的磁化率并绘制磁化率随病程进展的时间变化曲线,SEL磁化率时间变化曲线总体呈“缓慢上升、缓慢下降”特点,SEL在进展阶段中长期存在,随访数年才检测到磁化率的降低;而非SEL的磁化率时间变化曲线呈现“快速上升、快速下降”特点,非SEL在相对短时间内磁化率即可降低到与周围正常脑白质相近水平(图1A)。Zhang等[22]使用QSM技术对29例MS病人进行回顾性研究,2次扫描间隔1~2年,研究发现急性活跃阶段结束(钆强化消退时刻)时MS病变的磁化率明显增加,在进入进展阶段时达到峰值,磁化率甚至可达到急性活跃阶段时的3倍左右;将随访时间延长至6年,发现非SEL的磁化率在随访1.5年后开始降低,而SEL的磁化率直到第4年后才出现明显下降,降低开始的时间点比非SEL大约晚2年。Chen等[23]对MS病人进行了10年的回顾性研究,发现SEL的磁化率需要6~8年逐渐降低到正常脑白质相近水平。Absinta等[9]发现SEL中位持续时间可长达7年,比非SEL的磁化率降低速率慢。
不同研究中SEL和非SEL病变的体积变化率不同,但总体上SEL体积随病程进展逐渐增大,而非SEL体积逐渐减小[22,24](图1B)。SEL代表具有早期潜在恶化并逐步进展特性的病变。Zhang等[22]研究发现在急性活跃阶段,SEL体积约为非SEL的3倍,提示SEL一般由早期较大的病变进展而来,病变内存在更严重的炎症时会引发更多的脱髓鞘和铁释放;该研究还采用QSM持续多年随访MS病变体积,在0.5、4、10年时,SEL体积始终大于非SEL。这一发现也在其他GRE技术研究中被验证,如Dal-Bianco等[4]随访至第3.5年,发现SEL体积较基线时刻增长约29%,而非SEL体积减小约10%;Absinta等[12]随访至第10年,发现SEL体积始终保持稳定或以每年2.2%速度扩大,而非SEL则以每年3.6%的速度缩小。
此外,随着病程进展,SEL较非SEL更易引起脑组织的不可逆严重损伤。在不同研究[12,18,25]的基线时刻及随访第10年,SEL的T1信号均低于非SEL,信号差距随病程进展而更加显著,SEL更容易演变成T1极低信号(“黑洞”)病变(图1B)。
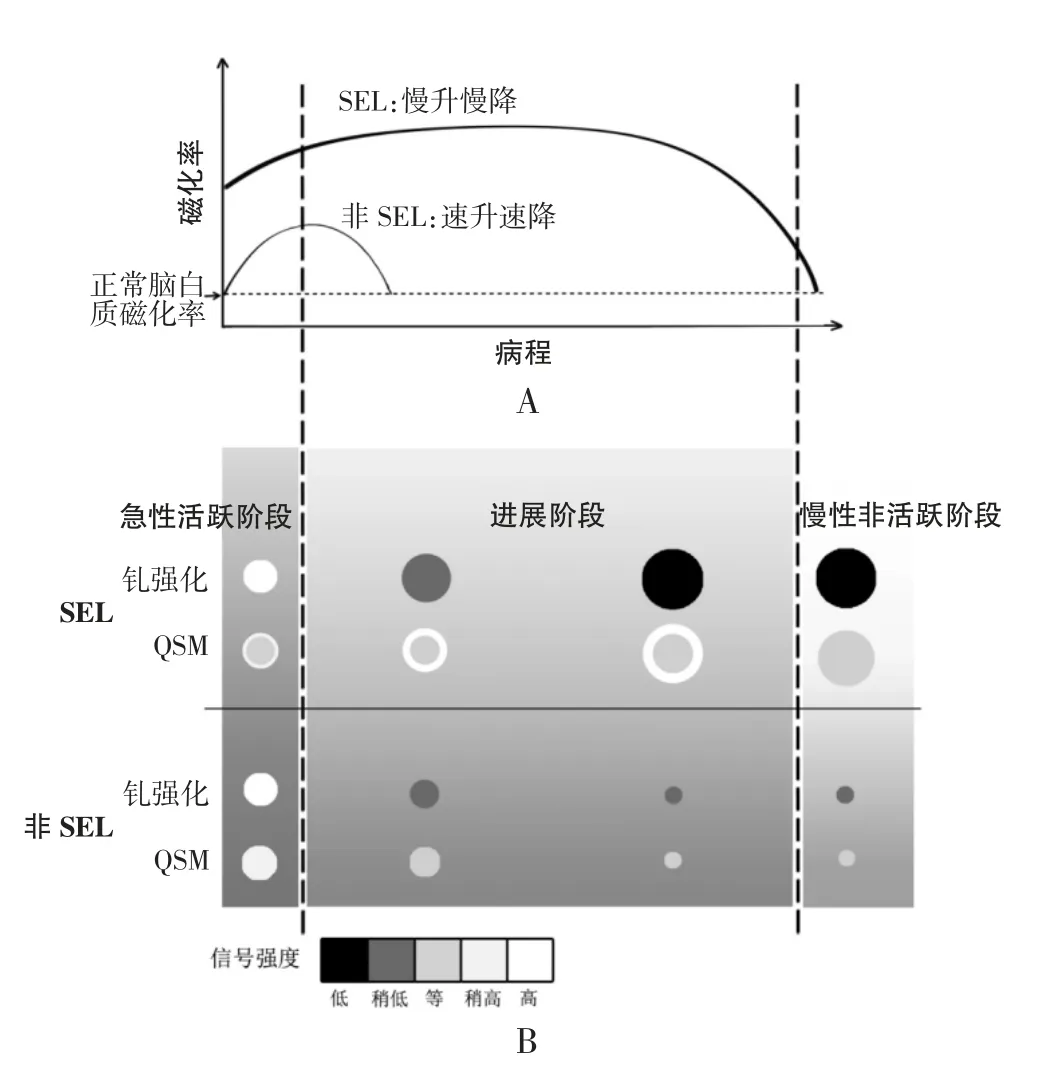
图1 SEL和非SEL的QSM磁化率随病程进展的时间变化曲线和病程演变示意图。A图为病变磁化率随病程进展的时间变化曲线。B图为病变信号和体积变化示意图。SEL进入进展阶段钆强化迅速减低,于QSM影像上呈边缘高信号环,随病程进展体积逐渐增大并最终演变为“黑洞”病变;非SEL随病程进展钆强化及磁化率迅速下降,体积较前逐渐减小。
3.3 药物疗效评价 在MS病人临床全病程管理中,临床医生需把握2个黄金治疗窗口期——疾病起始和进展阶段[26]。近年的2项大型研究[12,27]显示,目前已成功研发的疾病修饰治疗(disease modification therapy,DMT)药物大多用于病程起始阶段,可以控制MS疾病复发,延缓不可逆残疾;但用于MS进展阶段的高效DMT药物品种单一。SEL边缘的小胶质细胞在整个进展阶段中保持活性,其作为靶点具有指导临床治疗的意义[28]。Zinger等[29]在富马酸二甲酯(DMF)的临床三期试验研究中,使用QSM技术发现DMF可以降低SEL的磁化率,明显降低SEL小胶质细胞的炎症活性及其所负载的铁含量。因此,QSM技术可以检测SEL且定量反映小胶质细胞活性,成为未来在MS进展阶段确定治疗方案、评估治疗效果的有效辅助工具。
4 小结
尽管QSM可以通过定量监测铁沉积来评估SEL边缘的小胶质细胞活性,但该技术具有较高的场强依赖性,易受其他物质影响,且成像时间有一定的滞后性,因此在应用上有一些局限性。例如:①高场强可以增加QSM的磁敏感效应,从而具有更好的影像质量;而较低场强(如1.5 T)时,组织磁化率差异引起的信号改变不如在高场强(如7 T、3 T)上显著,故影像信噪比会降低[30]。②人脑内存在其他物质可以导致明显的组织磁化率差异。髓磷脂是抗磁性物质,在神经纤维轴索表面形成管状外膜,构成髓鞘。当脑白质发生脱髓鞘,正常髓磷脂被破坏,QSM影像上组织磁化率增加。因此,髓磷脂的含量会影响QSM检测组织中铁含量的准确性。③QSM影像上SEL的信号特征所反映的并非小胶质细胞活化的实时状态,而是通过量化SEL慢性活动后小胶质细胞负载铁的情况,间接反映前一时刻小胶质细胞的活性。因此,QSM识别SEL边缘铁沉积的时刻滞后于小胶质细胞激活的时刻,成像存在时间滞后性。
尽管QSM准确性及特异性尚待提高,但QSM技术可以通过识别和定量监测SEL边缘的铁沉积,来评估小胶质细胞活性,为MS进展诊断、动态监测、治疗效果评估提供新的思路和方法。因此,利用QSM技术评估SEL边缘的铁沉积,有利于确定MS进展发生的时间窗和治疗靶点,更好地改善病人的预后。

