全模型迭代重建联合靶重建对甲状腺低剂量CT影像质量的影响
卢雪花 刘冲 张建军 郝永 王淑梅
甲状腺是人体非常重要的内分泌器官,可以合成、分泌甲状腺激素,对机体生长发育及能量代谢起着关键作用。受饮食、生活习惯及电离辐射的影响,甲状腺疾病的发病率逐年增高。CT作为重要的影像学检查方法,在甲状腺疾病检查方面必不可少。然而甲状腺对电离辐射十分敏感,射线的潜在致癌风险极大限制了CT在甲状腺检查中的应用[1]。如何在保证影像质量的前提下降低甲状腺CT扫描的辐射剂量是现阶段亟待解决的问题。
目前,降低辐射剂量的主要方法有降低管电压,降低管电流,管电流自动调制[2-3]。传统的滤过反投影法(filtered back projection,FBP)虽有重建速度快、性能稳定的优势,但在重建低剂量扫描影像时往往伴有较高的影像噪声,影像质量较差。近年发展的一些重建技术,包括自适应迭代重建、混合迭代重建(hybrid iterative reconstruction,HIR)及全模型迭代重建(iterative model reconstruction,IMR)技术[4]可以降低影像噪声,提高影像质量。但前两者在低剂量扫描时降低噪声的程度有限,而IMR具有很强的降噪能力,可在降低辐射剂量的同时大幅降低影像噪声,提高影像质量。此外,靶重建是一种在常规CT基础上缩小显示野(display field of view,DFOV)的重建方法,也可提高影像质量,主要用于小器官和小病变[5]。靶重建技术可使局部影像放大,从而能够更丰富更清晰地显示影像中的细微结构,提高影像的空间分辨率[6]。
近年来,利用IMR和靶重建单独研究提高影像质量的报道较多见,但两者联合应用于甲状腺低剂量扫描的研究鲜有报道,亦未见与标准条件CT扫描进行比较的研究。本文旨在应用IMR联合靶重建方法对甲状腺低剂量CT影像进行重建,探索该方法能否在降低辐射剂量的同时提高影像质量,以期满足诊断要求。
1 资料与方法
1.1 研究对象 前瞻性纳入2020年10月—2021年6月在保定市第一中心医院拟行甲状腺CT平扫及增强检查的临床可疑甲状腺病变病人100例,其中男46例,女54例,年龄18~75岁,平均(56.89±12.67)岁。排除标准:①甲亢;②碘对比剂过敏者;③妊娠期及哺乳期病人;④严重心肾功能不全者;⑤体质量指数(body mass index,BMI)>30 kg/m2。将100例病人按照随机数表法分为2组,每组50例,分别采用不同剂量进行扫描,即80 kV低剂量扫描(low-dose CT,LDCT)组和120 kV标准剂量扫描(standard-dose CT,SDCT)组。研究经本院伦理委员会审批通过,病人在扫描前签署知情同意书。
1.2 设备与方法 采用飞利浦Brilliance iCT 256层螺旋极速CT设备,扫描范围从舌骨平面至胸1椎体下缘。扫描参数:管电压,LDCT组80 kV,SDCT组120 kV,自动调制管电流(参考管电流为180 mA,调制范围100~250 mA),准直器宽度128×0.625 mm,旋转时间0.5 s/r,螺距0.914,矩阵1 024×1 024,视野(FOV)为300 mm×300 mm,层厚3 mm,层间距3 mm,重建间隔为1.0 mm。增强扫描采用OptiVantageTMDH双筒高压注射器经病人肘前静脉注射非离子对比剂碘普罗胺(含碘300 mg/mL,拜耳公司),注射剂量1 mL/kg体质量,注射流率3.0 mL/s,随后立即以相同流率注射生理盐水30 mL。于注入对比剂后25、55 s行动脉期、静脉期扫描。
1.3 影像后处理 采用IntelliSpace Portal工作站对平扫及动脉期影像重组。LDCT组影像采用3种方案处理,分别为iDose4+DFOV 300×300(LDCT1组)、iDose4+DFOV 150×150(LDCT2组)、IMR+DFOV 150×150(LDCT3组);SDCT组影像仅采用常规方案处理,即iDose4+DFOV 300×300。先比较LDCT组3种处理方案后的影像质量,选出影像质量最优组再与SDCT组比较。
1.4 主观影像质量评估 由2名分别有8年和10年诊断经验的放射科医师分别在不知晓病人扫描参数和重建技术(允许改变窗宽和窗位)情况下独立进行影像分析,2人意见不同时商讨达成一致。评估内容包括:①肌肉锐利度(胸锁乳突肌的锐利度)。5=非常锐利,清晰显示边缘;4=锐利,较清晰显示边缘;3=一般,可显示边缘;2=较差,勉强显示边缘;1=非常模糊,难以显示边缘;②甲状腺影像清晰度。5=清晰,4=高于平均水平,3=平均水平,2=低于平均水平,1=模糊影像。③主观影像噪声。5=无噪声,4=低于平均噪声,3=平均噪声,2=大于平均噪声,1=严重噪声。
1.5 客观影像质量测量 在甲状腺峡部显示的层面上,分别于甲状腺左侧叶、左侧胸锁乳突肌、颈前正中皮下脂肪的脂肪间隙处手动绘制圆形兴趣区(ROI),ROI选择同质区域,尽量避开钙化、囊变和肿瘤等,大小设置为20 mm2。在每个ROI上测量CT值、标准差(SD)值,以胸锁乳突肌的SD值作为背景噪声,测量3次并取平均值。计算对比噪声比(contrast to noise ratio,CNR)[CNR=(CT值甲状腺-CT值胸锁乳突肌)/SD胸锁乳突肌]、信噪比(signal to noise ratio,SNR)(SNR=CT值甲状腺/SD甲状腺)。
1.6 辐射剂量分析 记录所有病人的容积CT剂量指数(the volume CT dose index,CTDIvol)、剂量长度乘积(dose length product,DLP)、总DLP。计算有效剂量(effective dose,ED),ED=DLP×k,k为转换系数,取值0.005 mSv·mGy-1·cm-1。
1.7 统计学方法 采用SPSS 23.0软件进行数据分析。符合正态分布的计量资料用均数±标准差(±s)表示,2组间比较采用独立样本t检验;非正态分布的计量资料用中位数[M(P25,P75)]表示,2组间比较采用Wilcoxon秩和检验;多组间比较采用FriedmanM检验,进一步两两比较采用q检验。计数资料采用例(%)表示,2组间比较采用卡方检验。采用Kappa检验对2名医师的测量结果进行一致性分析,κ≥0.75表示一致性较好。P<0.05为差异有统计学意义。
2 结果
2.1 2组病人基本资料及CT辐射剂量比较2组病人的年龄、性别、BMI差异均无统计学意义(均P>0.05)。LDCT组的CTDIvol、ED、DLP、总DLP均低于SDCT组(均P<0.05),详见表1。

表1 2组病人基本资料及CT辐射剂量的比较 n=50
2.2 LDCT 3组间影像质量比较
2.2.1 客观影像质量3组间CNR、SNR的差异均有统计学意义(均P<0.05)。LDCT3组在平扫和动脉期CNR、SNR均高于LDCT1、LDCT2组(P<0.05)。详见表2。

表2 LDCT 3组间客观影像质量比较n=50
2.2.2 主观影像质量 与LDCT1、LDCT2组相比,LDCT3组肌肉锐利度、影像清晰度、主观影像噪声评分均较高(P<0.05);LDCT2组肌肉锐利度及影像清晰度评分高于LDCT1组(P<0.05),但主观影像噪声评分低于LDCT1组(P<0.05),见表3、图1A-C。

表3 3组间主观影像质量评分比较 n=50,分
2.3 LDCT3组与SDCT组间影像质量比较 与SDCT组比较,LDCT3组在平扫和动脉期的CNR、SNR均较高(均P<0.05),详见表4、图1。2组间主观影像质量评分的差异均无统计学意义(均P>0.05),见表5。

表4 LDCT3组与SDCT组客观影像质量比较 n=50
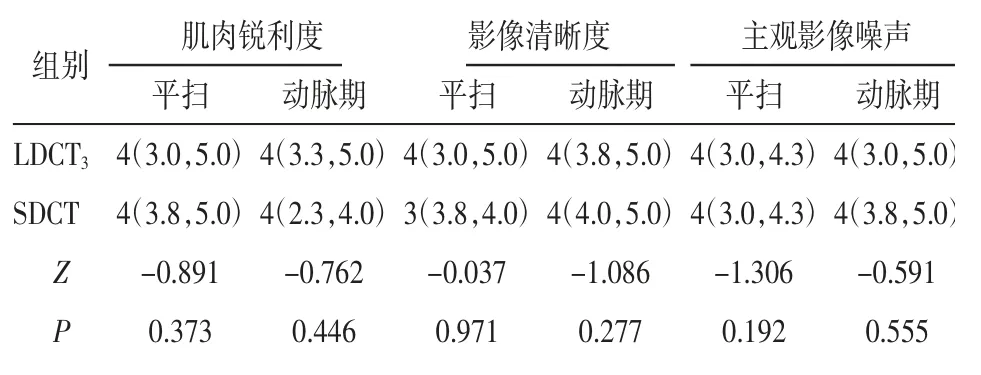
表5 LDCT3组与SDCT组间主观影像质量评分比较n=50,分
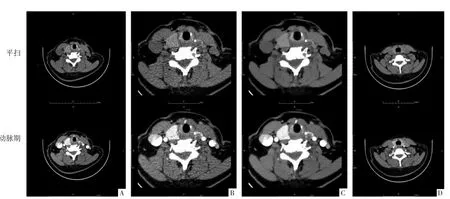
图1 LDCT组和SDCT组影像对照。A-C图为结节性甲状腺肿病人(女,53岁)LDCT1、LDCT2、LDCT3组平扫和动脉期影像。LDCT1组空间分辨率较低,密度不均匀;LDCT2组影像空间分辨率较高,密度不均匀;LDCT3组影像空间分辨率较高,密度均匀。D图为结节性甲状腺肿病人(女,50岁)SDCT平扫和动脉期影像,空间分辨率较低,密度较均匀。
2.4 2名医师主观影像质量评分的一致性分析2名医师评估4组影像质量的一致性较好(均κ≥0.75)。见表6。

表6 主观影像质量评分的观察者间一致性分析κ值
3 讨论
3.1 扫描方案的选择CT技术在疾病辅助诊断、预后评估及术后复查中发挥的作用越来越重要。然而,不可避免的辐射暴露及潜在的致癌风险是其最大的局限性[7]。Mazonakis等[8]报道,进行颈部多层CT检查时,甲状腺的吸收剂量为15.2~52.0 mGy,甲状腺恶性肿瘤的患病率会增加到0.039%。Cha等[9]研究显示进行冠状动脉CT扫描时,采用80 kV管电压联合IMR较100 kV联合iDose4的ED降低了50%。本研究应用80 kV的低管电压扫描甲状腺,较120 kV的标准剂量组平均ED、总DLP大幅降低,表明利用低管电压扫描可显著降低辐射剂量,有效保护被检查者。
低剂量扫描必然会引起影像噪声的增加,噪声是密度分辨率的主要影响因素,因此降低噪声可显著提高影像密度分辨率,从而提高影像质量。IMR可在LDCT时降低噪声,提高密度分辨率和影像质量。与HIR技术iDose4相比,IMR降低影像噪声、提高密度分辨率的能力更强。靶重建是针对小器官特有的提高影像质量的方法,可提高影像空间分辨率。因此,将两者联合应用于甲状腺LDCT有望提高其影像质量。本研究将IMR和iDose4这2种重建方法同时纳入研究,并将DFOV设定在2个水平,于LDCT组内设置3种不同的重建组合,通过两两比较,选出低剂量扫描影像质量最优组,再与标准剂量组进行比较。本研究标准剂量组采用的是临床常用的标准剂量和标准处理方案(iDose4+DFOV 300×300),如果低剂量最优组与标准剂量组的影像质量差别不大甚至更优,说明低剂量组及相应的扫描方案能够替代常规扫描方案。
3.2 客观影像质量分析 本研究比较LDCT 3组的结果发现,在较低的管电压或管电流下,相比LDCT1和LDCT2组,LDCT3组的CNR、SNR更高,影像质量更好,而LDCT1、LDCT2组影像CNR、SNR差异无统计学意义。在Park等[10]的研究中,LDCT+IMR组可以获得比SDCT+iDose4组更低的影像噪声,更好的影像质量。这与本研究结果一致。iDose4是目前临床普遍应用的影像重建方法,SDCT扫描时其重建性能良好,具有较好的影像质量,但用于LDCT时其降低影像噪声的能力有限;而IMR可大幅降低LDCT的影像噪声,增加各组织结构密度均匀性,提高影像质量。此外,靶重建能够对局部影像进行放大,DFOV 150×150较DFOV 300×300影像对细微结构显示得更清晰、更丰富,空间分辨率显著提高,影像质量有所提高。矩阵不变,DFOV越小,像素越小,空间分辨率越高。Rodriguez等[11]研究表明,小DFOV较大DFOV测量气道内径、气道壁面积百分比更为准确,测量误差更小。本研究应用大矩阵(1 024×1 024)、小像素可进一步提高影像的空间分辨率。因此,本研究LDCT组的3种方案中,选择IMR和小FOV的LDCT3组影像质量最优,将其与SDCT组进行比较,前者的CNR、SNR、影像质量均较高。由此可见,联合应用IMR与靶重建在提高影像密度分辨率的同时,还可以提高空间分辨率并获得较高的影像质量。3.3主观影像质量评分分析 本研究中对LDCT 3组影像质量评分比较发现,LDCT3组的肌肉锐利度、影像清晰度、影像噪声评分均优于LDCT1、LDCT2组。iDose4用于LDCT时,其影像密度不均,影像颗粒感强烈,密度分辨率不高。IMR使用数据统计、影像统计和系统建模来控制影像噪声[12],可使影像各部分组织或器官的密度更加均匀,提高密度分辨率,视觉感受影像质量更高。靶重建使影像细微结构显示更清晰,空间分辨率显著提高,便于肉眼观察各组织结构及较小病变。两者结合可使肌肉边缘显示更加锐利,各组织结构显示更为清晰,影像噪声较低。靶重建的影像虽然具有较高的空间分辨率,但不可避免地会增加噪声[13]。本文应用IMR降低噪声的优势来弥补靶重建导致的影像噪声的增加。LDCT3组与SDCT组的肌肉锐利度、影像清晰度、影像噪声主观评分无统计学差异。Kulkarni等[14]研究发现LDCT+IMR组影像质量主观评分高于SDCT+iDose4组,与本研究结果不太一致,这可能是由于他们的研究应用了相同管电压,不同管电流,剂量差别不大。此外,本研究中2位医师对4组影像质量评分间的一致性较高(均κ≥0.75)。
3.4 小结 联合应用IMR及靶重建2种后处理方式可同时提高空间分辨率和密度分辨率,两者优势互补使得提高甲状腺LDCT的影像质量成为可能。但本研究尚存在一定局限性,如样本量较小,可能会存在选择性偏倚;另外,未对SDCT影像进行多种方案的后处理。

