湿酒糟中乙醇等9种成分分析及拮抗物质的体外筛选
李前勇,张余蓬,朱瑞,张德志,张芝金,罗怡茜,郭灵君
(1.西南大学动物医学院,重庆 荣昌 402460;
2.重庆市兽医工程技术研究中心,重庆 荣昌 402460;3.重庆市肉牛工程技术研究中心,重庆 荣昌 402460)
0 引言
酒糟(Distillers grains,DG)是利用谷类进行酿酒发酵、蒸馏处理后的副产物,白酒、啤酒等酿造及燃料乙醇的生产均可产生酒糟[1]。我国白酒酿造历史悠久,啤酒等各类酒精饮料产业兴旺发达;燃料乙醇行业发展迅速,已是世界第3大燃料乙醇生产和消费国[2]。据记载,我国每年可产出的各类酒糟在1亿t以上[3]。基于酒糟中残存的营养及可利用物质,人们已探索出利用酒糟生产细菌纤维素、活性炭、食用醋、食用菌、木糖醇、甘油、乳酸、沼气及直接或青储用作动物饲料[4]等资源化利用的方法,其中,因酒糟中各类营养物质较为丰富[5-6],用于动物饲料比较普遍,并可以达到保护环境、节约粮食资源和酒糟的经济高效利用的目的。
酒糟中不仅含有可利用的营养素,还含有乙醇、乙酸、甲醛等对动物健康有一定伤害的物质[7]。郑玉梅等[8]分析指出,白酒糟中含有乙醇、乙酸、乳酸、脂肪酸、草酸等物质,长期使用可对动物造成伤害,并引起慢性中毒。据记载,酒糟中的乙醇可引起中枢神经功能紊乱、心肌变性和造血功能障碍,甲醇蓄积可造成视神经萎缩,并对细胞质造成毒性伤害;乙酸等有机酸可降低胃肠道PH值,引起消化紊乱、骨骼营养不良等[7]。由此可见,开展酒糟中毒性物质含量的分析,对保障动物的健康、维护动物性食品的安全均有十分重要的意义。国外,已有关于小麦型及玉米型鲜酒糟和发酵酒糟中乳酸、乙酸、乙醇、丙酸等含量的报道[9-10]。我国白酒酿造历史悠久,与西方国家比较拥有独特的酿造技艺和工艺,酿酒原料方面与国外的单一原料(如小麦、玉米)比较,也显得更加丰富,酒糟中常见的有毒成分及含量也存在差异,但却尚未见这些成份含量的报道。对于动物酒糟中毒的预防,已有的资料显示酒糟中添加一定比例的碳酸氢钠或石灰可有较好的效果[7,11],但针对酒糟中可能的有害物质开展体外拮抗物质筛选的研究,国内外却鲜有报道;酒糟中长期添喂碳酸氢钠,可能因动物机体钠离子的升高而诱发心力衰竭、水肿和碱中毒,并增加尿结石形成的机率;石灰中有硅、铁、铝、镁等杂质成分,具有腐蚀性和发热效应,常作为环境消毒剂使用,非食品级石灰在酒糟中长期添加使用可能会导致较大的健康风险。
研究采用气相色谱、高效液相色谱技术检测和分析了国产湿酒糟(白酒糟、啤酒糟)中乙醇、乙酸、乳酸、甲醛等9种物质的含量及存储过程中变动规律,并针对酒糟中乙醇、甲醛等含量较高的物质开展拮抗物质的体外筛选试验,以期获得国产酒糟中常见毒性成分的具体含量数据。
1 材料与方法
1.1 酒糟样品采集及处理
随机采集川渝地区大酒厂、小酒厂高梁型鲜白酒糟及啤酒厂新鲜啤酒糟各35 kg,置于洁净塑料袋内运回。然后每种类型酒厂酒糟均随机抽样成鲜糟组、储存7 d组、储存15 d 组、存储30 d 组,鲜糟组按每种类型酒糟采集10份,150 g /份,置洁净采样袋内,作好标记后--80 ℃保存备用。每种类型酒糟存储组再抽样成5个重复,每个重复1 000 g /份,置洁净小型塑料桶内,按照酒糟的塑料袋存储法[12],将酒糟装入干净的专用塑料袋内,压实后密封,分别于室温下避光保存7、15、30 d,勿使样品霉败。再于各保存时间点按每个重复150 g/份随机采样2份,使每种类型酒糟储存组采样为10份/组,置采样袋内--80 ℃保存备用。
1.2 仪器及药品
气相色谱仪(GC-6280)购自美国安捷伦科技有限公司,高效液相色谱分析仪(Agilent-1100)购自美国安捷伦科技有限公司,0.45μm滤膜(HVLP-1450)购自美国MiliPore公司,超纯水系统(Mili-Q)购自美国MiliPore公司,电子天平(Secura125-1CN)购自赛多利斯有限公司,无菌均质器(Scientz-IIL)购自宁波新芝生物科技有限公司,超声震荡器(KQ5200B)购自昆山市超声仪器有限公司。
磷酸(GR级)购自MERCK公司,甲醇(色谱纯)、乙醇(色谱纯)、戊醇(色谱纯)、正丙醇(色谱纯)、异戊醇(色谱纯)、异丁醇(分析纯)、甲醛(分析纯)、乳酸(分析纯)、乙酸(分析纯),均购自于天津科密欧化学试剂有限公司。碳酸氢钠(分析纯)、氧化镁(分析纯)、氧化钙(分析纯)、膨润土、腐植酸钠(精制)、蒙脱石(K-10)、分子筛(ZSM-5),均购自于上海麦克林生化有限责任公司。
1.3 试验方法
1.3.1 酒糟中甲醇、乙醇、戊醇、正丙醇、异戊醇、异丁醇、甲醛含量测定
精确称取酒糟样品10.0000 g,加超纯水15 mL,然后均质粉碎,振荡混匀后置冰水溶液中60% P(P=400W)超声提取1 h。再定容至20 mL,密封,4 ℃下冷浸过夜萃取,最后10 000 r/min 离心10 min,取上清过0.45 μm滤膜,续滤液待测。
样品中甲醇、乙醇等7种成分均采用GC-6280气相色谱仪进行检测,检测器为FID,色谱柱为DB-FFAP(30 m×0.25 mm,膜厚0.25 μm)。升温程序为:初始柱温35 ℃保持8 min;8~12 min,以5 ℃/min升至60 ℃;12~20.5 min,以20 ℃/min升温至230 ℃;保持2 min。进样口温度为230 ℃;检测器温度为250 ℃;载气为高纯氮气,流量为2.0 mL/min;进样口分流比为15∶1进样体积为1 μL。
取甲醇、乙醇、正丙醇、异戊醇、异丁醇标准品,均用超纯水进行稀释、定容至2.5、5、10、25、50、100 μg/mL浓度;戊醇标准品稀释定容至3、6、12、30、60 μg/mL浓度,甲醛标准品稀释定容至0.012、0.06、0.12、0.24、0.3、0.6 μg/mL浓度,上机检测,并以峰面积为横坐标、标准测定液的浓度为纵坐标绘制标准曲线,运用EXCEL中的LINEST函数计算其斜率、截距、相关系数、截距标准误,并利用公式“检测限(LOD)=3.3δ/S、定量限(LOQ)=10δ/S”计算各标准物质的LOD、LOQ。参照文献[12],进行甲醇、乙醇、正丙醇、戊醇、异戊醇、异丁醇、甲醛测定的精密度、回收率试验。样品组分测定所得峰面积,代入标准曲线公式计算出待测液中相应组分的浓度。
1.3.2 酒糟中乙酸、乳酸含量的测试
精确称取酒糟样品10.0000 g,均质机捣碎,转移至20 mL容量瓶内,加入超纯水15 mL,室温避光60% P(P=400W)超声提取30 min。取出,用超纯水定容至20 mL,混匀,然后取上清液过0.45 μm滤膜,续滤液待测。
参照SN /T 2007-2007 规定的高效液相色谱法[13],样品中乙酸、乳酸均采用Agilent-1100高效液相色谱分析仪进行检测。色谱柱为TSKgel ODS-100V(4.6 mm×250 mm×5.0 μm),流动相为0.1%的磷酸水溶液,流速1 mL/min;紫外检测器,检测波长为210 nm;柱温为40 ℃,进样体积20 μL。
取乙酸、乳酸标准品均精确配制4、20、32、40、64、80μg/mL浓度梯度,上机检测,并以峰面积为横坐标、标准测定液的浓度为纵坐标绘制标准曲线,按“1.3.1”计算相关系数、准物质的LOD、LOQ。参照文献[14],进行乙酸、乳酸测定的精密度、回收率试验。样品组分测定所得峰面积,代入标准曲线公式计算出待测液中乙酸、乳酸的浓度。
1.3.3 酒糟中主要毒性成分体外拮抗物质的筛选
取储存7 d未发霉符合质量要求的白酒糟(湿,小厂)随机分为18组,1~17组为试验组,第18组为对照,500 g/组,试验组按组次序号以质量百分比在酒糟中依次加入碳酸氢钠1.5%、膨润土3%,氧化镁0.5%、1%、1.5%,腐植酸钠、氧化钙、蒙脱石、分子筛均为1%、3%、5%,混匀后室温作用2 h,再采集酒糟试样,30 g/份,每个添加比例组10个重复,置洁净样品袋内,同时采集对照组样品,-- 80℃下保存备用。依照“1.3.1”“1.3.2”测定样品中乙醇、乙醇、乳酸、甲醛四种毒性成分的含量。
1.3.4 酒糟中水分的测定
精确称取白酒糟、啤酒糟样品各10份,50 g/份,采用食品中水分的测定(GB5009.3—2016)标准中蒸馏法测定样品中水分含量。
1.3.5 数据统计
试验所得数据经Excel 2016整理,计算平均值和标准偏差SD,数据以±表示;用sPss19.0软件下单因素方差分析、LSD多重比较法分析试验组间及组内不同物质间平均含量的差异,P<0.05表示差异显著。
2 结果
2.1 各标准物质的保留时间、线性方程、相关系数
由图1、2、3可知,9种标准物质能得到良好的分离,而且峰形较好。表1显示,各种标准物质的相关系数均大于0.998,表明9种物质分别在其相应的检测方法下有良好的线性关系,可以很好地对6种醇、甲醛、2种酸进行定量检测;检测限和定量限均能满足试验的要求。
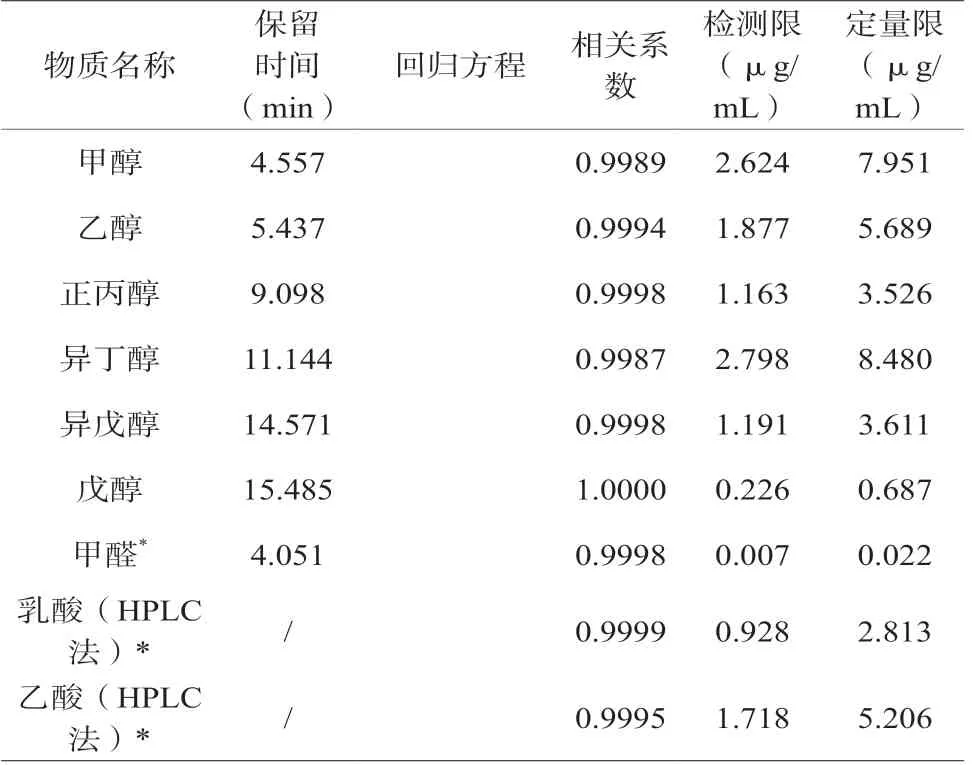
表1 9种物质的保留时间、线性回归方程、相关系数、检测限和定量限
2.2 精密度、回收率试验
利用试验所测的9种物质的标准工作液,按试验方法进行精密度试验,结果显示,9种物质的RSD分别为甲醇0.28%、乙醇0.34%、正丙醇0.41、异丁醇0.35%、戊醇0.3%、异戊醇0.38%、甲醛0.36%、乙酸0.32%、乳酸0.24%,表明试验采用方法有良好的精密度。
取小酒厂鲜白酒糟,分别测定甲醇等9种物质的本底值,再在样品中添加2个浓度水平的标准物质进行回收率试验,结果见表2。9种物质的2种不同剂量添加其回收率在93%~102.5%,表明试验采用方法回收率高,符合试验要求。
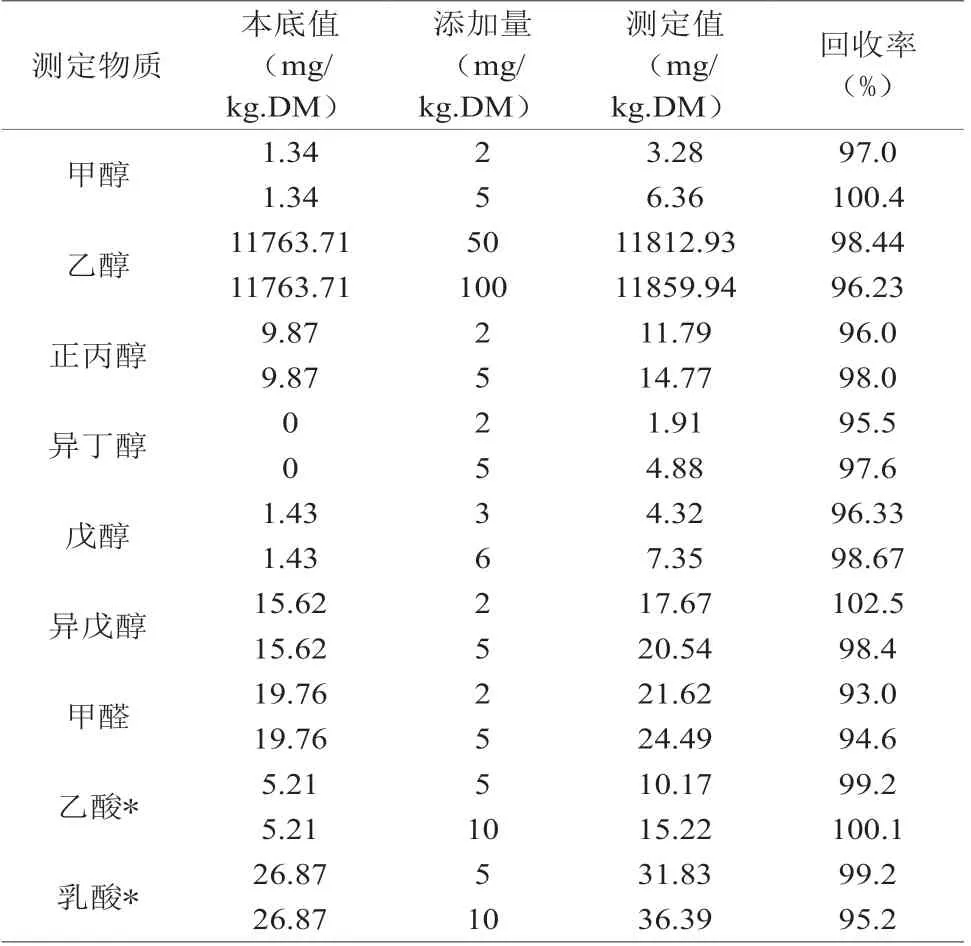
表2 9种物质回收率的测定
2.3 鲜酒糟中9种物质含量
参试酒糟样品中水分测定结果,大厂白酒糟水分含量为67.34%±5.71%、小厂酒糟为71.61%±7.83%、啤酒糟糟为83.75%±6.72%,该结果用于后续试验计算干酒糟各测定物质的含量。由表3可知,同类鲜酒糟中9种物质的含量不同,大厂白酒糟、啤酒糟中乳酸>乙酸>乙醇>甲醛(P<0.05),甲醇和异戊醇含量均为最低,正丙醇、异丁醇、戊醇均未检出;小厂的白酒糟中乳酸>乙醇>乙酸(P<0.05),甲醛、异戊醇、正丙醇含量间无显著差异(P>0.05),但三者含量均显著低于乙酸(P<0.05),戊醇、甲醇含量为最低(P<0.05),异丁醇未检出。同种物质在不同类型酒糟中含量也不同,甲醇以啤酒糟中含量最高(P<0.05),乙醇为小酒厂酒糟>大酒厂酒糟>啤酒糟(P<0.05),正丙醇、戊醇为小厂白酒糟含量最高(P<0.05),其余未检出;异戊醇为小厂白酒糟>大厂白酒糟>啤酒糟(P<0.05),甲醛为白酒糟>啤酒糟(P<0.05),乙酸则为大厂白酒糟>小厂白酒糟>啤酒糟(P<0.01),大酒厂酒糟乳酸显著高于其他2种类型酒厂酒糟(P<0.01)。所有酒糟中乙酸、乳酸、乙醇、甲醛的含量相对较高,乙醇含量范围为299.64~11667.45 mg/kg.DM,乙酸含量范围为1.80~7.11 g/kg.DM,乳酸含量为25.41~92.90 g/kg.DM,甲醛含量为9.64~18.79 mg/kg.DM。
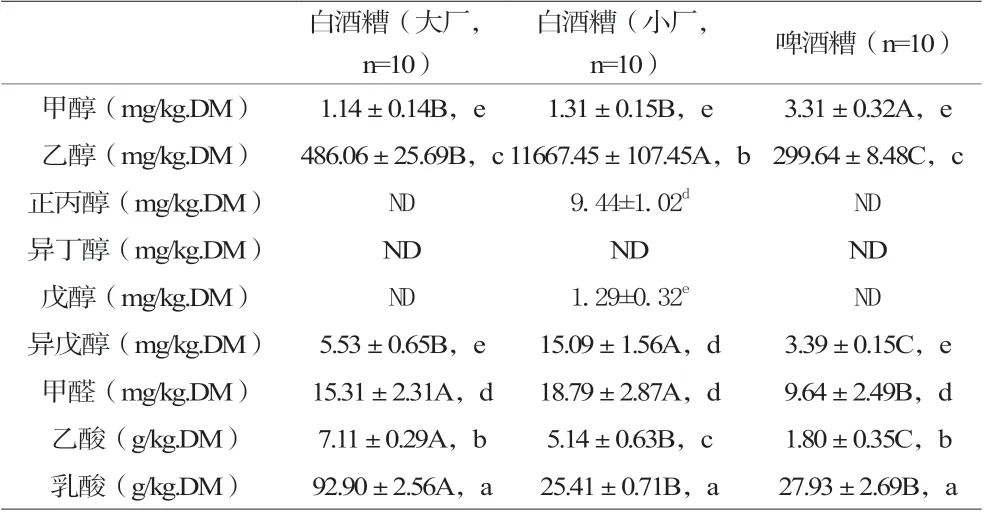
表3 鲜酒糟样品中9种物质的含量
2.4 储存酒糟中8种物质含量的变化规律
由图4至图11可知,酒糟中甲醇含量随着储存时间的增加呈现显著的增加,以啤酒糟最为明显,储存30 d达到26.78±1.93 mg/kg.DM;大厂的白酒糟和啤酒糟乙醇含量随储存时间的增加而呈现显著的增加,储存30 d分别达到5 331.53±1 138.48 mg/kg.DM、7 362.26±93.99 mg/kg.DM,但小厂白酒糟中乙醇含量在储存15 d后有显著下降;啤酒糟中正丙醇含量随储存时间的增加显著增加,小厂白酒糟只是在储存7 d时有显著增加;小厂白酒糟中戊醇含量存储15 d后呈现显著下降;大厂白酒糟和啤酒糟中异戊醇含量在储存7、15 d时显著增加,小厂白酒糟异戊醇含量储存7 d及以后显著增加。
小厂白酒糟和啤酒糟中甲醛含量随储存时间增加而升高,以啤酒糟储存15 d时达到最高(为208.62±5.87 mg/kg.DM),大厂白酒糟在储存7、15 d显著降低;大厂白酒糟和啤酒糟中乙酸含量随储存时间增加而升高,以大厂储存15 d达到最高值(为12.73±0.13 g/kg.DM),小厂白酒糟乙酸随储存时间的增加而降低;3种类型酒糟中乳酸含量均随储存时间的增加而出现显著下降,以啤酒糟储存30 d时含量最低(为1.98±0.42 g/kg.DM)。
2.5 酒糟主要毒性成分体外拮抗物质的筛选
试验以酒糟中乙醇、乙酸、乳酸、甲醛四种主要检出物为衡量对象,研究碳酸氢钠、膨润土、氧化镁等7种物质体外拮抗酒糟中主要毒性成分的作用,结果显示,与酒糟对照组中乙醇含量比较,7种物质不同浓度处理后的酒糟中乙醇含量均显著降低(P<0.01),其中,1%蒙脱石和1%氧化钙处理后乙醇的检出量最低,其次是0.5%、1%的氧化镁,而1.5%碳酸氢钠、5%氧化钙和1%、3%分子筛的作用最差;除5%的氧化钙外,7种物质的相应试验浓度处理后酒糟中乙酸含量均显著的降低(P<0.05),其中,1.5%的碳酸氢钠和1%、5%的蒙脱石以及1.5%的氧化镁处理后乙酸的检测量最低,其次是3%的膨润土、3%蒙脱石和0.5%、1%氧化镁、1%腐植酸钠,3%、5%的氧化钙的作用最差;除3%蒙脱石、1%和5%分子筛外,7种物质的其他浓度处理后的酒糟中乳酸含量均极显著降低(P<0.01),其中,1.5%的氧化镁处理后乳酸检出量最低,其次是1%的氧化镁和3%、5%的氧化钙,1%、5%的分子筛和3%、5%的蒙脱石的作用最弱;不同浓度的氧化镁、氧化钙、蒙脱石、分子筛处理后酒糟中甲醛含量均显著降低(P<0.01),其中,3%、5%的分子筛、3%、5%的氧化钙处理后甲醛的检出量最低,其次为1%、1.5%的氧化镁、1%氧化钙及1%分子筛,3个比例的腐植酸钠、1.5%的碳酸氢钠及3%膨润土的作用最弱。所筛选的物质中,1%氧化镁对酒糟中乙醇、乙酸、乳酸、甲醛4种毒性成分均能显示较好的拮抗效果,1%氧化钙、1%蒙脱石也可发挥一定的拮抗效果,见表4。
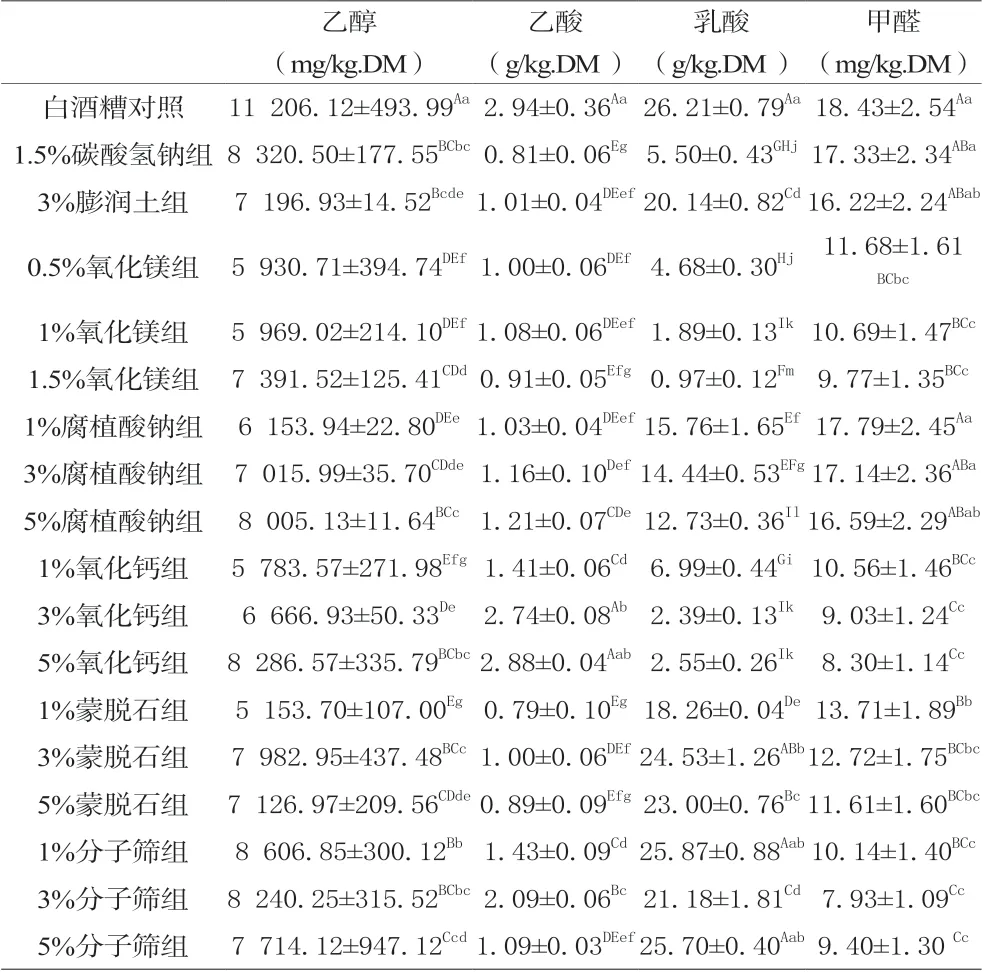
表4 7种物质对酒糟中4种成分检出量的影响
3 讨论分析
谷物类酒糟(干)中粗蛋白含量为26%~31.7%、脂肪9.1%~14.1%、酸性及中性纤维44.5%~64.7%,有必需和非必需氨基酸18种,微量元素Fe、Zn、Mn、P等含量丰富[1,5-6,15],与其原料谷物比较通常高约3倍,是良好的动物饲料资源,目前已广泛应用于奶牛[16]、肉牛[17]、猪[18]、羊[19]等动物的饲养过程中。Firkins等比较了干、湿酒糟作为牛、羊蛋白、能量饲料的饲喂效果,结果表明牛羊日粮中至少可以饲喂50%(干物质比例)的湿酒糟,并可保证其良好的生长性能,干、湿酒糟中的氮、中性纤维的消化率无显著差异,说明湿酒糟用于动物生产可以取得与干酒糟一致的饲喂效果。然而酒糟中不仅有动物可利用的营养物质,还有乙醇、乙酸、乳酸、甲醛等物质的残存,长期或超剂量饲喂可对动物健康带来损害[7,9,11],尤其是湿酒糟更值得引起警惕。Pedersen等[9]采用高效液相测定等方法分析了小麦鲜湿酒糟中乙醇、乙酸、乳酸含量,结果乙酸、乳酸分别为1、17 g/kg.DM,乙醇未检出;而储存的小麦酒糟中3种物质含量依次为5、12、88 g/kg.DM,三种物质在存储酒糟中均显示明显升高;Kamal Mjoun等[10]的研究显示,鲜湿酒糟中乙醇、乙酸较低,未检出,乳酸含量为9.0 g/kg.DM,但乙酸在存储14 d升高到2.9 g/kg.DM,乳酸储存14 d达到10.1 g/kg.DM,乙醇储存129 d升高到10.0 g/kg.DM。目前关于酒糟中残存的醇类、醛类、杂醇油、酸类等的数量研究报道较少,且并不十分完善。本试验基于我国白酒、啤酒的现行生产工艺,以兽医内科教材记载的酒糟中的主要毒性成份为依据,检测和分析了鲜湿高粱型白酒糟、储存高粱型白酒糟及啤酒糟中9种毒性物质的含量,结果表明,鲜啤酒糟、不同类型酒厂的白酒糟中9种成分含量均不同,但所有酒糟中乙醇、乙酸、乳酸、甲醛的含量相对较高,乙醇含量范围为299.64~1 1667.45 mg/kg.DM,乙酸含量范围为1.80~7.11 g/kg.DM,乳酸含量为25.41~92.90 g/kg.DM,甲醛含量为9.64~18.79 mg/kg.DM,异戊醇在3种酒糟中均能很好检出;存储试验期内,啤酒糟、大厂白酒糟中乙醇、乙酸含量随储存时间增加而显著上升,小厂白酒糟则呈现显著下降;3种酒糟中乳酸含量均随储存时间的增加而出现显著下降;啤酒糟和小厂白酒糟中甲醛含量随储存时间增加而升高,大厂的白酒糟在储存15 d内显著降低。试验结果与已有的报道有较大的差异,这主要与酿酒过程使用的谷物类原料、接入菌种、蒸馏工艺等的差异有关,如国外一般以玉米、小麦等单一原料进行酿酒,而国内多为五谷杂粮为主,且成份混杂;国外多以先进的发酵、蒸馏设备和规范科学的菌种植入,而国内小酒厂酿造设施和技术等相对欠缺。值得说明的是,我国幅员辽阔,各地白酒酿造的原料、工艺等差别较大,本试验所得结果并不能完全反映各地酒糟中已测成份的含量,还需作进一步的研究。但在目前尚未见我国酒糟中9种毒性成分含量记载的情况下,本试验结果可为畜禽生产中科学、高效、安全利用酒糟提供有力的剂量计算依据。
动物鲜酒糟可引起以乙酸中毒为主的症状;长期大量乳酸摄入,可降低胃肠道内容物的酸度,影响其微生物区系,降低消化机能和钙的吸收,酒糟中加入1%~1.5%的碳酸氢钠或0.1%~1%生石灰是目前预防动物酒糟中毒的常见策略[7],但尚未相关的试验研究报道。本试验选择目前在动物生产中广泛使用的,并具有吸附、中和酒糟中酸类、醇类作用的膨润土、氧化镁、腐植酸钠、蒙脱石等物质,研究其体外拮抗酒糟中主要毒性成分的效果,结果显示,对乙醇拮抗作用最强的是1%蒙脱石和1%氧化钙,对乙酸的拮抗作用最强的是1.5%的碳酸氢钠和1%、5%的蒙脱石及1.5%的氧化镁,对乳酸拮抗作用最强的是1.5%的氧化镁,对甲醛拮抗作用最强的有3%、5%的分子筛、3%、5%的氧化钙,但对测定的4种毒性物质的综合拮抗作用最好的是1%氧化镁,1%氧化钙、1%蒙脱石可发挥一定的拮抗效果。镁是牛羊及其他动物体的常量元素之一,饲料中添加0.8%的水平可调节瘤胃液pH 值、预防热应激、提高乳脂率,而饲料中不饱和脂肪酸含量增加时可通过皂化作用降低镁的吸收,而酒糟中脂肪及酸类物质较高,1%的氧化镁添加使用引起镁风险并不大,从试验所得数据0.5%~1%的氧化镁均可有效降低酒糟中乙醇、乙酸、乳酸、甲醛的检出率,实际生产中可适当选择使用。研究结果为人们寻求预防动物酒糟中毒提供新的参考。
4 结论
本试验分析川渝地区大、小白酒厂的高粱型白酒糟、啤酒糟中乙醇等9种物质含量,鲜湿酒糟、啤酒糟中乙醇、乙酸、乳酸、甲醛的检出量较高,按干物质计算,乙酸、乳酸及乙醇含量可达克级水平;储存30 d内,啤酒糟中乙醇、乙酸、甲醛含量均呈显著上升,大酒厂酒糟乙醇、乙酸含量呈显著上升,而小酒厂因其鲜糟中乙醇、乙酸、甲醛及3类酒糟中乳酸含量较高,在储存过程中呈现显著下降,但均高于其他5种物质含量。提醒牛羊生产中使用时应特别关注乙酸、乳酸、乙醇等4种物质可能对动物健康带来负面影响。酒糟主要毒性成分体外拮抗物质筛选结果,以1%的氧化镁效果最好,考虑动物镁摄入过多的风险,结合体外筛选试验的结果,建议生产中氧化镁的使用浓度选择为0.5%~1%。

