阿克替苷通过激活血红素加氧酶-1抑制H2O2诱导的视网膜神经节细胞氧化损伤
李晓勇 孟凡颖 白赫南
青光眼是一种以视网膜神经节细胞(RGCs)和视神经进行性变性为特征的眼部神经退行性疾病[1]。如果得不到有效控制,最终会因为RGCs的死亡而导致失明。青光眼视网膜的主要病理特征为RGCs的慢性进行性退变和视野的损害。最近研究显示,氧化应激参与青光眼RGCs的损伤机制[2-3]。因此,寻找合适的药物预防、阻断、逆转RGCs氧化应激损伤是治疗疾病的关键,也是目前研究的热点之一。阿克替苷(acteoside)是一种糖苷类化合物[4],在神经退行性疾病阿尔茨海默病[5]和帕金森病[6]中具有神经保护作用。但是阿克替苷在氧化应激诱导的RGCs损伤中是否具有神经保护作用尚未完全清楚。因此,本研究以H2O2诱导的RGC-5细胞为模型,研究阿克替苷是否抑制H2O2诱导的氧化损伤,以及血红素加氧酶-1(HO-1)上调在阿克替苷抑制H2O2诱导的氧化损伤中的作用。 以期明确阿克替苷抑制氧化应激引起的RGCs的具体机制,为阿克替苷作为青光眼神经保护剂的研发工作提供科学依据。
1 材料与方法
1.1 材料阿克替苷(上海融禾医药科技发展有限公司);小鼠RGC-5 细胞株、DMEM 培养液、胎牛血清(美国Gibco公司);兔抗小鼠Bcl-2、Bcl-2/Bax、半胱氨酸蛋白酶-3(Caspase-3)、β-肌动蛋白(β-actin) 抗体(美国 Cell signaling公司);HO-1抗体 (#SPA895,加拿大Stressgen公司);辣根过氧化物酶(HRP) 标记的山羊抗兔 IgG二抗、罗丹明123(Rh123) 、噻唑蓝(MTT)(美国Sigma公司);HO-1抑制剂锌原卟啉(ZnPP)(美国Santa Cruz公司);活性氧(ROS)荧光探针H2DCF-DA(美国Invitrogen公司) 。
1.2 方法
1.2.1 RGC-5细胞的培养RGC-5细胞用DMEM培养基(含青霉素100 ×103IU·L-1,链霉素100 IU·mL-1)加入体积分数10% 胎牛血清培养。于37 ℃、体积分数5% CO2条件下培养,选取对数生长期细胞进行实验。
1.2.2 实验分组在初始筛选阿克替苷神经保护浓度时,将RGC-5细胞分为对照组、H2O2组(H2O2处理细胞24 h)、阿克替苷+H2O2组(1 μmol·L-1、10 μmol·L-1、30 μmol·L-1阿克替苷分别预处理细胞2 h后,200 μmol·L-1H2O2处理细胞24 h),MTT 法检测各组细胞活性。后续实验阿克替苷+H2O2组选择30 μmol·L-1阿克替苷作为治疗浓度,荧光探针H2DCF-DA检测活性氧(ROS)产生和Rh123检测线粒体膜电位,Western blot检测各组细胞中Bcl-2、Bax、Caspase-3蛋白表达;机制研究中首先用不同浓度阿克替苷单独处理RGC-5细胞24 h,Western blot检测HO-1蛋白表达水平,进一步ZnPP预处理RGC-5细胞1 h,而后30 μmol·L-1阿克替苷单独预处理后与200 μmol·L-1H2O2共孵育24 h(阿克替苷+H2O2+ZnPP组),通过MTT法测定细胞活力。
1.2.3 细胞活力检测RGC-5细胞以每孔1×104个接种于96孔板中,每孔100 μL。于37 ℃、体积分数5%CO2培养箱中培养过夜。12 h后,吸弃上清液,每孔加入5 g·L-1MTT 20 μL,37 ℃孵育4 h,并加入150 μL DMSO,振荡8 min,待紫色结晶充分溶解后,置酶标仪上测各孔光密度(D)。然后以D求细胞存活率。
1.2.4 细胞内ROS测定用荧光探针H2DCF-DA染色法检测细胞内ROS。H2DCF-DA溶于DMSO中,-20 ℃避光保存。染色前用培养基稀释为工作浓度。即处理好的细胞加载荧光探针H2DCF-DA,37 ℃孵育15 min。PBS洗3次,用荧光酶标仪测定细胞内DCF的荧光强度。
1.2.5 线粒体膜电位测定Rh123用无血清的DMEM配制,加入到96孔板中。37 ℃ 培养箱内孵育30 min,弃DMEM培养液,0.01 mol·L-1PBS洗3次,荧光酶标仪检测。激发波长488 nm,发射波长525 nm,求其平均荧光强度。
1.2.6 Western blot检测分组处理后的 RGC-5细胞,PBS洗3次,裂解液收集细胞,冰上放置30 min,12 000 r·min-1离心20 min,收集上清,Bradford法测定蛋白浓度。2×上样缓冲液混合蛋白,开水煮沸蛋白5 min。100 g·L-1SDS-PAGE电泳,蛋白转膜到PVDF膜,封闭,孵育兔抗小鼠Bcl-2/Bax、Caspase-3和HO-1或鼠抗 β-actin 抗体。 ECL荧光显影液加膜上反应,暗室内膜正面朝下盖于X线胶片上,分别曝光,胶片显影,定影。凝胶图像分析仪扫描图像并分析。
1.3 统计学方法结果以均数±标准差表示。资料采用GraphPad Prism 5.0 software (GraphPad Software,Inc.,San Diego,CA)分析软件进行统计分析,两组数据比较采用t检验。检验水准:α=0.05。
2 结果
2.1 阿克替苷抑制H2O2诱导的 RGC-5细胞损伤阿克替苷(1 μmol·L-1、10 μmol·L-1、30 μmol·L-1)预处理2 h后,200 μmol·L-1H2O2处理细胞24 h。与对照组相比,H2O2组中细胞活力明显降低(P<0.01)(图1)。与H2O2组相比,阿克替苷+H2O2组中10 μmol·L-1、30 μmol·L-1阿克替苷预处理均可显著提高细胞活力(P<0.05、P<0.01),表明阿克替苷可以抑制 H2O2诱导的细胞毒性损伤。

图1 各组RGC-5细胞活力 A组:对照组;B组:H2O2组;C组:阿克替苷(1 μmol·L-1)+H2O2组;D组:阿克替苷(10 μmol·L-1)+H2O2组;E组:阿克替苷(30 μmol·L-1)+H2O2组。*P<0.05,**P<0.01。
2.2 阿克替苷抑制H2O2诱导的RGC-5细胞ROS生成增加与对照组相比,H2O2组RGC-5细胞ROS的生成明显增加(P<0.05);与H2O2组相比,阿克替苷+H2O2组RGC-5细胞ROS的生成减少(P<0.05)(图2)。结果表明,阿克替苷可以抑制H2O2诱导的RGC-5细胞ROS的生成。
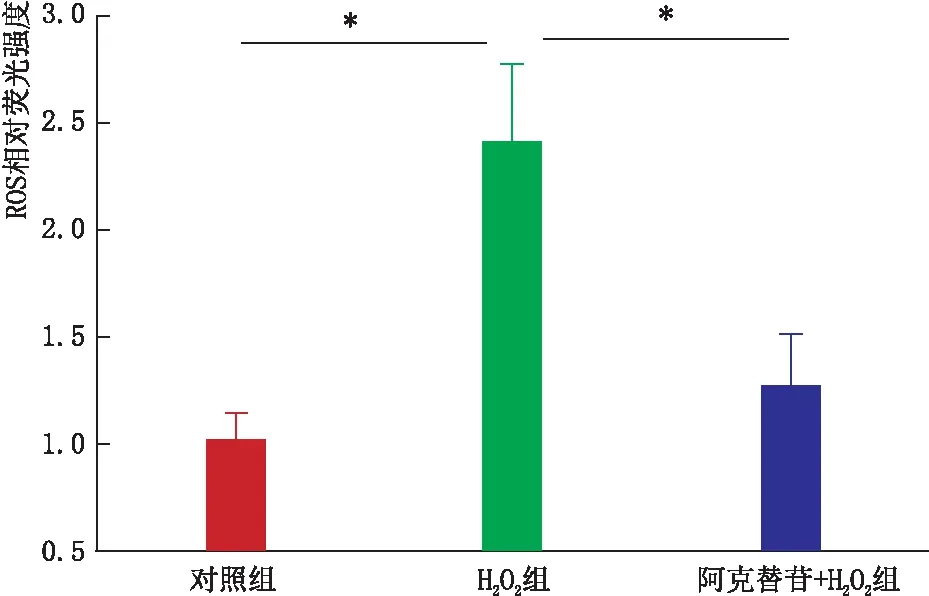
图2 各组RGC-5细胞ROS生成 *P<0.05。
2.3 阿克替苷抑制H2O2诱导的 RGC-5细胞线粒体膜电位降低与对照组相比,H2O2组RGC-5细胞线粒体膜电位显著降低(P<0.05);与H2O2组相比,阿克替苷+H2O2组RGC-5细胞线粒体膜电位的降低得到恢复(P<0.05)(图3)。结果表明,阿克替苷可以抑制H2O2诱导的RGC-5细胞线粒体膜电位降低。
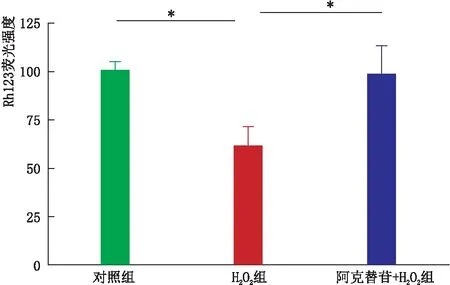
图3 各组RGC-5细胞线粒体膜电位降低 *P<0.05。
2.4 阿克替苷抑制H2O2诱导的RGC-5细胞凋亡与对照组相比,H2O2组RGC-5细胞Bcl-2/Bax比值降低(P<0.05);与H2O2组相比,阿克替苷+H2O2组Bcl-2/Bax比值升高(P<0.05)(图4A)。与对照组相比,H2O2组Caspase-3蛋白相对表达量增加(P<0.05);与H2O2组相比,阿克替苷+H2O2组Caspase-3蛋白相对表达量降低(P<0.05)(图4B)。表明阿克替苷可以抑制H2O2引起的RGC-5 细胞凋亡发生。

图4 阿克替苷对H2O2处理的RGC-5细胞Bcl-2/Bax比值和Caspase-3蛋白表达的影响 A:Western blot检测Bcl-2、Bax蛋白表达。B:Western blot检测Caspase-3蛋白表达。*P<0.01;#P<0.05。
2.5 阿克替苷通过上调HO-1通路抑制H2O2诱导的 RGC-5细胞损伤阿克替苷单独处理RGC-5 细胞,Western blot检测HO-1蛋白的表达,与阿克替苷未处理(0 μmol·L-1阿克替苷)组相比,阿克替苷剂量依赖性诱导HO-1蛋白的表达(图5A)。与对照组相比,H2O2组细胞活力降低(P<0.05),阿克替苷+H2O2组细胞活力较H2O2组升高(P<0.05);与阿克替苷+H2O2组相比,加入ZnPP后细胞活力降低(P<0.01)(图5B)。说明HO-1活性抑制剂ZnPP预处理能够逆转阿克替苷对H2O2诱导的RGC-5 细胞损伤的抑制作用,表明阿克替苷通过上调HO-1表达抑制H2O2阿克替苷/μmol·L-1诱导的RGC-5细胞损伤。
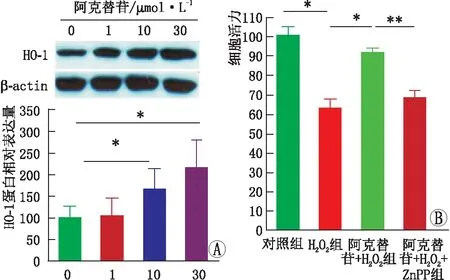
图5 阿克替苷诱导的HO-1保护RGC-5细胞免受H2O2介导的细胞毒性损伤 A:不同浓度的阿克替苷孵育RGC-5细胞24 h,Western blot检测HO-1蛋白的表达;B:MTT法测定各组细胞活力。*P<0.05,**P<0.01。
3 讨论
本研究探讨阿克替苷是否对氧化应激引起的RGCs损伤具有神经保护作用。以H2O2诱导的RGC-5细胞为模型,通过MTT、细胞内ROS测定、线粒体膜电位检测、Western blot检测等方法,从形态学水平和蛋白水平研究阿克替苷对H2O2诱导的RGC细胞系RGC-5细胞毒性损伤的保护作用。本研究结果表明,阿克替苷能够通过抗氧化、抗凋亡和诱导HO-1蛋白表达的作用来抑制H2O2诱导的RGC-5细胞损伤。
目前有许多假说来解释青光眼RGCs死亡的相关机制,这些机制包括RGCs轴突的缺血性损害[7]、神经营养因子的丧失[8]、RGCs轴突的机械性损伤[9]以及视网膜神经胶质细胞的功能失调[10]。目前也有研究显示,RGCs死亡的原因与兴奋性氨基酸[11]和凋亡[12]有关。近年来氧化应激和ROS在青光眼中的发病作用引起广泛关注[13-14]。ROS在青光眼的发病机制中发挥至关重要的作用。ROS作为信号分子激活许多对应激敏感的通路,引起细胞损伤,导致细胞凋亡的发生[15]。研究显示,在青光眼动物模型和患者中视网膜、视神经内氧化应激的水平升高[15-16]。而流行病学研究显示,许多青光眼患者血液和房水内氧化能力降低,同时伴有抗氧化酶水平的相应增高[17],这表明氧化应激损伤是青光眼的重要发病机制。因此,针对抗氧化损伤抑制ROS产生,成为了预防青光眼的重要治疗靶标,针对抗氧化损伤抑制RGCs死亡发生的研究成为了目前国际的研究热点,许多抗氧化剂可抑制氧化应激引起的RGCs死亡的发生[18]。因此,越来越多学者研究天然化合物在抑制氧化应激引起的RGCs死亡中的神经保护作用。
阿克替苷是一种广泛存在于植物中的糖苷类化合物,具有许多药理学活性。最近研究显示,阿克替苷具有广泛神经保护活性,在神经退行性疾病和其他神经系统疾病中广泛被研究[19-23]。但是阿克替苷是否会抑制RGC-5的氧化应激损伤目前尚不清楚。本研究以H2O2诱导的RGC-5细胞为模型,明确了阿克替苷能够抑制H2O2诱导的RGC-5细胞活力降低、ROS产生和线粒体膜电位的降低,同时抑制H2O2诱导的Bcl-2/Bax比值降低以及Caspase-3蛋白的活化。这一抗凋亡特性与其他研究结果相符[5,24]。HO-1就是细胞抗氧化和细胞保护防御体系的一个重要组成部分,其主要功能为催化血红素产生一氧化碳、胆绿素(快速地转化为胆红素)和游离铁。近年研究显示,HO-1表达上调能够抑制氧化应激损伤,进而在神经退行性疾病等多种疾病中具有抑制氧化应激损伤的保护作用[25]。通过药物上调HO-1可抑制多种眼科疾病导致的RGC-5氧化应激损伤[26-29],因此,我们接下来检测阿克替苷是否在RGC-5细胞中上调HO-1以及这种上调在阿克替苷抑制H2O2诱导的RGC-5细胞氧化损伤中的作用。阿克替苷能够剂量依赖性上调RGC-5细胞HO-1的表达,这与其他研究相符[30]。而HO-1抑制剂ZnPP减弱阿克替苷抑制H2O2诱导的RGC-5损伤作用,表明HO-1表达上调参与阿克替苷对H2O2诱导的RGC-5细胞损伤的作用机制。
总之,本研究结果表明,阿克替苷能够通过抗氧化、抗凋亡和诱导HO-1表达抑制H2O2诱导的RGC-5细胞损伤。为阿克替苷作为青光眼等眼科疾病的研发工作提供科学依据。

