KLF7对TLR4/NLRP3炎症小体激活的抑制作用及其对视网膜缺血-再灌注损伤大鼠细胞凋亡的影响
夏江南 沈 蕾 李晶晶
视网膜缺血-再灌注(RIR)损伤参与了多种眼科疾病发生和发展的过程,如急性青光眼、视神经病变、糖尿病视网膜病变、视网膜血管阻塞等[1]。RIR损伤的特点是神经元广泛缺失,视网膜形态变性,视网膜功能丧失,最终导致视力损害和丧失视力[2]。视网膜神经节细胞(RGC)是视网膜的一种重要神经元,将视网膜通过光传输等刺激获得的信息传递给大脑,尤其容易受到RIR的影响[3],因此,以神经保护为基础的治疗可能是减少RGC损伤和改善RIR损伤的新策略。近年来,越来越多的研究表明,炎症反应与RIR损伤有一定的关系。有研究证明,Toll样受体4/NOD样受体热蛋白结构域相关蛋白3 (TLR4/NLRP3)炎症小体的激活参与了RIR的发生和发展[4]。NLRP3炎症小体以半胱天冬酶-1依赖的方式触发,使细胞膜崩解而穿孔,导致炎症因子释放[5]。To11样受体(TLRs)是机体内最重要的模式识别受体,如TLR4在调节固有免疫及适应性免疫中起到重要作用,可诱导下游NLRP3炎症小体的表达[6]。在RIR损伤中,TLR4信号转导被激活,导致NLRP3炎症小体激活,进一步触发了白细胞介素(IL)-18和IL-1β的产生,导致视网膜功能改变[7]。Krüppel样因子7(KLF7)是KLFs转录因子家族中的一员,可以调节细胞的生长、增殖、迁移、分化、代谢、炎症和凋亡。有研究报道,KLF7与多种人类疾病有关,包括癌症、肥胖、糖尿病、炎症和心血管疾病等[8]。但是关于KLF7在眼部疾病中的研究很少,因此,本研究探讨KLF7是否通过TLR4/NLRP3炎症小体的激活调控细胞的凋亡,从而影响大鼠RIR的病理过程。
1 材料与方法
1.1 实验动物健康无眼疾SD大鼠60只,雄性,体重300~350 g,10周龄,购于北京维通利华实验动物技术有限公司[SCXK(京)2020-0005]。统一在笼中饲养。室温21~26 ℃,相对湿度50%~60%,光暗交替各12 h。实验动物使用遵循《国家实验动物管理保护条例》以及《实验动物医学伦理条例》。
1.2 主要试剂AAV2-KLF7腺病毒购自美国 Vector BioLabs 公司;放射免疫沉淀法(RIPA)裂解液购自济南信嘉生物技术有限公司;兔抗小鼠 KLF7抗体、兔抗小鼠 TLR4抗体、兔抗小鼠髓样分化因子初次应答基因88(MYD88)抗体、兔抗小鼠 NLRP3抗体、兔抗小鼠肿瘤坏死因子受体相关分子6(TRAF6)抗体均购自美国Sigma公司;辣根酶标记山羊抗兔IgG购自北京索莱宝公司;苏木精-伊红(HE)购自北京博奥森生物技术有限公司;ELISA试剂盒、BCA蛋白检测试剂盒均购自北京中杉金桥生物技术有限公司;红霉素眼膏购自河南同源制药有限公司。
1.3 方法
1.3.1 实验分组和动物模型建立将60只大鼠随机分为对照组、RIR组和KLF7组,每组各20只。除对照组外,其他组采用前房内生理盐水灌注法建立RIR模型[9],均以右眼为实验眼,方法为:采用100 g·L-1水合氯醛以3 mL·kg-1进行注射麻醉,麻醉成功后,将大鼠俯卧位固定于鼠架固定器上,复方托品酰胺散瞳,氯霉素滴眼液清洁结膜囊,然后进行RIR的诱导。将充满生理盐水的输液器始端与血压计的输气管相连接,输液器尾端连接7号针头,按压血压计气囊使水银柱升高至140 mmHg(1 kPa=7.5 mmHg)。在大鼠前睑裂距角巩膜缘1.5 mm处将针头刺入大鼠右眼结膜下,然后潜行到角巩膜缘处穿刺进入前房。这时水银显示的压力为大鼠眼压,继续使血压计水银柱升高至110 mmHg,维持60 min。眼底镜下观察到大鼠视网膜苍白,说明视网膜缺血形成。大鼠加压60 min后缓慢放开充气柄开关,待血压计降至14 mmHg缓慢拔出灌注针头。术后在结膜囊内涂红霉素眼膏预防感染。KLF7组大鼠腹腔注射2 μL AAV2-KLF7 腺病毒(含1×1011pfu·mL-1病毒),对照组和RIR组大鼠注射100 μL PBS,均每天注射1次,连续注射7 d。
1.3.2 HE染色观察大鼠视网膜形态变化AAV2-KLF7 腺病毒注射7 d后处死每组大鼠各6只,腹腔注射100 g·L-1水合氯醛麻醉处死大鼠,立即摘除眼球,置于体积分数10%福尔马林中固定,石蜡包埋。石蜡包埋标本切成5 μm的切片。切片进行HE染色。二甲苯I和二甲苯II去蜡、脱蜡,体积分数分别为95%、80%、70%乙醇浸泡1 min,蒸馏水冲洗1 min,HE染色,逐级酒精脱水,透明,用中性树胶封片,显微镜下拍照。使用Image-Pro Plus软件进行图像分析,测量神经节细胞层(GCL)厚度和GCL中RGC数量,每组随机取3眼,每眼测量4次取平均值。
1.3.3 Western blot检测视网膜组织中KLF7、TLR4、MYD88、NLRP3、TRAF6蛋白表达水平随机取7只大鼠,采用含有苯甲基磺酰氟的RIPA裂解缓冲液裂解视网膜组织,采用BCA蛋白检测试剂盒测定蛋白浓度,蛋白在十二烷基硫酸钠-聚丙烯酰胺凝胶中电泳分离,转移到PVDF膜上。然后用体积分数5%牛血清白蛋白(BSA)阻断细胞膜,用KLF7(1500)、TLR4(11000)、MYD88(1500)、NLRP3(11000)、TRAF6(1500)一抗和辣根酶标记山羊抗兔IgG孵育1 h。采用增强化学发光法观察其免疫反应,凝胶成像系统进行发光显影。
1.3.4 TUNEL检测RGC凋亡按1.3.2中方法,视网膜切片脱蜡,用新鲜配制体积分数1%的Triton X-100室温孵育30 min,PBS洗3次。配备TUNEL工作液,每个样品中使用1 μL TdT酶,20 μL荧光标记液,滴加配备后TUNEL工作液,在37 ℃中孵育60 min,PBS洗涤3次。滴加体积分数30%的DAPI抗荧光淬灭剂封片,荧光显微镜拍照。统计视网膜切片中的TUNEL阳性的RGC数量,并计算TUNEL阳性细胞占比。
1.3.5 ELISA法检测视网膜组织中1L-18和1L-1β表达水平随机取7只大鼠,分离视网膜,匀浆于生理盐水中,300 r·min-1离心10 min,获得视网膜蛋白提取物,将其离心处理,1000 r·min-1离心20 min,去除沉淀物,用增强型BCA蛋白检测试剂盒测定蛋白质浓度。按照说明书,使用ELISA试剂盒检测大鼠视网膜中1L-18和1L-1β表达水平。
1.4 统计学处理采用 SPSS 19.0软件进行统计处理,计量资料以均数±标准差表示,组间计量资料的比较采用t检验,多组间比较采用单因素方差分析。检验水准:α=0.05。
2 结果
2.1 各组大鼠视网膜形态学变化HE染色结果显示,对照组大鼠的视网膜内界膜平滑完整,RGC呈单层排列,核较大,核内染色质分布均匀。内丛状层厚,呈网状结构,内核层排列整齐,外核层排列整齐紧密。与对照组相比,RIR组大鼠视网膜内层、内丛状层水肿加重,内核层、外核层细胞排列明显疏松、紊乱,RGC数量减少。与RIR组相比,KLF7组大鼠内界膜恢复平滑,视网膜水肿逐渐减轻,部分细胞呈空泡样变,RGC数量减少,损伤程度明显减轻(图1A)。与对照组相比,RIR组和KLF7组大鼠GCL厚度及GCL中RGC数量均降低(均为P<0.05);与RIR组相比,KLF7组大鼠GCL厚度及GCL中RGC数量均升高(均为P<0.05)(图1B和图1C)。
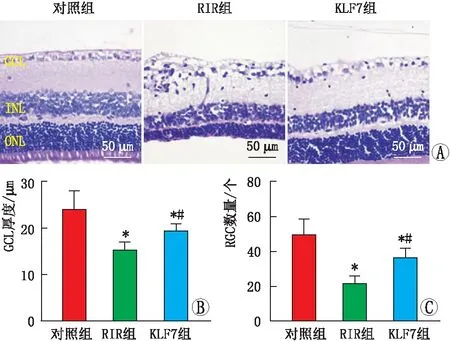
图1 各组大鼠视网膜形态变化情况 A:HE染色结果;B:三组大鼠GCL厚度比较;C:三组大鼠GCL中RGC数量比较。与对照组相比,*P<0.05;与RIR组相比,#P<0.05。
2.2 各组大鼠视网膜组织中KLF7蛋白表达水平Western blot检测结果显示,与对照组相比,RIR组大鼠视网膜KLF7蛋白的相对表达水平升高(P<0.05)。KLF7组大鼠视网膜KLF7蛋白的表达水平均显著高于RIR组和对照组(均为P<0.05)(图2A和图2B)。
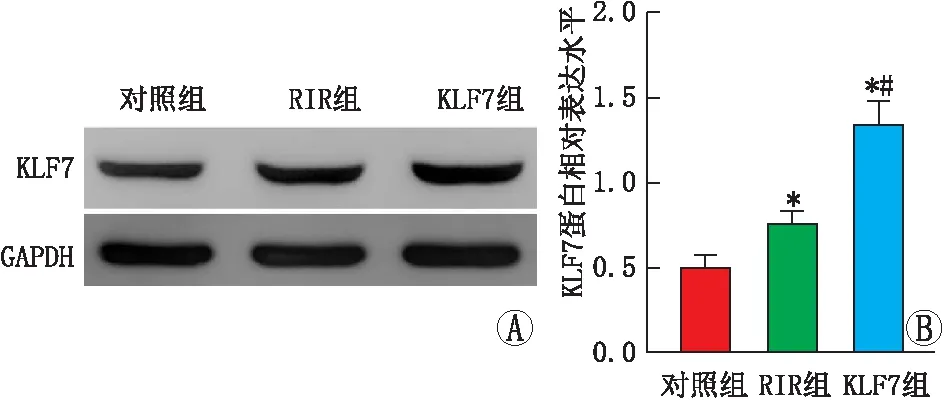
图2 各组大鼠视网膜中KLF7蛋白的表达 A:Western blot检测蛋白表达情况;B:三组大鼠KLF7蛋白相对表达水平比较。与对照组相比,*P<0.05;与RIR组相比,#P<0.05。
2.3 各组大鼠RGC凋亡TUNEL检测结果显示,与对照组相比,RIR组和KLF7组大鼠视网膜中TUNEL阳性RGC占比均升高(均为P<0.05)。与RIR组相比,KLF7组大鼠视网膜中TUNEL阳性RGC占比降低(P<0.05)(图3)。
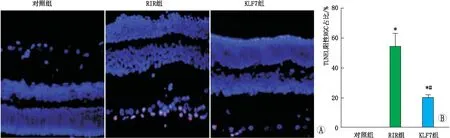
图3 各组大鼠RGC凋亡情况 A:TUNEL染色代表性图片;B:三组大鼠TUNEL阳性RGC占比比较。与对照组相比,*P<0.05;与RIR组相比,#P<0.05。
2.4 各组大鼠视网膜组织中TLR4/NLRP3炎症小体激活情况Western blot检测结果显示,与对照组相比,RIR组和KLF7组大鼠视网膜中TLR4、MYD88、NLRP3、TRAF6 蛋白的相对表达水平均升高(均为P<0.05)。与RIR组相比,KLF7组大鼠视网膜中TLR4、MYD88、NLRP3、TRAF6 蛋白的相对表达水平均降低(均为P<0.05)(图4A和图4B)。
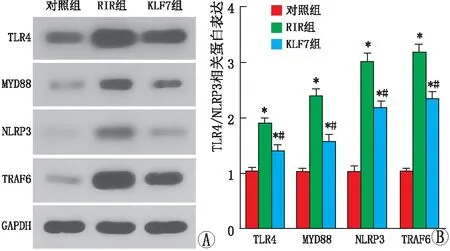
图4 各组大鼠TLR4/NLRP3炎症小体激活情况 A:Western blot检测蛋白表达情况;B:三组大鼠TLR4/NLRP3相关蛋白表达水平比较。与对照组相比,*P<0.05;与RIR组相比,#P<0.05。
2.5 各组大鼠视网膜组织中1L-18、1L-1β表达水平ELISA法检测结果显示,与对照组相比,RIR组和KLF7组大鼠视网膜中1L-18、1L-1β表达水平均升高(均为P<0.05)。与RIR组相比,KLF7组大鼠视网膜中IL-18、IL-1β表达水平均显著降低(均为P<0.05)(图5A和图5B)。
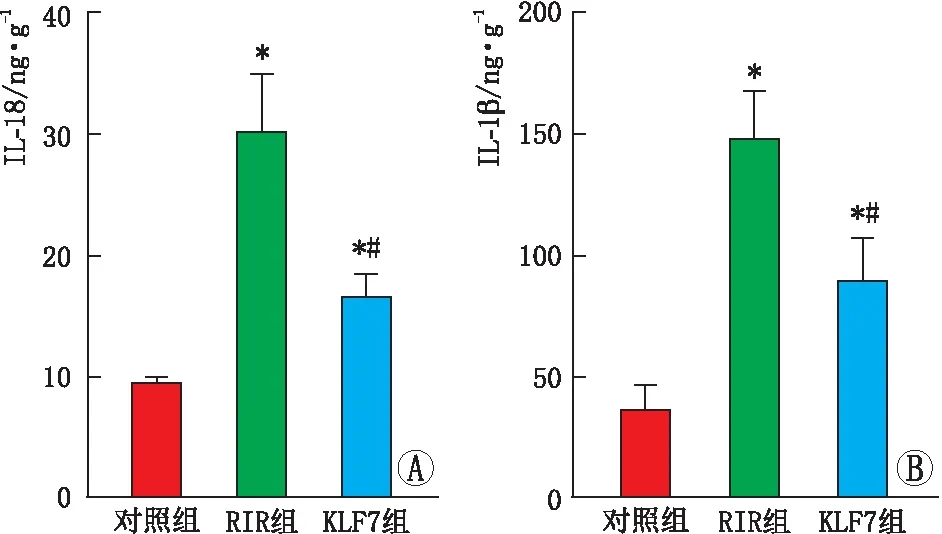
图5 各组大鼠视网膜炎症因子表达情况 A:三组大鼠视网膜中IL-18表达水平比较;B:三组大鼠视网膜中IL-1β表达水平比较。与对照组相比,*P<0.05;与RIR组相比,#P<0.05。
3 讨论
RIR损伤是眼科常见的疾病,主要病因可能是由于闭角型青光眼急性发作、视网膜血管阻塞性疾病、糖尿病视网膜病变以及影响视网膜血流的眼科手术等引起[10]。RIR损伤可引起严重的视力损害,甚至还可以导致视力丧失。目前临床治疗主要是从控制眼压、改善循环和营养神经等方面进行治疗[11],但收效甚微。所以,深入了解RIR损伤的生理、病理改变和发生发展的过程,进一步探讨RGC的凋亡路径,为治疗RIR损伤,改善视力提供新思路。
KLF7参与了多种病理和生理的过程,为关键调控转录因子,能够调控轴突再生、神经元形态、神经母细胞分化和感觉神经元存活[12]。在神经损伤反应中,KLF7能够介导轴突对损伤的反应。相关研究表明,KLF7 可减轻脊髓损伤大鼠的神经损伤,改善其运动功能[13]。也有研究表示,KLF7 对氧-葡萄糖剥夺/复氧诱导的海马神经元RIR细胞损伤具有保护作用[14]。为了解KLF7在RIR损伤中的作用,本研究通过HE染色发现,注射AAV2-KLF7 腺病毒的RIR模型大鼠视网膜水肿逐渐减轻,损伤程度明显减轻,GCL厚度和GCL中RGC数量都明显高于RIR模型大鼠。进而说明KLF7对机体免受RIR损伤具有一定的保护作用。有研究表明,KLF7过表达可提高RGC的存活率,保护其电生理功能[15],与本研究结论相似。
TLR4属于TLRs家族,研究发现,TLR4在视网膜及中枢神经系统缺血-再灌注损伤中起重要作用,TLR4信号能够激活依赖性MYD88和非依赖性MYD88的通路,促进促炎基因和炎症细胞因子的表达[16]。在TLR4信号通路中,通过MYD88募集TRAF6,最终导致免疫发生,激活炎症反应[17]。NLRP3 是炎症小体的核心蛋白,可以促进IL-18和1L-1β剪切成熟,导致炎症介质大量释放及DNA损伤,使细胞发生渗透性崩解,诱发炎症因子形成炎性瀑布效应,诱导炎症反应激活[18]。相关研究表明,视网膜缺血-再灌注损伤可通过MYD88、TRAF6诱导TLR4信号激活,进而导致NRLP3炎症小体激活和IL-1β、IL-18的分泌[19]。本研究结果表明,注射AAV2-KLF7 腺病毒的RIR模型大鼠视网膜组织中TLR4、MYD88、NLRP3、TRAF6 蛋白的表达水平均显著低于RIR模型大鼠,IL-1β、IL-18表达水平显著低于RIR模型大鼠,从而说明KLF7对机体免受RIR损伤的保护作用可能是通过抑制TLR4/NLRP3炎症小体激活介导,为视网膜RIR损伤炎症反应提供了一种新的治疗策略。
NLRP3诱导的神经炎症参与了眼病的发病和发展,研究表明,部分视神经受压力损伤小鼠模型中,NLRP3敲除后,ASC、Caspase-1、IL-1β表达减少,RGC存活明显延长,提示NLRP3炎症小体加重了炎症的损伤,进一步导致RGC丢失[20]。另外,在之前的研究中已经发现了TLR4与RGC损伤之间的关系,TLR4敲除致视神经损伤的小鼠RGC存活率高于TLR4野生型小鼠[21]。本研究结果发现,注射AAV2-KLF7 腺病毒的RIR模型大鼠TUNEL阳性细胞占比低于RIR模型大鼠,说明KLF7抑制RIR损伤中TLR4/NLRP3炎症小体的激活来抑制视网膜神经细胞的凋亡。
综上,KLF7对RIR损伤具有保护作用,KLF7可能通过抑制TLR4/NLRP3炎症小体的激活来减轻RIR的损伤。

