miR-34a-5p对ARPE-19细胞TGF-β/Smad通路相关蛋白表达及细胞增殖、迁移和上皮-间质转化的影响△
庄海容 吴子东 陈雪红 李成军
增生性玻璃体视网膜病变是一类较为常见的眼科疾病,严重时会导致玻璃体积血、视网膜脱落甚至失明。其主要的病理学机制为视网膜色素上皮(RPE)细胞的上皮-间质转化(EMT)[1-2]。探讨RPE细胞发生EMT的潜在分子机制,有助于为增生性玻璃体视网膜病变的防治提供参考依据。
微小RNA(miRNA)作为转录后调节器,参与了RPE细胞的EMT过程[3-4]。转化生长因子(TGF)-β1是一种多功能的细胞因子,在胚胎发育、伤口愈合、纤维化疾病和癌症转移期间均能诱发EMT[5]。Qi等[6]指出,在纤维化肺组织中miR-34a表达下调,而过表达miR-34a可以抑制TGF-β1诱导的肺上皮细胞EMT。国外有报道显示,miR-34a可以抑制各类肿瘤细胞的EMT行为[7]。Hou等[8]则明确提出miR-34a-5p可以抑制RPE细胞增殖与迁移。然而,miR-34a-5p对RPE细胞的作用机制仍未知。
我们初期通过生物信息学分析发现,miR-34a-5p与TGF-β/Smad通路主要分子均存在靶向结合位点。TGF-β/Smad通路的激活可以促进细胞的EMT,这已被大量研究所证实[9-11]。由此推测miR-34a-5p可能通过抑制TGF-β/Smad通路阻止RPE细胞发生EMT。本研究采用TGF-β1诱导ARPE-19细胞发生EMT,同时上调细胞内miR-34a-5p的表达,探讨miR-34a-5p对ARPE-19细胞TGF-β/Smad通路相关蛋白表达及细胞增殖、迁移和EMT的影响。
1 材料与方法
1.1 材料
1.1.1 细胞RPE细胞系ARPE-19细胞购自美国ATCC细胞库。将细胞放入含有体积分数10%胎牛血清的DMEM/F12培养基中,置于37 ℃含体积分数5%的CO2培养箱中进行培养。
1.1.2 试剂与仪器TGF-β1(南京欧凯生物科技有限公司),Transwell小室(美国Corning公司),Lipofectamine 2000转染试剂(美国Introvigen公司),MTT细胞增殖检测试剂盒、各类抗体与DMEM/F12培养基(德国默克公司),增强型电化学发光试剂盒、电泳凝胶(上海碧云天生物技术有限公司)。细胞培养箱(武汉培因公司),激光共聚焦扫描显微镜(德国Zeiss公司),酶标仪(上海赛默飞世尔公司),凝胶成像分析仪(北京六一仪器厂)。
1.2 方法
1.2.1 细胞分组与干预将ARPE-19细胞分为4组:对照组、TGF-β1组、miR-34a-5p 过表达组与复合干预组,每孔接种5×104个细胞于24孔板中,培养至细胞融合后,对照组与TGF-β1组采用Lipofectamine 2000转染试剂转染对照模拟物,miR-34a-5p 过表达组与复合干预组转染miR-34a-5p模拟物,培养24 h后采用无血清培养基饥饿培养12 h,TGF-β1组与miR-34a-5p 过表达组均添加10 mg·L-1的TGF-β1,复合干预组添加10 mg·L-1的TGF-β1与10 μmol·L-1的 TGF-β通路激活剂SRI-011381,各组细胞继续培养24 h,测定细胞增殖、迁移与EMT。
1.2.2 Ki67荧光染色检测细胞增殖情况收集各组细胞,室温下用40 g·L-1的多聚甲醛固定20 min,PBS 冲洗3次,用体积分数10% 牛血清白蛋白在37 ℃孵育30 min,并与Ki67单抗在4 ℃孵育过夜,次日与DAPI 染色液在37 ℃孵育5 min,使用激光共聚焦显微镜拍照。
1.2.3 划痕实验与Transwell实验检测细胞迁移和侵袭能力划痕实验:使用无血清培养基培养细胞,用无菌移液管尖端在各组细胞培养基上刮擦形成同宽度的伤口,用PBS洗涤细胞,于37 ℃含体积分数5% CO2的培养箱中培养24 h,显微镜下拍照。 Transwell实验:采用胰蛋白酶消化细胞,取2×104个细胞加入Transwell上室,将400 μL含体积分数10% 胎牛血清的DMEM/F12培养基加入下室,将Transwell小室置于37 ℃含体积分数5% CO2的培养箱中培养,18 h后去除膜上未迁移细胞,室温下使用40 g·L-1多聚甲醛固定15 min,然后使用1 g·L-1结晶紫染色20 min,于显微镜下随机选取5个视野对细胞进行计数。
1.2.4 免疫荧光染色测定细胞EMT相关蛋白表达情况细胞EMT标记物,包括上皮标志物钙黏蛋白E、间质化标志物α平滑肌肌动蛋白(α-SMA)与纤维连接蛋白。收集各组细胞,室温下用40 g·L-1多聚甲醛固定20 min,PBS 冲洗3次,与体积分数10%的牛血清白蛋白在37 ℃下孵育30 min,并与一抗在4 ℃下孵育过夜,次日加入二抗于37 ℃下孵育1 h,DAPI染色液孵育5 min,使用激光共聚焦显微镜拍照。
1.2.5 Western blot检测细胞TGF-β/Smad通路相关蛋白的表达采用Western blot测定TGF-β受体1、2(TGF-βR1、TGF-βR2),Smad2,Smad3和磷酸化Smad2、3(p-Smad2、p-Smad3)的表达量。首先裂解细胞释放总蛋白,取30 g蛋白样本进行凝胶电泳,转移至聚偏二氟乙烯膜,使用体积分数5%的脱脂牛奶封闭1 h,于4 ℃下与一抗孵育过夜,次日使用PBS (含体积分数0.1%的吐温-20)清洗膜后,于室温下加入辣根过氧化物酶标记的二抗孵育1 h,再次清洗后,采用增强型电化学发光试剂显影,于凝胶成像仪下拍照,以甘油醛-3-磷酸脱氢酶编码mRNA作为内参,计算相对表达量。
1.3 统计学分析采用GraphPad Prism 8.0进行数据分析与图形绘制,计量资料以均数±标准差表示,采用单因素方差分析与独立样本t检验进行组间比较。检验水准:α=0.05。
2 结果
2.1 各组ARPE-19细胞中TGF-β/Smad通路相关蛋白表达的比较采用Western blot法检测各组ARPE-19细胞内TGF-β/Smad通路相关蛋白的表达水平,结果显示:与对照组相比,TGF-β1组细胞内TGF-βR1、TGF-βR2、p-Smad2和p-Smad3的表达水平均增高(均为P<0.05,图1),表明TGF-β1能够显著激活ARPE-19细胞内的TGF-β/Smad信号通路;另外,与TGF-β1组相比,miR-34a-5p过表达组能够明显逆转TGF-β1对TGF-β/Smad信号通路的激活作用(图1)。除此之外,与miR-34a-5p过表达组相比,复合干预组细胞内TGF-β/Smad信号通路明显被激活。以上结果表明,过表达miR-34a-5p能够抑制ARPE-19细胞内TGF-β/Smad信号通路。

图1 各组ARPE-19细胞中TGF-β/Smad通路相关蛋白表达情况 *P<0.05。
2.2 各组ARPE-19细胞增殖能力的比较采用免疫荧光染色检测ARPE-19细胞内Ki67蛋白的表达水平,结果显示:对照组细胞Ki67阳性率为(8.33±3.21)%;与对照组相比,TGF-β1组细胞Ki67阳性率为(19.33±2.50)%,明显升高(P<0.05)。另外,与TGF-β1组相比,miR-34a-5p 过表达组细胞Ki67阳性率为(6.67±1.52)%,明显降低(P<0.05)。与miR-34a-5p过表达组相比,复合干预组细胞Ki67阳性率为(16.67±1.53)%,明显升高(P<0.05,图2)。以上结果表明,过表达miR-34a-5p能够通过失活TGF-β/Smad信号通路抑制ARPE-19细胞增殖能力。

图2 各组ARPE-19细胞Ki67免疫荧光染色结果(×100)
2.3 各组细胞迁移和侵袭能力的比较划痕实验和Transwell实验结果显示:与对照组相比,TGF-β1能够促进ARPE-19细胞迁移和侵袭。除此之外,过表达miR-34a-5p能够明显抑制TGF-β1组ARPE-19细胞的迁移和侵袭能力。在复合干预组内,TGF-β通路激活剂SRI-011381能够明显逆转过表达miR-34a-5p对ARPE-19细胞迁移能力的抑制作用(图3)。以上结果提示,过表达 miR-34a-5p能通过失活TGF-β/Smad信号通路抑制TGF-β1诱导的ARPE-19细胞迁移和侵袭。
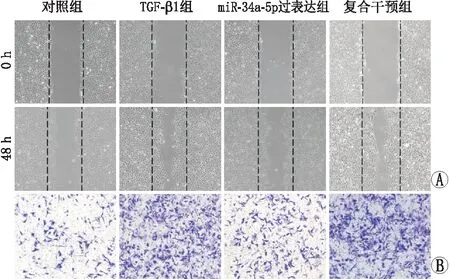
图3 各组ARPE-19细胞划痕实验和Transwell实验结果 A:各组细胞在0 h与48 h的划痕实验结果(×40);B:各组细胞Transwell实验结果(×40)。
2.4 各组细胞EMT情况的比较免疫荧光染色结果显示:与对照组相比,TGF-β1组ARPE-19细胞内α-SMA和纤维连接蛋白表达水平明显升高,并钙黏蛋白E的表达明显降低,表明TGF-β1能够促进ARPE-19细胞发生EMT。另外,与TGF-β1组相比,miR-34a-5p过表达组ARPE-19细胞EMT被明显抑制。在复合干预组内,TGF-β通路激活剂SRI-011381能够缓解过表达miR-34a-5p对ARPE-19细胞EMT的抑制作用(图4)。以上结果表明,过表达miR-34a-5p通过抑制TGF-β/Smad信号通路逆转TGF-β1诱导的EMT。

图4 各组ARPE-19细胞 EMT标志物(α-SMA、纤维连接蛋白、钙黏蛋白E)的免疫荧光染色结果(×200)
3 讨论
RPE细胞在TGF-β、表皮生长因子与血小板生长因子等刺激下过度增殖,并向小体或内皮层迁移,且不断转化为成纤维细胞,进一步形成纤维膜,而纤维膜发生收缩会造成视网膜发生褶皱、断裂,形成新的视网膜,从而造成严重的视力障碍[12-14]。因此,抑制生理或病理条件下RPE细胞的增殖、迁移与EMT,对于视网膜粘连或创伤手术后增生性玻璃体视网膜病变的预防都具有重要意义。
本研究中使用了ARPE-19细胞作为研究对象,同时采用TGF-β1诱发ARPE-19细胞的EMT行为。TGF-β1刺激上皮细胞是研究中经常使用的EMT体外模型[15]。在TGF-β1的刺激下,细胞逐渐失去上皮形态,上皮钙黏蛋白E表达减少,且分化程度降低,表现为中性细胞特性,增殖与迁移能力增强,并发展为纤维细胞,表达更多的α-SMA与纤维连接蛋白[16-18]。本研究发现,过表达 miR-34a-5p能显著抑制TGF-β1诱导的ARPE-19细胞增殖、迁移与EMT,同时过表达 miR-34a-5p抑制了ARPE-19细胞中TGF-β/Smad通路相关蛋白的表达及通路激活,而采用SRI-011381干预逆转了过表达miR-34a-5p对增殖、迁移与EMT抑制的效果。既往证据显示,TGF-β/SMAD通路在细胞EMT、迁移中均发挥着重要作用[19]。TGF-β1与TGF-βR1和TGF-βR2形成紧密复合体,激活Smad2与Smad3,进而激活下游效应分子的表达,诱发了增殖、迁移与EMT[20-21]。 由此可知,miR-34a-5p与TGF-β1/2 mRNA 3’UTR区域结合并促进其降解,导致Smad2与Smad3的磷酸化激活受阻,进而抑制了EMT。
综上所述, miR-34a-5p是通过靶向抑制TGF-β/Smad通路激活来阻止ARPE-19细胞在应激状态下的增殖、迁移与EMT,miR-34a-5p/TGF-β/Smad轴有可能成为增生性玻璃体视网膜病变的防治靶点。

