表皮生长因子受体酪氨酸激酶抑制剂用于非小细胞肺癌术后辅助治疗的心脏毒性回顾性分析
杨懿 牟云飞 任福强 黄鑫 王园
(西南交通大学附属医院 成都市第三人民医院胸外科,四川 成都 610031)
据国家癌症中心数据显示,肺癌位居恶性肿瘤死亡率之首,是威胁人类健康的第一大杀手。近年来,随着低剂量螺旋CT的普及,大大提高了早期肺癌的检出率,而靶向药物的问世,不仅改善了患者的生活质量,也使得晚期肺癌的5年生存率增加。事实上,抗肿瘤治疗在改善患者远期预后的同时,伴随之的就是其毒副反应,其中心脏毒性已成为除复发转移外的第二大死因[1]。无论是化学治疗(化疗)药物(如蒽环类和氟尿嘧啶类)、放射治疗、免疫治疗还是分子靶向治疗均可导致严重程度和临床表现各异的心血管毒性,一项回顾性分析研究中出现心功能不全患者的比例为26%[2]。Leong等[3]对亚洲患者抗肿瘤治疗相关心脏毒性的荟萃分析发现,靶向治疗提高了癌症人群生存率,但以更高的心脏毒性反应为代价。表皮生长因子受体酪氨酸激酶抑制剂(epidermal growth factor receptor tyrosine kinase inhibitors,EGFR-TKIs)为晚期非小细胞肺癌(non-small cell lung cancer,NSCLC)中最常使用的靶向药物,常见的不良反应为皮疹、消化道反应和肝肾功能损伤,心脏毒性发生率相对较低。而对于早、中期NSCLC术后,通常以化疗作为辅助治疗手段,但研究表明化疗仅能使5年生存率提高5%,因EGFR-TKIs具有高效低毒的优势,近年来,开始使用EGFR-TKIs作为NSCLC术后的辅助治疗方案,服药时间为2~3年。那么,EGFR-TKIs作为术后辅助治疗长期使用时其心脏毒性如何呢?
为评价EGFR-TKIs作为NSCLC术后辅助治疗时的心脏毒性,本次研究对2019年1月—2020年6月本院102例NSCLC术后使用EGFR-TKIs作为辅助治疗的患者的临床资料进行回顾性分析,现报道如下。
1 研究对象和方法
1.1 研究对象
纳入2019年1月—2020年6月,本院102例NSCLC术后口服EGFR-TKIs作为术后辅助治疗的患者。其中男性39例,女性63例,年龄42~81岁,按照美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)制定的体力评分标准评分0~1分;吸烟者28例,从不吸烟者74例。病理分期:ⅠB期38例,ⅡA期34例,ⅡB期15例,ⅢA期11例,ⅢB期4例。基因突变情况:61例19Del,36例L858R,2例L861Q,1例G719S,2例T790M。其中50例服用奥希替尼,16例服用吉非替尼,36例服用阿法替尼。
1.2 纳入与排除标准
1.2.1 纳入标准
(1)经手术切除,且病理组织学检查证实为NSCLC;(2)ECOG评分0~2分;(3)经基因检测证实存在EGFR基因敏感突变,符合EGFR-TKIs辅助治疗适应证;(4)用药前无心脏功能损伤;(5)未使用心脏相关副反应的药物。
1.2.2 排除标准
(1)随访失败或死亡原因不明;(2)用药前合并严重心脏、肝、肾功能障碍;(3)妊娠及哺乳期女性;(4)合并使用其他抗肿瘤药物、中药,或合并多重癌接受其他靶向药物治疗的患者;(5)因其他不良反应停药者。
1.3 心脏毒性评价标准
美国国立癌症研究所(National Cancer Institute,NCI)将其定义为“影响心脏功能的毒性”。欧洲心脏病学会(ESC)心力衰竭分会、美国临床肿瘤学会(ASCO)、欧洲临床肿瘤学会(ESMO)、美国超声心动图协会、欧洲心血管影像学会一致推荐超声心动图、心肌肌钙蛋白T(cardiac troponin T,cTnT)及脑钠肽(brain natriuretic peptide,BNP) 用来监测肿瘤治疗相关心脏毒性[4]。目前肿瘤治疗相关心脏损伤把治疗后较治疗前左室射血分数(left ventricular ejection fraction,LVEF)下降的阈值设定为10%[5]。心率(heart rate,HR)、Q-T间期、cTnT及BNP参照NCI制定的常见毒性事件标准3.0(NCI-CTCAE 3.0)对毒副反应进行评价。
1.4 研究方法
1.4.1 数据收集
收集患者服药前,服药1周、1个月、3个月、6个月和12个月时数据:包括常规心电图中HR及Q-T间期,超声心动图LVEF值,检验学指标cTnT和 BNP。常规心电图检查仪器为北京谷山丰十二导联心电图机,患者情绪平稳5~15 min后平卧位采集;超声心动图检查设备为PHILIPIS EPIQ7C彩色多普勒超声诊断仪,探头型号S5-1,系统自动计算LVEF;检验学指标cTnT和BNP采用罗氏全自动电化学发光分析仪及雅培试剂盒,电化学发光法进行测定。
1.4.2 治疗方案
手术后第4周开始每日口服EGFR-TKIs类药物:吉非替尼(阿斯利康公司)250 mg/d,阿法替尼(勃林格殷格翰公司)30或40 mg/d,奥希替尼(阿斯利康公司)80 mg/d;服用剂量及频次均严格按照相应药品说明书进行,治疗期间出现不良反应按照靶向药物相关不良反应对症处理。
1.5 统计学处理
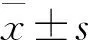
2 结果
2.1 HR、Q-T间期、LVEF、cTnT和BNP变化
102例患者在服药前,服药1周、1个月、3个月、6个月和12个月的常规心电图所记录的HR在各时间节点变化不大,差异无统计学意义(P>0.05);Q-T间期改变与HR变化一致,组间比较差异无统计学意义(P>0.05)。102例患者中,LVEF下降>10%的有3例(2.94%),但总人群在各时间节点比较差异无统计学意义(P>0.05)。检验学指标cTnT和BNP常用来反映心肌急性损伤,102例患者中,有2例(1.96%)出现cTnT和BNP水平异常升高,但在总人群中,无论是cTnT还是BNP各时间节点上比较差异均无统计学意义(P>0.05)。见表1。
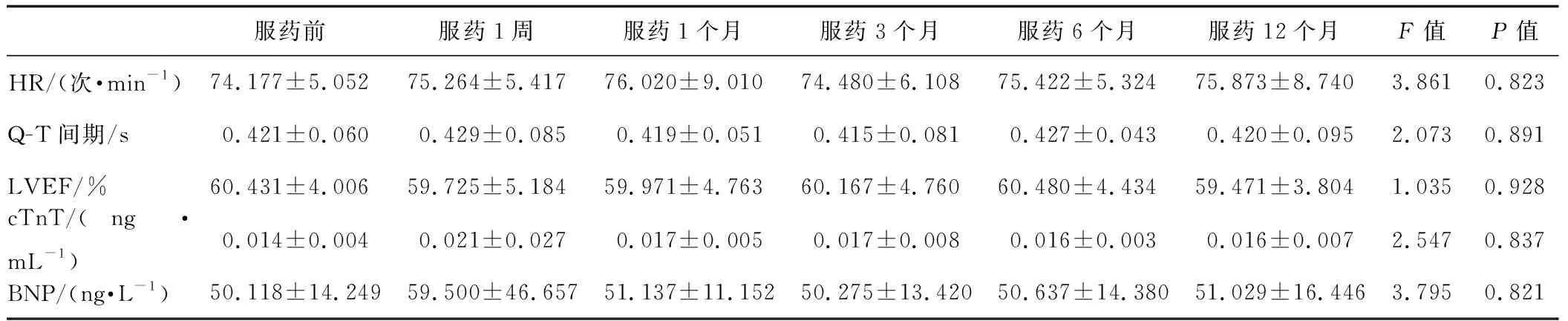
表1 102例患者在各时间点HR、Q-T间期、LVEF、cTnT、和BNP比较
2.2 LVEF下降>10%的患者情况
102例患者中,有3例出现不同程度LVFF值下降,且下降程度>10%,并伴有不同程度的胸闷症状,其中1例发生在服药1周时,另外2例发生在服药1个月时,经停药1周后症状缓解,LVEF值恢复正常后重启用药,后续监测LVEF值稳定在正常水平。3例患者中,有2例合并高脂血症及冠心病,1例合并高血压。见表2和图1。

表2 3例LVEF下降>10%患者一般情况及各时间点LVEF
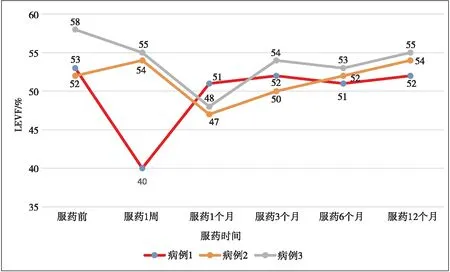
图1 3例患者LVEF变化趋势
2.3 cTnT及BNP异常升高患者情况
102例患者中,有2例出现cTnT和BNP异常升高,但无临床症状,均发生于服药1周时,经停药处理及口服辅酶Q10后,cTnT和BNP恢复正常水平并重启用药,后续监测未再明显升高。其中1例合并冠心病、高血压。见表3、图2和图3。

表3 2例cTnT和BNP水平异常升高患者一般情况及各时间点cTnT和BNP值

图2 2例患者cTnT水平变化趋势
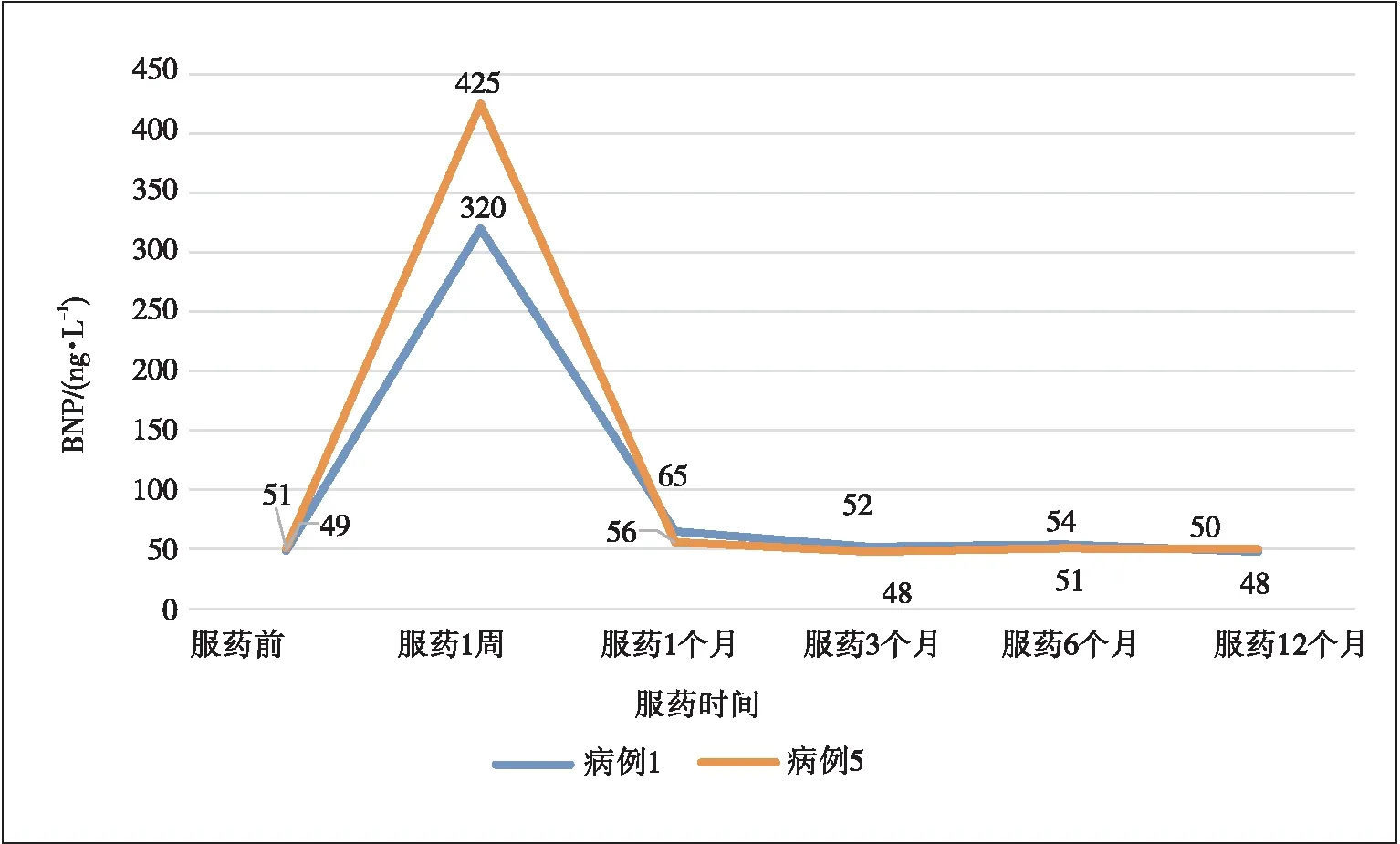
图3 2例患者BNP水平变化趋势
2.4 患者基线情况及心脏毒性的危险因素和相关性回归分析
单因素分析结果,心脏毒性在不同年龄患者存在差异(P<0.05)。将年龄作为自变量,心脏毒性为因变量,变量赋值年龄(<70岁=0,≥70岁=1),logistic回归分析结果发现年龄≥70岁是NSCLC术后EGFR-TKIs辅助治疗心脏毒性的独立危险因素(OR=8.732,P=0.002)。见表4和表5。

表4 102例患者基线情况及不同变量组间心脏毒性差异

表5 心脏毒性的危险因素回归分析
3 讨论
近年来,在NSCLC分子治疗领域,靶向治疗几乎覆盖了驱动基因阳性NSCLC患者的各个阶段,包括局部晚期和晚期治疗及术前新辅助治疗和术后辅助治疗,靶向治疗在各个阶段都发挥着至关重要的作用。EGFR是酪氨酸激酶受体ErbB家族的成员,自发现抗 EGFR治疗癌症以来,多种EGFR-TKIs被合成并被批准用于临床治疗,EGFR-TKIs目前已有四代药物,其中以第一代的吉非替尼,第二代阿法替尼,第三代奥希替尼为代表,临床应用最多,这些药物可能引起Q-T间期延长、左心室功能不全、心肌缺血或梗死等心脏毒性。研究[6-7]显示EGFR-TKIs可引起可逆或不可逆的心脏功能受损,在治疗过程中可导致3%~15%的左心功能下降以及1%~10%的症状性心力衰竭。在FLAURA 和AURA3研究[8]中分别有8例(3.1%)和14例(5.5%)患者接受奥希替尼治疗后LVEF下降了10%,在总人群中有35例(3.9%)患者在接受奥希替尼治疗后出现LVEF下降>10%,但大多数无症状,无需治疗或停用奥希替尼后即可好转。这与本次研究中5例(4.9%)出现心脏相关毒性的结果大致相符,由此可见,使用EGFR-TKIs作为NSCLC术后辅助用药,其心脏相关性毒性发生率较低,安全可靠。本次回顾分析发现常规心电图记录的HR变化及Q-T间期在各时间点改变并不明显,差异无统计学意义,分析认为心电图在反映靶向治疗相关性心脏毒性上的灵敏度不够[9]。在本次研究中,LVEF、cTnT以及BNP在治疗期间各时间节点并无明显统计学差异,但观察到3例患者LVEF下降>10%,2例患者cTnT和BNP水平异常升高,这提示LVEF、cTnT以及BNP可用作反映靶向药物心脏毒性的敏感指标。
EGFR-TKIs相关性心脏毒性不同于传统化疗,多与其作用靶点密切相关,但具体机制目前尚不明确。EGFR-TKIs引起心脏毒性的可能机制有:通过直接抑制心肌细胞内单磷酸腺苷活化蛋白激酶,造成线粒体能量合成障碍,引起心肌细胞损伤;同时,EGFR-TKIs介导的血管内皮生长因子抑制信号可能会抑制正常的血管生成,使血管生长速度慢于心肌生长速度,导致心肌收缩障碍和心功能衰竭[10]。初步研究表明年龄、剂量、基础心脏病史、胸部放射治疗以及与不同药物联合等因素可能与靶向治疗心血管毒性的发生有关[11]。本次回顾分析中,5例出现LVEF下降及cTnT、BNP水平异常升高的患者,均为高龄患者,不同心脏毒性患者的年龄存在差异(P<0.05);多因素logistic回归分析提示年龄≥70岁是NSCLC术后EGFR-TKIs辅助治疗心脏毒性的独立危险因素,因此对高龄患者,使用EGFR-TKIs时应密切监测相关指标变化。
ADAURA研究[12]已证实,对于EGFR阳性突变的患者NSCLC术后使用EGFR-TKIs可获得较好的无病生存期,同时显著降低术后复发风险,因此对于NSCLC术后,EGFR基因突变阳性的患者,推荐使用EGFR-TKIs作为术后辅助治疗。不同于化疗使用时间短,EGFR-TKIs需要长期服药,目前推荐治疗时间为3年,因此不可忽视其长期使用所带来的心脏毒性,本次回顾分析中102例患者仅追溯靶向治疗12个月内的数据,随着时间延长,心脏毒性反应发生率是否增加目前尚未可知,仍值得进一步深入探讨。综上,结合相关研究[13]及本次回顾分析结果提示:EGFR-TKIs作为NSCLC术后辅助治疗,其心脏毒性发生率较低。HR和Q-T间期反映EGFR-TKIs相关性心脏毒性时并不灵敏,LVEF、cTnT和BNP可及时反映心脏损伤,可将LVEF、cTnT和BNP作为NSCLC术后EGFR-TKIs治疗过程中心脏毒性的监测指标,并建议在基线期及服药过程中随访监测。

