利拉鲁肽对糖尿病合并动脉粥样硬化模型中骨保护素的影响及机制研究
杨晓晓 王峰 罗善顺 石立力
(哈尔滨医科大学附属第一医院干部一病房,黑龙江 哈尔滨 150001)
最新研究显示,2021年全球20~79岁人群的糖尿病(diabetes mellitus,DM)患病率约为10.5%,预计到2045年将上升至12.2%[1],DM心血管疾病的发生也呈现增高的趋势[2],动脉粥样硬化(atherosclerosis,AS)是DM患者寿命缩短和生活质量变差的重要原因[3]。AS具有复杂的发病机制,血脂异常、血糖高、炎症和氧化应激增加导致的内皮损伤起着重要作用[4]。证据表明高血糖可以通过不同机制导致内皮功能障碍,在血糖浓度较高的情况下,醛糖还原酶等酶可以影响渗透压和内环境,对内皮细胞进行破坏[5]。炎症是2型糖尿病AS内皮损伤的关键特征,炎症分子包括肿瘤坏死因子-α、白介素-1β和白介素-6[6]已被证明可以预测心血管风险[7]。此外,一氧化氮和硫化氢等气体递质分子的作用也是导致DM合并AS内皮功能障碍的重要原因[8]。氧化应激对DM合并AS的发生发展同样有重要作用,氧自由基可以诱导血管平滑肌细胞(vascular smooth muscle cells,VSMCs)的增殖和迁移。并且加速VSMCs的凋亡,从而进一步导致斑块不稳定和破裂[9]。VSMCs的增殖、迁移[10]、凋亡[11]和钙化[12],对于AS斑块的形成至关重要。
骨保护素(osteoprotegerin,OPG)也称为肿瘤坏死因子受体超家族成员11B,由血管系统中的VSMCs和内皮细胞产生,其释放可以被促炎细胞因子(包括白介素-1β和肿瘤坏死因子-α)调节[13]。OPG在对AS的作用中扮演着一分为二的角色。部分体外和动物模型的研究表明,OPG具有抑制血管钙化的作用[14],目前越来越多的数据表明OPG参与了血管内皮细胞作用的调节和AS过程的启动[15]。动物实验发现DM合并AS显著增加骨组织和血清中的OPG水平[16]。给予大鼠注射相当于DM患者血清浓度水平重组人OPG,大鼠VSMCs的增殖率显著增加,表明OPG可能参与了AS的发病[17]。体外研究[18]表明,OPG在AS斑块中有所表达,并且这种表达与动脉VSMCs、内皮细胞和巨核细胞的共同调节有关。OPG与DM合并AS的具体关系及相关机制,目前尚无定论,有待进一步探索研究。
以利拉鲁肽(liraglutide,LIRA)为代表的胰高血糖素样肽-1受体激动剂(glucagon-like peptide-1 receptor agonists,GLP-1 RAs)以其稳定的降血糖作用、较低的低血糖风险和额外的心脏保护作用在降血糖药中占据重要地位[19]。多项研究证实LIRA具有重要的心血管保护作用[20-21],并且这种心血管保护作用是通过延缓AS的发生和发展来实现的[22],但LIRA对心血管保护作用的具体机制目前仍未完全明确。故本实验设计LIRA对DM合并AS下VSMCs中OPG的影响及相应的信号通路的研究,以探讨LIRA抗DM合并AS的可能机制。
1 研究对象与方法
1.1 VSMCs的原代培养及分组
取SD大鼠胸主动脉,体外原代培养VSMCs。具体方法如下,5~8周雄性SD大鼠,分离取出整个胸主动脉。将主动脉置于培养皿中,剪开血管,剥离血管外膜并且清洗数次,把血管剪成1 mm2的组织块,放在加入2 mL胎牛血清T25的瓶中浸泡30 min。把组织块置于含15%PBS细胞培养液的培养瓶底部,于37 ℃、5%CO2培养箱培养12 h。培养细胞至密度为90%时,PBS清洗,去上清液,加入0.25%胰酶消化细胞,并加入细胞培养液,收集细胞混合液于15 mL试管,800 r/min离心3 min。吸弃上清液,将培养板置于37 ℃、5%CO2的培养箱内培养。VSMCs生长2~3 d可传代一次。
选择P4代细胞进行后续实验。给予VSMCs不同条件干预,包括对照组(5 mmol/L葡萄糖);高糖组(HG组)(25 mmol/L葡萄糖);LIRA组(100 nmol/L LIRA);HG+LIRA组(高糖+LIRA,100 nmol/L):培养液中先加入100 nmol/L LIRA,后加入高糖;HG+胞外信号调节激酶1/2(extracellular signal-regulated kinase 1/2,ERK1/2)拮抗剂组(高糖+PD98059,50 μmol/L):培养基中先加入ERK1/2拮抗剂PD98059 50 μmol/L预处理1 h后加入高糖;HG+ERK1/2拮抗剂+LIRA组(高糖+LIRA+PD98059,50 μmol/L):培养基中先加入ERK1/2 拮抗剂PD98059 50 μmol/L预处理1 h后加入高糖及100 nmol/L LIRA;HG+GLP-1受体拮抗剂+LIRA组[高糖+Exe(9-39)+LIRA,200 nmol/L]:在细胞培养液中加入高糖及100 nmol/L LIRA前,先加入Exe(9-39) 200 nmol/L作用30 min。
1.2 动物模型的制备及分组
取7周的清洁级雄性SD大鼠120只,体重约200 g,每笼4只,用普通饲料适应性喂养7 d,随机分为四组:对照组(Control组),LIRA组,DM合并AS组(DM+AS组),DM+AS+LIRA组,每组30只,对照组及LIRA组给予普通饲料喂养,DM+AS组及DM+AS+LIRA组给予高脂饲料喂养。1个月后,DM+AS组和DM+AS+LIRA组给予链脲佐菌素(35 mg/kg,溶于预冷的0.01 mol/L、pH 4.4的柠檬酸钠缓冲液中)一次性腹腔注射,诱导DM。对照组及LIRA组大鼠给予等剂量柠檬酸钠缓冲液注射,注射后7、14 d剪尾取血测血糖,血糖>16.7 mmol/L为2型糖尿病建模成功。若血糖不达标,再次补给链脲佐菌素20 mg/kg,至造模成功。DM造模成功后,四组大鼠仍以前述饲料喂养,其中LIRA两组给予LIRA 200 μg/kg、2次/d皮下注射,直至实验结束。于DM成模后0、4个月分别处死部分大鼠,取胸主动脉内侧缘行进一步相关检测。
1.3 Western Blot法检测VSMCs及胸主动脉中的OPG蛋白表达
预先将 RIPA裂解缓冲液(细胞部分使用NP-40裂解液)(碧云天)融化,进行分装,并加入1%的苯甲基磺酰氟(碧云天)。在组织样本中加入 RIPA裂解缓冲液(NP-40裂解液),置于冰上,并制成组织匀浆液。冷冻离心机(湖南湘仪) 离心10 min。使用二辛可酸蛋白浓度测定试剂盒(碧云天)测量蛋白质浓度。在十二烷基硫酸钠缓冲液中降解蛋白质,组装电泳装置,然后使用电泳在十二烷基硫酸钠-聚丙烯酰胺电泳凝胶上分离。之后转移到聚偏二氟乙烯膜(Millipore)上。用5%脱脂奶粉制成一抗工作液,与一抗OPG (1:200)在4 ℃下过夜。随后与辣根过氧化物酶(碧云天)偶联的二抗IgG(山羊抗兔,1:5 000)(碧云天)在室温下孵育45 min。在TBS-T(含有0.05%Tween-20)缓冲系统封闭液中洗涤膜后,通过增强型ECL化学发光试剂盒(七海生物)底物化学发光。随后抗体剥脱,封闭,孵育内参抗体,孵育二抗,增强化学发光法底物发光。将胶片扫描,用凝胶图象处理系统(Gel-Pro analyzer软件)分析条带的光密度。
1.4 免疫组化法检测胸主动脉平滑肌细胞中OPG蛋白表达
将组织样品包埋切片、脱蜡,将切片架置于抗原修复液中,慢火加热10 min,自然冷却,置入PBS(双螺旋)中重复3次浸泡5 min。使用3% H2O2(国药)室温孵育15 min, PBS中浸泡5 min,此过程重复3次。使用山羊血清(Solarbio)封闭。自然冷却后与抗体OPG (1:200)在4 ℃下孵育过夜。之后,加入辣根过氧化物酶偶联的二抗IgG(山羊抗兔,1:400)继续在37 ℃下孵育1 h。将二氨基联苯胺显色试剂A和B等剂量混合。取出切片,滴加100 μL显色剂,于颜色变深时迅速置于水中以终止反应。将切片浸没于苏木素(Solarbio)中3 min,流水缓慢冲洗2 min。取出切片架,浸入1%盐酸乙醇中3 s,在流水中反蓝20 min。脱水、透明、封片,镜检。
1.5 统计学分析
所有实验均重复3次,所有数据以均数±标准差方式表达。所有数据的处理使用SPSS 26.0进行。P<0.05被认为具有统计学意义。
2 实验结果
2.1 LIRA通过ERK1/2及GLP-1受体信号通路抑制高糖状态下VSMCs中OPG的表达
通过Western Blot检测VSMCs中OPG的表达。与对照组比较,HG组OPG表达显著增加(HG vs Control,*P<0.01);高糖的基础上,给予LIRA干预后,OPG的表达降低(HG+LIRA vs HG,#P<0.01);在高糖基础上,给予ERK1/2拮抗剂(PD98059),OPG表达水平下降(HG+PD98059 vs HG,#P<0.01)。在HG+LIRA的基础上,给予ERK1/2拮抗剂(PD98059),OPG的表达相较于HG+LIRA组进一步下降(HG+LIRA+PD98059 vs HG+LIRA,+P<0.01);而在HG+LIRA基础上,给予GLP-1受体拮抗剂[Exe(9-39)],可抑制LIRA对高糖状态下VSMCs中OPG的作用(HG+ Exe(9-39)+LIRA vs HG+LIRA,+P<0.01),见图1。表明LIRA抑制高糖状态下VSMCs中OPG的表达,并且这种作用与ERK1/2信号通路以及GLP-1受体信号通路密切相关。
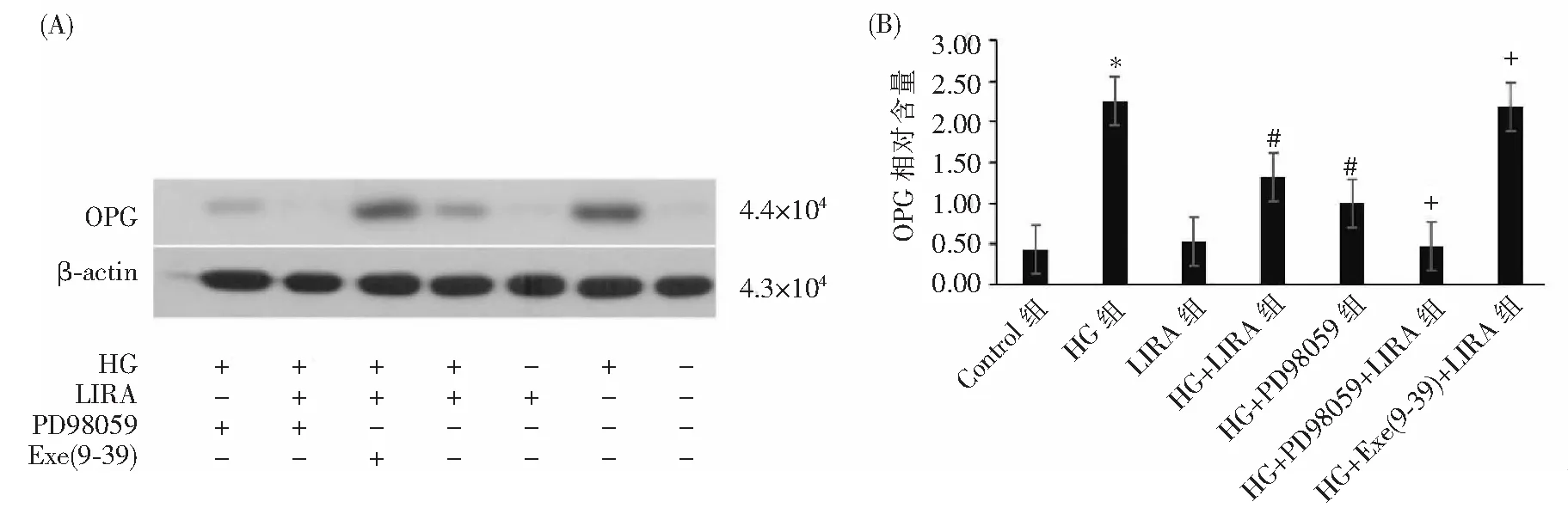
注:(A)采用 Western Blot法检测不同条件干预后VSMCs中OPG的表达水平;“+”表示该组别使用左侧干预条件,“-”表示该组别未使用左侧干预条件;(B)不同条件干预后VSMCs中OPG蛋白灰度分析。图1 采用 Western Blot法不同条件干预后VSMCs中OPG的表达水平分析
2.2 LIRA抑制DM合并AS模型中OPG的表达
通过Western Blot进行OPG表达水平的检测。DM成模0个月时,各组OPG表达均无差异。4个月时,与对照组比较,DM+AS组胸主动脉OPG表达显著升高(DM+AS vs Control,*P<0.05)。与DM+AS组比较,DM+AS+LIRA组胸主动脉OPG表达降低(DM+AS+LIRA vs DM+AS,#P<0.05)。此外,在DM+AS组,与0个月比较,4个月时胸主动脉OPG表达水平升高(DM+AS-4 vs DM+AS-0,+P<0.05),见图2。通过免疫组化进行OPG表达水平的检测。结果显示,DM成模4个月时,与对照组比较,DM+AS组胸主动脉OPG表达显著升高(DM+AS vs Control,*P<0.01)。与DM+AS组比较,DM+AS+LIRA组,胸主动脉OPG表达降低(DM+AS+LIRA vs DM+AS,#P<0.01)。此外,在DM+AS组,与0个月比较,4个月时胸主动脉OPG表达水平升高(DM+AS-4 vs DM+AS-0,+P<0.01),见图3。
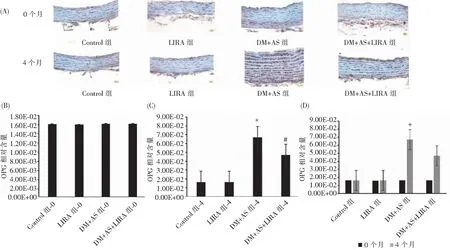
注:(A)采用免疫组化法检测0、4个月DM合并AS模型中OPG的表达水平;(B)不同条件干预后大鼠胸主动脉组织0个月OPG蛋白光密度分析;(C)不同条件干预后大鼠胸主动脉组织4个月OPG蛋白光密度分析;(D)0、4个月不同实验组大鼠胸主动脉组织中OPG蛋白光密度分析。图3 LIRA抑制DM合并AS模型中OPG的表达(免疫组化法)
3 讨论
本研究结果显示,高糖状态下以及DM合并AS模型的VSMCs中OPG表达显著增高,LIRA可以抑制DM合并AS模型中VSMCs中OPG的表达增高。
DM合并AS的发病呈逐年升高趋势[2]。高糖状态对AS的预后存在负面影响[23]。OPG参与了AS的发生和发展[24]。OPG基因敲除小鼠AS发生的概率升高,说明OPG是保护血管免受AS影响的重要因素[25]。其机制可能与RANK-RANKL-OPG信号轴调节破骨细胞形成进而抑制血管钙化的作用相关[26]。但另有研究[27]结果表明高糖可促进VSMCs中OPG表达。DM小鼠的主动脉和血液循环中OPG也显著增加[28]。人群研究[29]表明,血液中OPG的浓度与冠心病的发生及严重程度之间存在正相关,OPG是急性冠状动脉综合征心血管不良事件的发生及预后风险的指标。之前有研究表明OPG浓度升高可能与血管壁对各种干扰因素的反应有关。OPG具有增强白细胞对内皮表面的黏附,激活肾素-血管紧张素系统,促炎和促纤维化的作用,在AS形成的早期可以诱导内皮细胞功能障碍[30]。本实验结果显示,高糖状态可以促进DM合并AS的发生和发展,并且高糖可以促进OPG的表达水平升高。这与以往的研究结果类似,考虑高糖引起OPG升高的机制可能与高糖促进ERK1/2信号通路的表达有关。ERK1/2是丝裂原激活的蛋白激酶的重要成员[31],ERK1/2信号通路与AS的发生密切相关,研究证实抑制ERK1/2信号通路可减少动物模型中的AS,在细胞和动物水平上,ERK1/2抑制剂可减少高脂喂养的载脂蛋白E缺乏小鼠AS的发生[32]。并且它可能促进炎症的发生,Hankittichai等[33]和Shi等[34]的研究结果也显示ERK可以促进炎症的发生。本研究结果显示,高糖可促进OPG表达水平的升高,在高糖的基础上给予ERK1/2拮抗剂PD98059,OPG表达水平下降,这说明OPG在DM合并AS模型的VSMCs中升高可能与ERK1/2信号通路及炎症反应密切相关。
LIRA是2型糖尿病合并心血管疾病治疗的重要药物[35]。LIRA与成纤维细胞生长因子-21联合应用可以使大鼠的AS斑块面积减小,其AS斑块面积减小的原因可能与抑制血小板衍生生长因子诱导的VSMCs中蛋白激酶B和ERK的磷酸化有关[36]。有研究[37]指出GLP-1可能作用于骨细胞,从而增加OPG/RANKL的比率。分别于24、48和72 h给予大鼠100 nmol/L LIRA处理后,进行OPG表达的检测,结果显示MC3T3-E1细胞中OPG的表达增高[38]。多项研究[39-40]显示GLP-1 RAs通过抗炎机制影响AS,并且或通过调节炎症及血管重塑而减少内皮功能障碍。本实验研究结果显示,LIRA可以抑制DM合并AS模型中OPG的表达,这与之前LIRA的抗AS的研究结果相似,虽然在本研究结果中LIRA可以导致OPG表达水平下降,这与之前部分研究结果存在差异。考虑差异的原因可能与此类研究较少,研究的实验对象不同及指标检测方式差异等均有关系。以往研究结果显示,高糖可以导致炎症和氧化应激,激活ERK信号通路,从而导致AS的发生。OPG在AS斑块中有所表达,并且参与了AS的发生和发展。故本实验中LIRA对OPG的影响可能是通过其对炎症的抑制作用来实现的。后续实验中,将进行GLP-1与OPG以及炎症关联的相关研究。本实验中,给予ERK1/2拮抗剂(PD98059)及GLP-1受体拮抗剂[Exe(9-39)]后,可以影响LIRA对OPG的表达作用。并且ERK信号通路与高糖和炎症的发生密切相关,故考虑LIRA对DM合并AS及OPG的影响与ERK1/2和GLP-1受体信号通路密切相关。
4 结论
本实验通过体内外研究证实,OPG在DM合并AS的模型中水平显著增加。LIRA可以抑制高糖状态下OPG的表达。并且这种作用可能与ERK1/2信号通路以及GLP-1受体信号通路密切相关,故OPG可作为DM合并AS的预测指标,并且为研究LIRA抗AS的作用机制提供了病理生理学依据。

