黄鳍棘鲷IGF-2基因克隆及IGF-1/2在胚胎发育过程中的表达特性分析
崔淼,李钰杰,杨永春,张佳颖,许鲜姬,林李泉,林国荣,张其中,许德麟
( 1. 暨南大学 生命科学技术学院,广东 广州 510632;2. 阳西县恒生水产养殖专业合作社,广东 阳江 529825;3. 阳江市国荣水产科技有限公司,广东 阳江 529825)
1 引言
类胰岛素样生长因子(Insulin-like Growth Factors,IGFs)是一类参与脊椎动物生长、生殖和免疫等过程的调控因子,相较于胰岛素,IGFs多一个功能域D。IGFs主要由肝脏细胞表达生成,然后通过内分泌及旁分泌的方式运输到机体各个部位,介导生长激素(Growth Hormone, GH)发挥生理功能,从而促进肌肉组织的生长和肌纤维细胞的增殖,对于鱼类的生长发育具有重要作用[1]。硬骨鱼IGFs基因序列相继在虹鳟(Oncorhynchus mykiss)[2]、斑马鱼(Danio rerio)[3]、鲤鱼(Cyprinus carpio)[4]等成鱼中被克隆报道,但一直未见其在胚胎发育中的作用研究。直到Fukenstein等[5]首次在大西洋鲷(Sparus aurata)卵子和受精卵发育不同时期检测到了IGF-1基因,才明确IGF-1基因参与了调控胚胎的发育过程;此后,White等[6]发现敲除斑马鱼的IGF-2基因会导致胚胎死亡。由此可见,IGFs基因在硬骨鱼类胚胎发育的调控过程中发挥着至关重要的作用。
黄鳍棘鲷(Acanthopagrus latus)属鲈形目、鲷科、棘鲷属,为浅海暖水性底层鱼类,生活在近岸海域及河口湾,常见于我国东南沿海[7-8]。其肉质鲜美,营养价值高,深受广大消费者的喜爱,是沿海地区最有推广潜力的海水鱼类养殖品种之一。黄鳍棘鲷繁殖期为每年的9-12月,雌鱼繁殖期多次产卵[9-10]。郑运通等[11-12]、Leu和Chou[13]完成了黄鳍棘鲷的人工繁殖以及种苗培育,Li等[14]和Zhou等[15]对黄鳍棘鲷性腺发育进行了研究,为黄鳍棘鲷规模化人工养殖提供了理论基础。目前,关于黄鳍棘鲷的生长相关基因研究绝大多数限于成鱼之中[16-20],在胚胎发育中的作用和机制研究相对较少。本文拟通过对黄鳍棘鲷早期胚胎发育全过程的跟踪观察,掌握其胚胎发育阶段不同组织器官的特征变化规律,在克隆获得黄鳍棘鲷IGF-2基因的基础上,了解IGF-1和IGF-2基因在黄鳍棘鲷胚胎中的表达特征,为研究IGF-1和IGF-2基因在黄鳍棘鲷早期发育中的生理功能提供基础资料。
2 材料与方法
2.1 实验材料
选择体长为(14±3)cm,体重为(135±30)g的成鱼,每5条作为一个混样,每个样本设3个平行,采样前先进行MS-222(40 mg/L)麻醉,然后取新鲜肝脏组织,放入经过DEPC水处理过的冻存管中,置于液氮中,于-80℃超低温冰箱中保存备用。黄鳍棘鲷海捕亲鱼来源于南海不同海域,选择体质健壮、体表光滑无伤痕、颜色鲜艳、活力大的个体,雄性个体体重大于250 g,雌性个体体重大于400 g,共286条,在广东省阳江市恒生水产养殖合作社海上网箱中进行强化培育。
采用绒毛膜促性腺激素(HCG)和促黄体素释放激素(LRH-A)混合注射入背部肌肉,雌鱼HCG注射量为600 IU/kg,LRH-A注射量为10 μg/kg;雄鱼注射量为雌鱼的一半,分两次注射,间隔24 h。将5条雌性亲鱼与10条雄性亲鱼一同放入产卵池中,在水温为(27±1)℃,盐度为28,pH为8.0的情况下,采用避光、流水刺激的方法使亲鱼正常产卵受精。在孵化池的出水口收集受精卵,随机取样放入显微镜下观察,确保受精卵发育同步性,然后将受精卵转移至500 L的孵化桶中,在水温为(26.5±0.5)℃,盐度为28,pH为8.0的情况下,微充气孵化。用烧杯于孵化桶中捞取适量受精卵,用吸管吸取胚胎(不少于30粒),在Nikon E100生物显微镜下连续观察并拍照记录。参考刘鉴毅等[21]的方法,当视野中50%以上个体发育至某阶段时,所用时间即为发育到该阶段的时间。当胚胎到达一个发育阶段后,对该阶段胚胎进行取样,每次取样分为3个平行,每个平行不少于50粒,用DEPC水冲洗干净,放入液氮中冷冻保存。
2.2 实验方法
2.2.1 引物设计与合成
从NCBI数据库中获取到斜带石斑鱼(Epinephelus coioides,AY552787.1)、金钱鱼(Scatophagus argus,XM_046394064.1)、罗非鱼(Oreochromis niloticus,XM_025908435.1)、大 西 洋 鲷(S. aurata,EF563836.1)的IGF-2基因mRNA序列,利用BioEdit软件进行序列比对,获得IGF-2基因的保守区域,运用Primer Premier 5 设计保守区域引物,对黄鳍棘鲷IGF-2基因保守区域进行扩增测序,扩增反应体系总体积为25 μL:
10×KOD Buffer 2.5 μL,dNTPs Mixture(2 mmol/L)2.5 μL,MgSO4(25 mmol/L)1.5 μL,上、下游引物(10 μmol/L)各0.5 μL,cDNA 0.5 μL,ddH2O 16.75 μL,KOD-Plus Neo 0.25 μL。PCR反应条件为94°C 4 min;98°C 10 s,52~64°C 30 s,68℃ 40 s,35个循环; 68°C 延伸7 min,4℃保存。以IGF-2基因保守区域序列作为基础,设计并合成用于5′RACE与3′RACE扩 增所需的 特 异性引物,引物合成均由生工生物工程(上海)股份有限公司提供。引物序列详见表1。
2.2.2 总RNA提取与第一链cDNA的合成
参照Trizol试剂盒(Invitrogen,美国)说明书,提取黄鳍棘鲷肝与各胚胎发育阶段的总RNA,按照MMLV Reverse Transcriptase试剂盒(Promega,美国)说明书,以Oligo(dT)作为引物,反转录合成第一链cDNA。同时根据SMARTer®RACE 5′/3′Kit试 剂 盒(TaKaRa,日本)说明书,以黄鳍棘鲷肝的RNA作为模板合成5′和3′ RACE-ready cDNA。
2.2.3 黄鳍棘鲷IGF-2基因克隆
以反转录获得的第一链cDNA作为模板,用引物IGF-2-F与IGF-2-R进行梯度PCR。扩增产物经1.2%琼脂糖凝胶检测后,按照DNA凝胶回收试剂盒(Omega,美国)说明书,将PCR产物进行纯化,连接到pMD™18-T(TaKaRa,日本)质粒上,转化进DH5α中,挑取单克隆菌落,经菌液PCR检测后,筛选出阳性菌,送至生工生物工程(上海)股份有限公司测序,扩增反应体系总体积为25 μL:10×Buffer(含2.5 mmol/L MgCl2)2.5 μL,dNTPs Mixture(2.5 mmol/L)2 μL,M13F-47(10 μmol/L)0.5 μL,M13R-48(10 μmol/L)0.5 μL,菌液1 μL,ddH2O 18.375 μL,rTaq 0.125μL。PCR 反应条件为94°C 3 min;94°C 30 s,55°C 30 s,72℃ 90 s,32个循环;72°C 延伸10 min,4℃保存。以5′RACE-ready cDNA和3′RACE-ready cDNA作为模板,采用特异性引物与通用引物进行巢式PCR扩增,扩增反应体系总体积为25 μL:10×KOD Buffer 2.5μL,dNTPs Mixture(2 mmol/L)2.5 μL,MgSO4(25 mmol/L)1.5 μL,上、下 游 引 物(10 μmol/L)各0.5 μL,5′/3′RACE-ready cDNA 0.5 μL,ddH2O 16.75 μL,KOD-Plus Neo 0.25 μL。PCR 反应条件为94°C 4 min;98°C 10 s,50~64°C 30 s,68℃ 60 s,35个循环;68°C延伸7 min,4℃保存。扩增产物操作同上。运用DNAMAN软件将测序结果拼接,得到黄鳍棘鲷IGF-2基因cDNA序列。
2.2.4 生物信息学分析
运用NCBI数据库在线分析黄鳍棘鲷IGF-2基因的开放阅读框(Open Reading Frame,ORF),并将其翻译成相应的氨基酸序列,利用NCBI的Blast功能对IGF-2基因核苷酸与氨基酸进行序列相似性比对和分析,利用Expasy(http://web.expasy.org/)在线分析IGF-2基因的分子量、分子式、等电点等生物信息,利用MEGA X软件进行氨基酸序列比对,并基于邻接(Neighbour-joining,NJ)法构建IGF-2进化树。用于IGF-2氨基酸序列分析、同源性比对和构建系统进化树的基因序列均从NCBI数据库下载。
2.2.5 黄鳍棘鲷胚胎发育阶段IGF-1和IGF-2基因表达
根据已克隆得到的IGF-2基因以及前期报道的IGF-1基因序列[18],设计用于qPCR的特异性引物。使用Bio-Rad CFX96TMReal Time System 平台,参照SYBR®Green Real Time PCR MIX试剂盒(TOYOBO,日本)说明书,采用20 μL体系(SYBR®Green Real Time PCR MIX 10 μL,cDNA 1 μL,上游引物0.4 μL,下游引物0.4 μL,DEPC水8.2 μL),以实时qPCR法对IGF-1和IGF-2基因在黄鳍棘鲷胚胎发育各阶段的表达量进行测定。反应程序为预变性94℃ 3 min;94℃15 s, 60℃ 15 s,72℃ 20 s,共40个循环。以β-actin作为内参基因[20],校正各基因的反转录效率,采用2-ΔΔct方法计算IGF-1和IGF-2在各胚胎发育时期中的相对表达量。
2.2.6 数据处理
采用SPSS19.0通过单因素方差分析和Duncan多重比较进行均值计算和显著性分析,p<0.05表示差异显著,结果采用平均值±标准误表示,设置3个平行实验。
3 结果分析
3.1 黄鳍棘鲷IGF-2基因克隆及序列分析
利用保守区域特异性引物扩增获得的产物经纯化、连接、转化等处理后,送至生工生物工程(上海)股份有限公司测序。将测序结果在NCBI数据库中比对,确定为黄鳍棘鲷IGF-2基因保守区片段。根据此序列,进行3′RACE和5′RACE PCR扩增反应,得到IGF-2基因部分cDNA片段,经过拼接,得到黄鳍棘鲷IGF-2基因cDNA全长序列(图1)。黄鳍棘鲷IGF-2基 因cDNA包括148 bp的5′端 非 编 码 区(5′UTR),940 bp的3′端非编码区(3′UTR),以及648 bp的ORF,共编码215个氨基酸残基。对IGF-2基因编码的蛋白质进行生物信息学分析,结果显示该蛋白质中精氨酸(Arg)含量最高,为10.7%,其次为亮氨酸(Leu),含量为10.2%,色氨酸(Trp)含量最少,仅为0.5%。预测蛋白分子量为24.67 kDa, 理论等电点为10,不稳定指数为68.58,脂肪指数为79.81,蛋白质前52个氨基酸为信号肽,IGF-2功能区具有58个氨基酸,后105个氨基酸为结构域E。

图1 黄鳍棘鲷IGF-2基因全长序列及其编码的氨基酸序列Fig. 1 Complete sequence of IGF-2gene cDNA and deduced amino acid sequence from Acanthopagrus latus
3.2 黄鳍棘鲷IGF-2基因氨基酸序列的同源性和系统发育分析
黄鳍棘鲷IGF-2基因氨基酸序列经过Blast检索发现,IGF-2基因在鱼类中高度保守(图2),与同为鲈形目的大西洋鲷、三长棘赤鲷(Pagrus auriga)高度相似,一致性高达95%以上,与牙鲆(Paralichthys olivaceus)、大菱鲆(Scophthalmus maximus)一 致 性 在80%以上,与斑马鱼的一致性为78.2%,但与其他脊椎动物一致性较低,与野猪(Sus scrofa)的一致性为42.2%,与人(Homo sapiens)和猕猴(Macaca mulatta)的一致性仅为36.7%和35.8%。将黄鳍棘鲷与Gene-Bank中已发表的其他物种的IGF-2基因氨基酸序列进行比对,构建系统进化树(图3),基于系统进化树可知,黄鳍棘鲷与其他硬骨鱼类聚为一簇,两栖类则和哺乳类聚为一簇。其中,黄鳍棘鲷先与大西洋鲷、沙重牙鲷(Diplodus sargus)聚为一支,三者在遗传距离上最近,其次与三长棘赤鲷、牙鲆和大菱鲆等聚为一簇,与哺乳类动物和两栖动物遗传遗传距离较远,这与氨基酸序列同源性比较结果一致。
3.3 黄鳍棘鲷胚胎发育观察
黄鳍棘鲷受精卵在水温为(26.5±0.5)℃,盐度为28,pH为8.0的条件下,完成整个胚胎发育过程共用时25.5 h。在水体不充气的状态下,黄鳍棘鲷受精卵在不同盐度的海水中分布不同,当盐度大于32时,受精卵漂浮于水面;当盐度小于24时,受精卵沉在水底;当盐度为26~30时,受精卵悬浮于水中。黄鳍棘鲷受精卵卵裂方式为盘状卵裂,卵裂仅在胚盘上进行,卵黄不参与分裂。黄鳍棘鲷卵受精后,卵周隙变小,受精卵卵径为(0.900±0.050)mm,内有一个直径为(0.250±0.020)mm的油球。受精后,在动物极可观察到一扁平帽状结构,称为胚盘,卵黄向植物极集中,原生质逐渐向动物极转移,胚盘开始隆起,大约40 min后在胚盘顶部中央产生一分裂沟,即第一次细胞分裂,最终形成两个均等的细胞(图4a)。55 min后开始第二次细胞分裂,在细胞顶部中央出现与第一次细胞分裂相垂直的分裂沟,形成4个大小相似的细胞(图4b),1 h 10 min后,在第一次分裂沟两边,各出现一条与之相平行的分裂沟,形成8个细胞(图4c)。然后继续分裂,依次进入16细胞期(图4d)、32细胞期(图4e)、64细胞期(图4f)和多细胞期(图4g)。随着细胞分裂次数不断增多,细胞多而呈不规则排列,3 h 20 min后进入桑葚胚期(图4h)。细胞继续分裂,细胞间更细密,细胞界限模糊不清,4 h后在胚盘处细胞堆积,在突出于卵黄之上形成囊胚层,进入高囊胚期(图4i)。细胞向四周扩散,5 h 25 min后,囊胚层变低,称之为低囊胚期(图4j)。囊胚层继续向下包,7 h 10 min 进入原肠前期(图4k);胚盘下包至卵黄1/2处,形成胚盾,8 h 45 min 后进入原肠中期(图4l);10 h 5 min 后囊胚层下包至卵黄3/4处,胚层包裹植物极形成胚孔,胚盾继续延伸,胚体逐步形成,进入原肠晚期(图4m)。11 h 10 min后,胚层继续下包,最终完全将胚孔封闭(图4n);11 h 40 min后,胚体头部开始形成视囊(图4o);受精12 h 20 min后,脑开始出现分化,身体中部出现肌节(图4p);受精后13 h 40 min后,在眼囊中间处出现一对凹陷,开始形成视杯,肌节数目增多(图4q);受精后15 h,肌节进一步增多,胚体末端黑色素开始累积,在腹面开始突出形成尾芽,并开始从卵黄囊上分离(图4r);16 h 50 min 后,尾从卵黄囊上分离出来,胚体头部变大,视囊中出现圆形晶体,心脏原基开始出现(图4s);受精19 h 40 min后,心脏原基进一步发育,头部结构变得复杂,胚体开始间歇性颤动,进入肌肉效应期(图4t);受精21 h后,胚体颤动频率增加,心脏开始搏动,起初频率微弱,以后逐渐加快(图4u);23 h 10 min后,胚体长度几乎可以包裹卵黄囊一周,胚体扭动有力,在显微镜下可见连续扭动(图4v);胚体发育25 h 30 min后,胚体头部破膜而出,尾部摆动频繁,仔鱼开始褪去卵膜孵出(图4w)。

图2 黄鳍棘鲷IGF-2基因氨基酸序列多重序列比对Fig. 2 Amino acid sequence multiple alignment of IGF-2gene fromAcanthopagrus latus
3.4 IGF-1和IGF-2基因在黄鳍棘鲷胚胎发育过程中的表达情况
通过荧光定量PCR检测黄鳍棘鲷IGF-1和IGF-2基因在胚胎发育不同阶段(卵裂期、囊胚期、原肠期、胚孔封闭期、晶体期、肌肉效应期、心跳期、出膜前、出膜后3 d)的表达情况。结果显示,黄鳍棘鲷IGF-1和IGF-2基因mRNA在各发育时期中均有表达(图5),黄鳍棘鲷IGF-1基因呈现先上升后下降的表达趋势,在肌肉效应期表达量最高,在囊胚期、原肠期、胚孔封闭期、晶体期以及出膜后3 d表达量次之,卵裂期、心跳期、出膜前表达量较低;IGF-2基因呈现先上升后下降再上升的表达趋势,在原肠期、肌肉效应期以及出膜后3 d的表达量较高,在胚孔封闭期和晶体期表达量次之,而在卵裂期、囊胚期、心跳期以及出膜前表达量较低。
4 讨论
类胰岛素样生长因子是位于生物GH-IGFs生长轴下游的关键因子,介导生长激素发挥生物学功能[22],类胰岛素样生长因子主要由IGF-1和IGF-2组成。IGF-2也被称为生长调节素A,是胰岛素家族的成员之一,具有促进细胞有丝分裂和分化的作用,同时也与个体脂肪沉淀、生长速度等生产性能关系密切[23]。本研究采用RACE技术,首次克隆获得黄鳍棘鲷IGF-2基因的全长序列,其全长为1 736 bp,共编码215个氨基酸,推导的氨基酸序列与其他硬骨鱼类相似性较高,而与两栖类、哺乳类相似性较低,系统进化关系与物种传统分类学相一致,这说明IGF-2在硬骨鱼类中进化保守。IGF-2蛋白与IGF-1蛋白[18]一级结构基本相同,均由信号肽、功能域和结构域E组成。IGF-2功能域具有53个氨基酸,由B、C、A、D 4个结构域组成[24],B、A结构域分别与胰岛素B链和A链同源[25],C区与胰岛素连接肽类似,这说明IGF-1、IGF-2和胰岛素是由同一个祖蛋白进化来的[26]。IGF-2含有3个由半胱氨酸形成的二硫键,使得IGF-2蛋白质的三级结构得以维持。但是,目前相比于人、鼠等哺乳动物,国内外对硬骨鱼类IGF-2基因的研究较少,后续仍需对鱼类IGF-2基因功能及调节机制进行进一步研究。
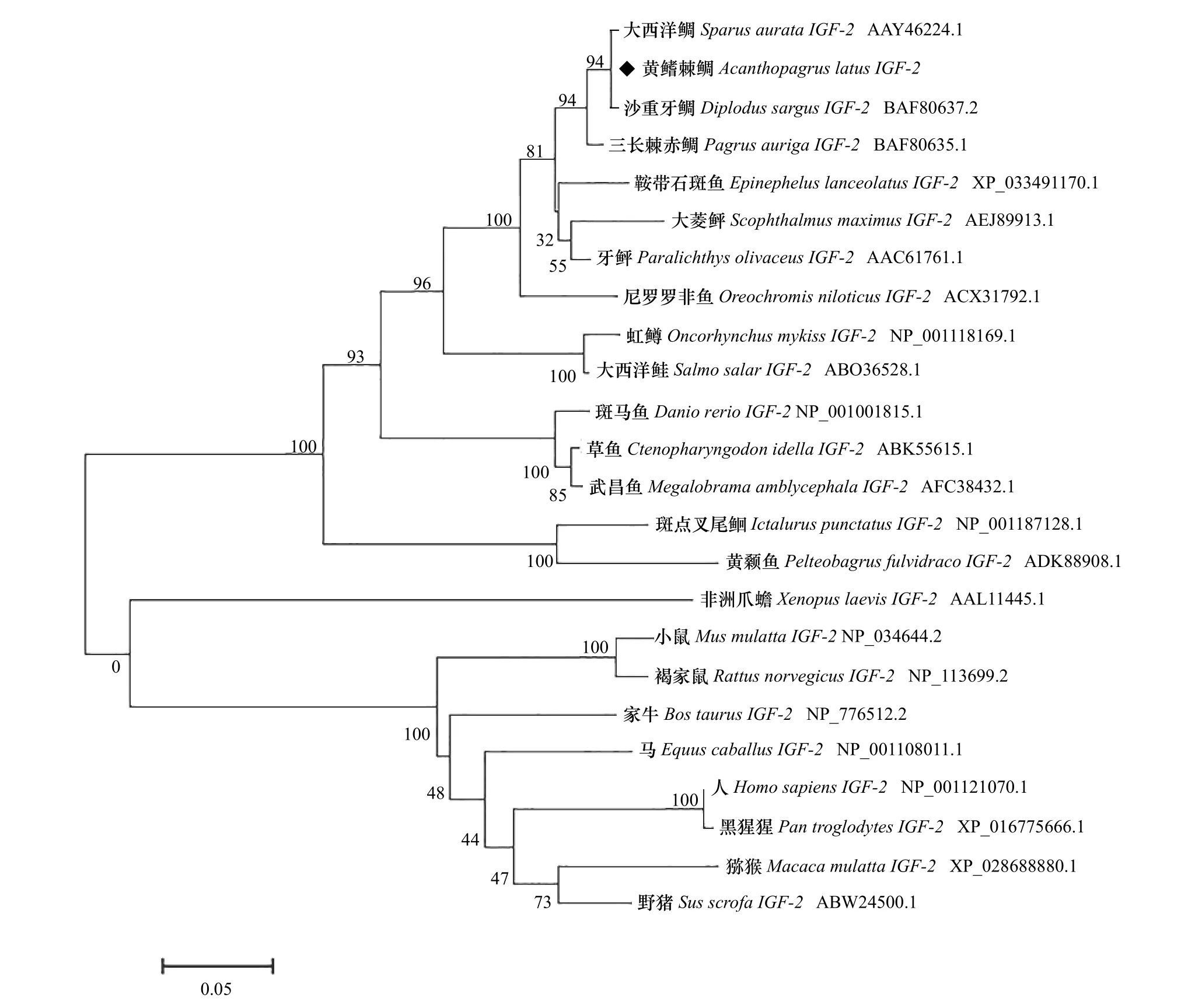
图3 黄鳍棘鲷和其他物种IGF-2基因氨基酸序列的系统进化树分析Fig. 3 Phylogenetic analysis of IGF-2gene amino acid sequence from Acanthopagrus latusand other species
本研究中观察并记录了黄鳍棘鲷胚胎发育23个时期的形态特征变化。黄鳍棘鲷受精卵具有典型硬骨鱼类端黄卵的特性,呈圆球形,具有一个油球,其内含中性脂肪,使受精卵不仅能储藏养料,也能使卵子漂浮于水中。受精卵在盐度28的海水中为悬浮性卵,卵裂方式为盘状卵裂。胚胎发育主要经历5个时期,分别为卵裂期、囊胚期、原肠胚期、神经胚期和器官形成期[27]。鱼卵的直径因物种不同而存在差异,鱼卵直径显著影响其发育速度,一般鱼卵直径越大,发育速度越慢。将黄鳍棘鲷与几种鲈形目暖水性海水鱼类胚胎发育特征进行比较[21,28-33](表2),发现黄鳍棘鲷受精卵卵径比军曹鱼(Rachycentron canadum)卵径小,与3种鲷科鱼类差距不大,比其余3种鱼卵径大,这与物种的种间差异具有一定的关系。相较于3种鲷科鱼类,黄鳍棘鲷孵化时间短,我们猜想这与孵化温度有一定关系[34]。本研究中黄鳍棘鲷在水温(26.5±0.5)℃的情况下,经25.5 h孵化为仔鱼,这与郑运通等[12]观察到黄鳍棘鲷受精卵在(21.6±0.5)℃下,30 h 35 min后孵化为仔鱼情况有所差异,该结果也验证了我们所猜想的胚胎孵化与温度具有一定的关系。

图4 黄鳍棘鲷的胚胎发育Fig. 4 Embryonic development ofAcanthopagrus latus
胚胎发育涉及到各种信号通路的调节,是个体发育中的重要环节,本研究利用RT-PCR检测了IGF-1和IGF-2基因在胚胎发育各个时期的表达。结果显示:IGF-1和IGF-2基因在黄鳍棘鲷的胚胎发育各个时期均有表达,IGF-1基因在肌肉效应期高表达;相较于IGF-1基因,IGF-2基因在原肠期、肌肉效应期以及出膜后3 d均有高表达。金钱鱼IGF-1基因在卵裂期到出膜期的各个时期中均有表达[35],大西洋鲷[5,36]也有着类似现象。通过向斑马鱼胚胎显微注射IGF-1基因mRNA,相较于对照组,实验组斑马鱼躯干生长发育速度加快[1]。我们推测IGF-1基因可能在鱼类胚胎发育过程中广泛表达,促进肌纤维细胞的增殖。黄鳍棘鲷IGF-2基因直到原肠期才开始高表达,虹鳟卵裂期不表达[37],斜带石斑鱼在桑葚期开始表达,随后表达量持续升高[22],这说明IGF-2基因在不同鱼类早期胚胎发育过程中的表达方式不同。White等[6]利用吗啉反义寡核苷酸抑制斑马鱼胚胎发育期间IGF-2b基因的表达,发现IGF-2b基因缺失导致斑马鱼背侧中线发育缺陷,同时也导致了腹侧前脑发育缺陷,最终胚胎死亡,这说明IGF-2基因可能参与了脑部发育与肌细胞的增殖。IGF-2基因在原肠期高表达,这与金钱鱼IGF-2基因表达相似[35],我们认为IGF-2基因可能在中胚层的形成中发挥作用。IGF-1和IGF-2基因在肌肉效应期都出现高表达的现象,表示二者在胚胎发育过程中对肌细胞的增殖均发挥作用。IGF-1和IGF-2基因在胚胎发育过程中发挥着重要作用,但其在胚胎发育过程中是否具有协同作用及其调控的下游信号通路还需进一步研究。

图5 黄鳍棘鲷胚胎发育过程中IGF-1/IGF-2基因mRNA的相对表达量Fig. 5 The relative expression of IGF-1/IGF-2genes mRNA in different embryo development stages ofAcanthopagrus latus
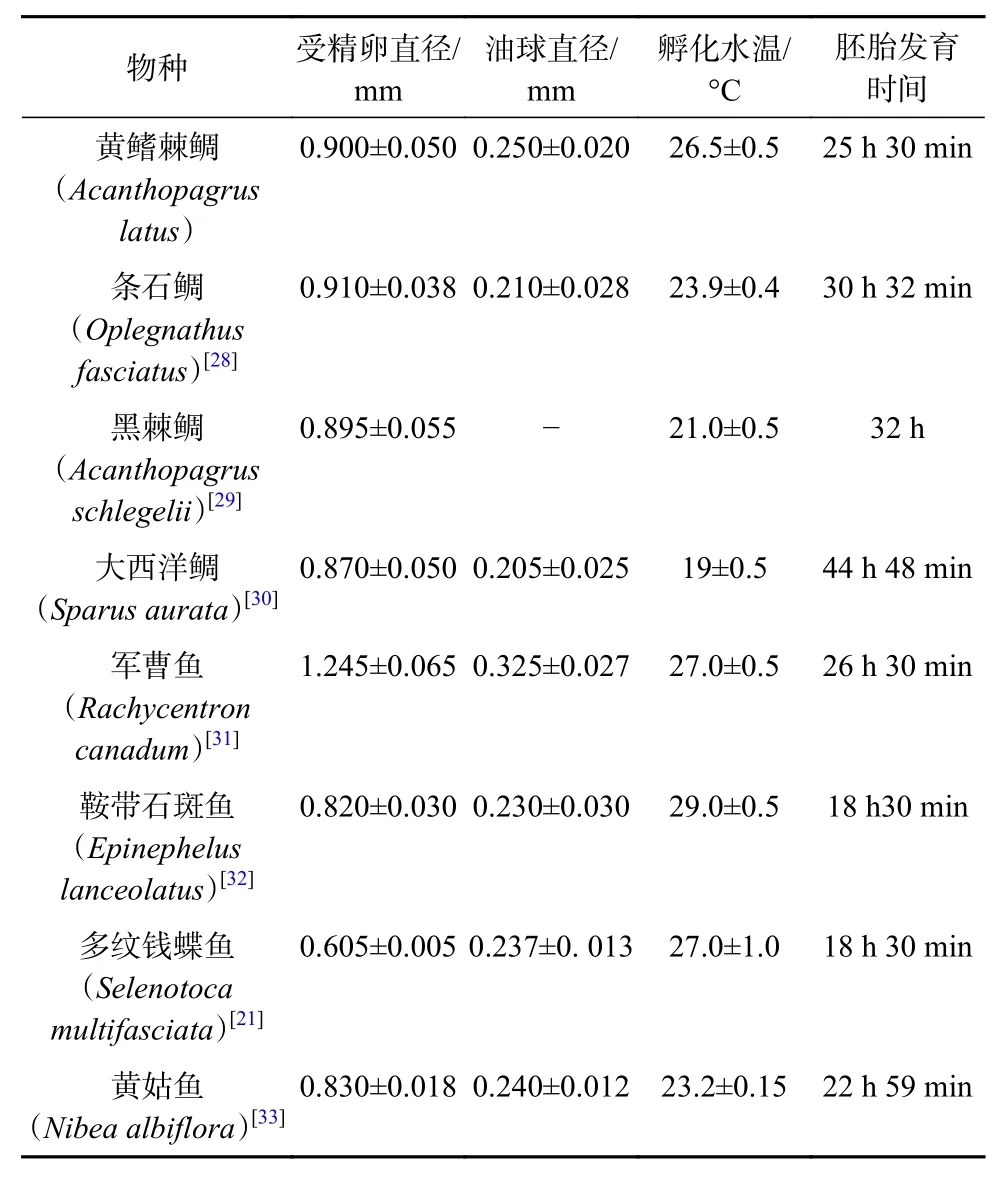
表2 海水鱼类胚胎发育特征的比较Table 2 Comparison of embryonic developmental characteristics of marine fish

