系统免疫炎症指数及凝血指标联合SOFA评分在尿源性脓毒症早期病情评估中的意义*
龙启成,温汉春,叶永康,廖品琥
(广西医科大学第一附属医院 1.重症医学科;2.急诊科,南宁 530021)
尿源性脓毒症是指由宿主对源自泌尿道和(或)男性生殖器官的感染反应失调引起的危及生命的器官功能障碍[1],属于脓毒症的一个亚类。在全球范围内,尿源性脓毒症占脓毒症总数的9%~31%,占比主要取决于地理位置[2]。目前,对尿源性脓毒症的病情评估尚缺少明确的评价标准,多参照脓毒症序贯器官衰竭(sequential organ failure assessment,SOFA)评分或降钙素原水平[3],但目前国内降钙素原检测费用偏高,且不在医保目录范围。同时,单一的指标往往难以充分反映病情变化。因此,需要寻找更高效的病情评估方法。临床发现,尿源性脓毒症患者病情愈重血常规和凝血功能异常现象越明显。系统免疫炎症指数(systemic immune-inflammation index,SII),即SII=血小板计数(PLT)×中性粒细胞计数(NEU)/淋巴细胞计数(LYM),是一种新的系统免疫炎症预后指标[4],与许多肿瘤及包括胰腺炎和新型冠状病毒肺炎在内的炎症性疾病相关[4-6]。SII、凝血指标联合SOFA 评分在尿源性脓毒症早期病情评估方面的文献鲜见报道。本研究回顾分析尿源性脓毒症患者的SII、凝血指标联合SOFA评分在早期病情评估中的意义。
1 对象与方法
1.1 研究对象 回顾分析2017年1月至2021年12月中国某三甲医院重症医学科收治的成人尿源性脓毒症患者85 例。参照2021 年版“拯救脓毒症运动:国际脓毒症和脓毒性休克管理指南”以及2018年欧洲泌尿外科学会“尿源性脓毒症管理指南”关于脓毒症和尿源性脓毒症诊断标准[1,7],病例纳入标准:年龄>18 岁;临床符合泌尿系感染的诊断且存在器官功能障碍表现、SOFA评分≥2分。排除标准:年龄<18岁,其他原因或部位导致的急性系统性感染,传染病活动期如结核、肝炎等;恶性肿瘤放化疗后;使用免疫抑制剂;严重血液系统疾病者;慢性心、肺、肝功能不全者;结缔组织病。9 例患者因资料不完整,不纳入回顾性研究。纳入研究的76例尿源性脓毒症患者,其中男38 例,女38 例,年龄40~66 岁,平均(53.55±13.28)岁,65 例为上尿路结石引起的泌尿系梗阻,3例为泌尿系肿瘤,非梗阻性尿路感染及肾周脓肿各2 例,肾盂肾炎、泌尿系结核、右输尿管膀胱成型术后、输尿管狭窄各1 例。病例分组:根据是否发生脓毒性休克将所有病例分为脓毒性休克组(n=39)和非脓毒性休克组(n=37)。
1.2 方法 采集尿源性脓毒症患者的一般资料,包括姓名、性别、年龄、并发症以及转归等;记录患者转入ICU 24 h 内的生命体征、动脉血气分析、血常规、生化和凝血功能指标[含凝血酶原时间(PT)、活化部分凝血酶时间(APTT)、国际标准化比率(INR)、纤维蛋白原(FIB)、凝血酶时间(TT)和D-二聚体(DD)],以及是否使用血管活性药物等,并根据上述资料进行SOFA评分。
1.3 统计学方法 采用SPSS 24.0统计软件进行统计学分析。正态分布的计量资料以均数±标准差()表示,两组间比较采用t检验。非正态分布的计量资料以中位数(四分位数)[M(P25~P75)]表示,两组间比较采用Mann-WhitneyU检验;计数资料以百分率(%)表示,两组间比较采用χ2检验或Fisher确切概率法。采用Logistic回归分析患者并发脓毒性休克的危险因素,并通过受试者工作特征曲线(ROC)评估独立危险因素单独或联合预测脓毒性休克的价值。以P<0.05为差异有统计学意义。
2 结果
2.1 脓毒性休克组与非脓毒性休克组的临床资料比较 脓毒性休克组SOFA 评分、28 d 死亡率、住ICU时间、SII、NEU、PT、APTT及INR高于非脓毒性休克组(均P<0.05),而LYM 和PLT 计数低于非脓毒性休克组(均P<0.01)。两组间性别、年龄、白细胞、TT、FIB、DD 比较,差异无统计学意义(均P>0.05),见表1。
2.2 尿源性脓毒症并发脓毒性休克的影响因素分析 依据表1中两组资料比较的结果,将P<0.05的变量及性别、年龄进行单因素Logistic回归分析,结果显示,SOFA评分、LYM计数、PLT计数、SII、PT延长及APTT延长是尿源脓毒症患者并发脓毒性休克的危险因素(均P<0.05),见表2。将上述单因素分析中有意义的因子及性别、年龄纳入多因素Logistic分析,提示SOFA 评分(OR=2.122,95%CI:1.197~2.913,P=0.010)、SII(OR=3.547,95%CI:1.236~9.668,P=0.018)及APTT 延长(OR=6.008,95%CI:1.099~32.853,P=0.039)是脓毒性休克的独立危险因素,见表3。
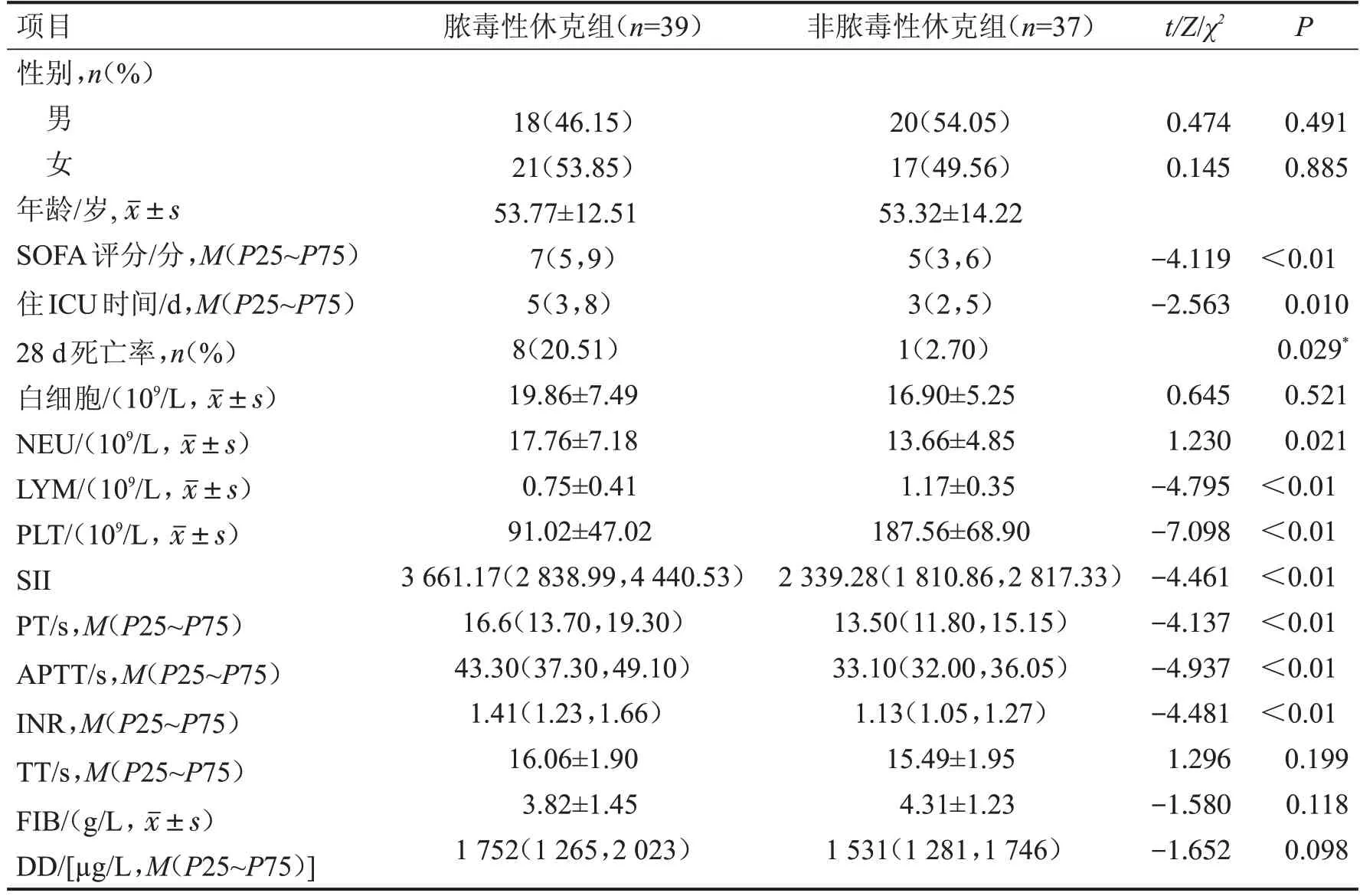
表1 脓毒性休克组与非脓毒性休克组临床资料比较
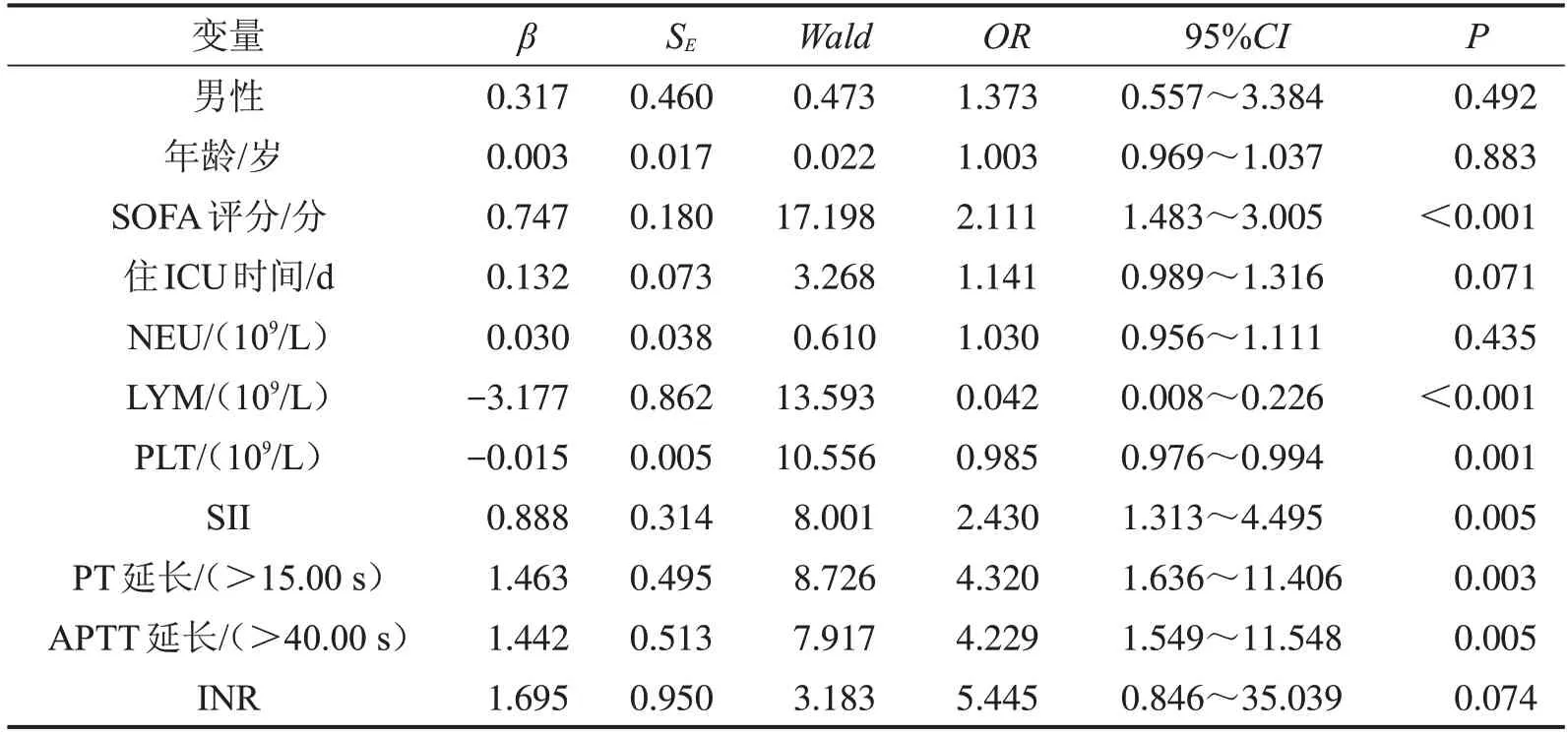
表2 尿源性脓毒症患者并发脓毒性休克的单因素Logistic回归分析

表3 尿源性脓毒症患者并发脓毒性休克的多因素Logistic回归分析
2.3 SII、APTT 联合SOFA 评分对脓毒性休克的预测价值 对SII、APTT 及SOFA 评分单独进行ROC曲线分析,其预测脓毒性休克的曲线下面积(AUC)依次为0.811、0.784、0.816。以2 751.41 为界值,SII预测脓毒性休克的灵敏度和特异度分别79.5%和75.7%。以37.00 s为界值,APTT的灵敏度和特异度分别为74.4%和81.1%。以6.5 为界值,SOFA 评分的灵敏度和特异度分别为64.1%和86.5%。若SII、APTT与SOFA评分三者联合,其预测脓毒性休克的AUC 为0.900,灵敏度和特异度分别为89.7%和81.1%,见图1、表4。
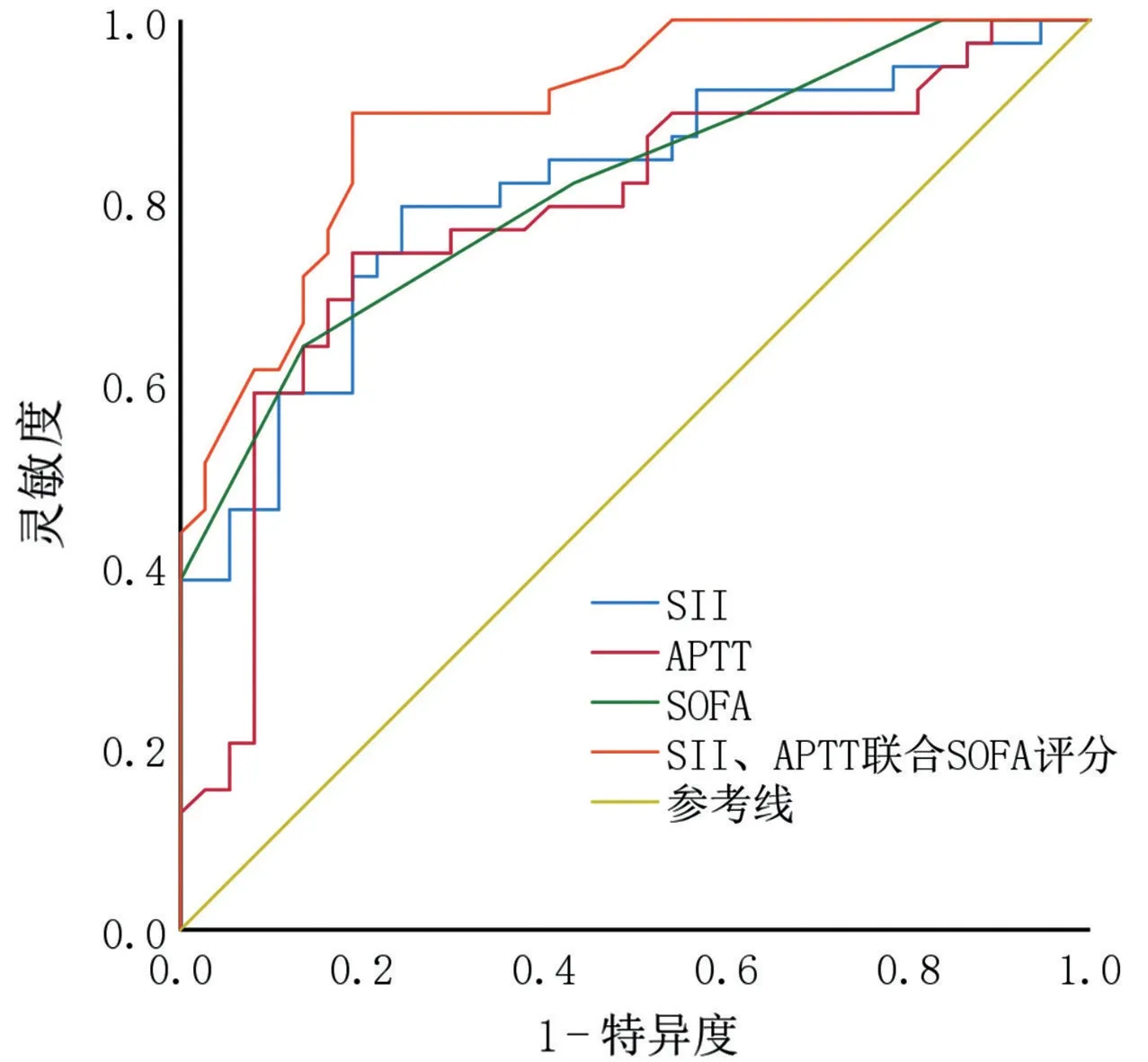
图1 SII、APTT及SOFA评分预测脓毒性休克的ROC曲线图

表4 SII、APTT及SOFA评分对脓毒性休克的预测价值
3 讨论
本研究探讨SII及凝血指标联合SOFA 评分在尿源性脓毒症早期病情评估中的价值。结果显示:在转入ICU 24 h 内,SII、APTT 及SOFA 评分是并发脓毒性休克的独立危险因素,SII、APTT 联合SOFA评分预测脓毒性休克的发生优于单一指标。
本研究提示,SII为脓毒性休克独立危险因素。在脓毒症免疫炎症反应中,NEU过度激活可引起炎症因子释放并引发系统炎症反应综合征,最终导致组织损伤或器官衰竭[5]。过度炎症则可导致PLT 活化并产生大量细胞因子,如CD62-P,进一步促进NEU 的活化[8]。活化的NEU 还可产生大量氧自由基和蛋白水解酶,损害内皮细胞[9]。血管内皮细胞损伤导致内皮下组织中I型和Ⅲ型胶原暴露,从而导致PLT 黏附[10],后者释放血栓素A2(thromboxane A2,TXA2)和5-羟色胺(5-hydroxytryptamine,5-HT)等促凝血介质又可引起PLT 聚集,从而激活凝血和炎症级联反应[11]。同时,脓毒症诱导细胞凋亡可导致淋巴细胞缺失[12]。LYM 减少也被证实与非病毒感染患者并发脓毒症密切相关[13],SII可作为早期评估胰腺炎严重程度指标[5,14],支持本研究结果。
本研究提示,脓毒性休克组PT、APTT高于非脓毒性休克组,且APTT 是脓毒性休克的独立危险因素。PT 和APTT 分别提示外源性和内源性凝血系统功能,提示尿源性脓毒症患者随着病情的进展而发生全面的凝血功能紊乱。如前述,脓毒症发生炎症-凝血级联反应,引起严重的微循环障碍和器官功能损伤,最终导致脓毒性休克甚至多器官衰竭[15]。临床研究也表明,APTT 延长是脓毒症相关急性肾损伤患者全因死亡的独立危险因素[16],与本研究结果类似。
SOFA评分主要用于重症患者的器官功能和预后评估[17],其早期动态变化还可反映脓毒症患者28 d 死亡风险[18]。本研究提示SOFA 评分为脓毒性休克的独立危险因素,与前述研究结果基本一致。有学者通过观察研究发现,将不同的指标结合SOFA 评分,可更好的预测脓毒症发生,并降低死亡率[19]。在本研究中,SII、APTT 联合SOFA 评分预测脓毒性休克的AUC 明显高于SII、APTT 及SOFA 评分单独的AUC,且SII、APTT联合SOFA评分灵敏度和特异度优于单一指标,说明相较于单一指标,SII、APTT 联合SOFA 评分能够更好地预测脓毒性休克的发生,与前述研究结果相类似。
本研究尚存在一些不足之处:首先,仅观察基线指标在尿源性脓毒症病情评估的意义,未动态监测相应指标;其次,纳入的病例仅限于收住ICU 患者,未纳入在普通病房的尿源性脓毒症患者,可能存在抽样偏倚。最后,本研究尚需多中心、前瞻性的研究进一步证实。
综上,SII、APTT及SOFA评分是尿源脓毒症患者并发脓毒性休克的独立危险因素,三者联合预测脓毒性休克的发生优于单一指标,可综合反映免疫、炎症、凝血紊乱和器官功能,提示其可作为预测尿源性脓毒症的简易初筛指标。

