棒柄花叶提取物对肝纤维化大鼠的防治作用及其机制*
张梦师,黄奕璇,李洁莲,易敏铭,肖 敏,郭 超,黄春英△,杨 斌△
(1.广西医科大学药学院,南宁 530021;2.玉林市中医院肝病科,玉林 537000;广西医科大学第八附属医院,贵港 537100)
全球每年有200 万人死于肝脏疾病,因肝硬化和肝癌死亡的人数占疾病总死亡人数的3.5%[1]。肝纤维化是多种慢性肝病发展成为肝硬化甚至肝癌的必经病理环节。若能及时医治,将有助于减轻肝硬化和肝癌的发生。棒柄花叶为大戟科植物棒柄花Cleidion brevipetiolatumPax et Hoffm 的干燥枝叶。为广西壮药,民间用于治疗黄疸、急慢性肝炎、痢疾、热淋等[2]。研究表明棒柄花方可明显改善肝炎患者肝功能、降低患者胆红素,对肝炎肝胆湿热证患者的临床症候有好转作用,并发现棒柄花可改善肝功能、表征等各项指标[3-4]。本研究使用棒柄花叶水提物干预肝纤维化大鼠,旨在探究棒柄花叶水提物对肝纤维化的干预效果及作用机制。
1 材料与方法
1.1 动物 雄性SD 大鼠60 只,SPF 级,体重(180±20)g,由广西医科大学实验动物中心提供(实验动物使用许可证号:SYXK(桂)2020-0004;实验动物生产许可证号:SCXK(桂)2020-0003)。动物实验方案经广西医科大学实验动物中心动物伦理委员会审核批准。
1.2 主要药品与试剂 棒柄花叶水提物,由广西玉林市中医医院鉴定并提供,浓度:1.55 g(生药量)/mL。秋水仙碱片,西双版纳药业有限责任公司,0.5 mg×20 片,批号:20 190422;生理盐水,贵州天地药业有限公司,批号:D19 092901;四氯化碳(CCl4),成都市科龙化工试剂厂,批号:20 190605;花生油,山东鲁花集团有限公司,批号:20 190504;肿瘤坏死因子-α(TNF-α),江苏晶美生物科技有限公司,批号:201912;三型胶原(COL-Ⅲ),武汉华美生物科技有限公司,批号:N20 019515;四型胶原(COL-Ⅳ),武汉华美生物科技有限公司,批号:N16 019516;分子生物级超纯水,HyClone,批号:SH30538.02;反转录第一链cDNA合成试剂盒,Thermo,K1622。
1.3 模型建立与给药[5]SPF级SD雄性大鼠60只,适应性饲养1 周后,将其随机分为6 组:正常对照组,模型对照组,秋水仙碱组和棒柄花叶水提物高、中、低剂量组。除正常对照组外,各组大鼠灌胃50%CCl4花生油溶液1 mL/kg,每周2次,连续6周。造模同时,秋水仙碱组灌胃0.2 mg/kg的秋水仙碱溶液,棒柄花叶水提物高、中、低剂量药物组分别灌胃4.8 g/kg、2.4 g/kg、1.2 g/kg 的棒柄花叶水提物,模型对照组灌胃蒸馏水,1 次/d。为精确的给药量,每次给药前均进行称重。
1.4 给药剂量 棒柄花人临床拟用剂量12 g/d(生药量),参照《药理实验方法学》的传统经典的等效剂量直接折算法。换算出大鼠给药低剂量、中剂量、高剂量分别为1.2 g/kg、2.4 g/kg、4.8 g/kg(生药量/体重)。
1.5 肝脏系数检测及肝组织病理学检查 处死大鼠后;取出胸腺、肝脏,精密电子天平称取胸腺、肝脏重量,计算脏器系数;取每一只大鼠肝大叶的同一位置约1 cm×1 cm 大小,用10%福尔马林溶液固定,用于苏木精—伊红(HE)染色和Masson 染色病理学检查。
1.6 肝功能、胶原指标检测 6周给药结束后,大鼠12 h 禁食不禁水。水合氯醛麻醉大鼠,腹主动脉取血,3 500 r/min 离心30 min 取血清。全自动生化分析仪检测血清谷丙转氨酶(ALT)、谷草转氨酶(AST)的含量,根据ELISA操作说明书,检测血清中COL-Ⅲ、COL-Ⅳ的表达水平。
1.7 炎症指标检测 取“1.6 项”下的血清,根据ELISA说明书操作,分别加入抗体和显色剂,终止显色反应后15 min 内检测吸光度,计算TNF-α、白细胞介素(IL)-1的表达水平。
1.8 RT-PCR 测定大鼠肝组织PDGF、FAK、AktmRNA的表达 取各组大鼠肝脏组织100 mg,提取RNA 并进行反转录,分别检测PDGF、FAK、AktmRNA 水平,程序设置:95 ℃预变性10 min;95 ℃变性15 s,60 ℃退火延伸60 s,共40 次循环。相关引物序列如下:PDGF上游引物序列为5’-AGACCTCGTGGGCTTCAGTTAC-3’,下游引物序列为5’-AGGTGGTGTAGAGGCTGTTGAAG-3’;FAK上游引物序列为5’-AAAGCAGTAATGAGCCAACCAC-3’,下游引物序列为5’-TGAGGCGAAATCCATAGCAG-3’;Akt上游引物序列为5’-TCTCAGTGGCACAATGTCAGC-3’,下游引物序列为5’-TGGGTGAACCTGACCGGAAG-3’;内参GAPDH上游引物序列为5’-CTGGAGAAACCTGCCAAGTATG-3’,下游引物序列为5’-GGTGGAAGAATGGGAGTTGCT-3’。
1.9 统计学方法 采用SPSS 20.0进行统计分析数据,计量资料以均数±标准差()表示。当组间数据比较方差齐时,多组均数比较采用单因素方差分析,组间两两比较采用LSD-t检验;组间数据比较方差不齐时,采用Tamhane’s T2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 对肝纤维化大鼠肝脏系数的影响 与正常对照组比较,模型对照组大鼠体重减轻,胸腺指数降低,肝脏指数增加(P<0.01)。与模型对照组比较,棒柄花叶水提物各剂量组和秋水仙碱组体重和胸腺指数具有上升趋势(P>0.05);肝脏指数具有降低的趋势(P>0.05),见表1。
表1 棒柄花叶水提物对肝纤维化大鼠脏器指数的影响,n=10
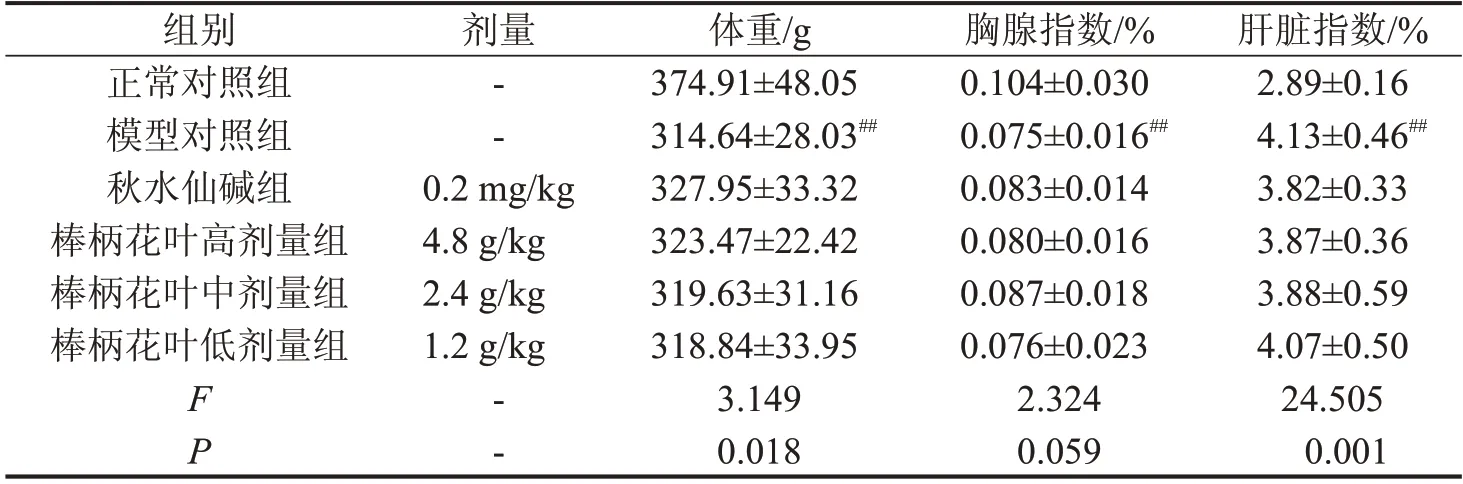
表1 棒柄花叶水提物对肝纤维化大鼠脏器指数的影响,n=10
与正常对照组比较,##P<0.01。
2.2 对肝纤维化大鼠血清生化指标的影响 与正常对照组比较,模型对照组大鼠的AST、ALT 的含量升高(P<0.01);与模型对照组比较,秋水仙碱组和棒柄花叶水提物高、中剂量组能降低大鼠的AST、ALT的含量(P<0.05或P<0.01),见表2。
表2 棒柄花叶水提物对肝纤维化大鼠肝功能的影响,n=10

表2 棒柄花叶水提物对肝纤维化大鼠肝功能的影响,n=10
与正常对照组比较,##P<0.01;与模型对照组比较,*P<0.05,**P<0.01。
2.3 对肝纤维化大鼠血清胶原的影响 与正常对照组比较,模型对照组大鼠的COL-Ⅲ、COL-Ⅳ含量升高(P<0.05或P<0.01);与模型对照组比较,棒柄花叶水提物高、中剂量组与秋水仙碱组的肝纤维化指标COL-Ⅲ、COL-Ⅳ的含量显著降低(P<0.05 或P<0.01),见表3。
表3 棒柄花叶水提物对肝纤维化大鼠纤维化指标的影响,n=10
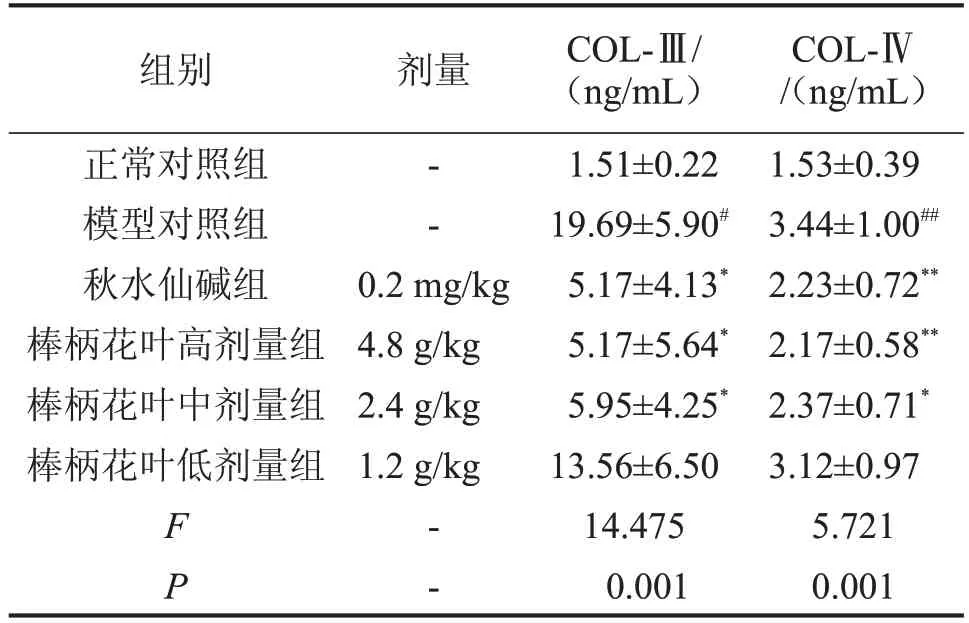
表3 棒柄花叶水提物对肝纤维化大鼠纤维化指标的影响,n=10
与正常对照组比较,#P<0.05,##P<0.01;与模型对照组比较,*P<0.05,**P<0.01。
2.4 对肝纤维化大鼠炎症反应的影响 与正常对照组相比,模型对照组大鼠血清中TNF-α、IL-1含量明显升高(P<0.01)。与模型对照组相比,棒柄花叶水提物高、中剂量组和秋水仙碱组显著降低血清中TNF-α、IL-1 的含量(P<0.05 或P<0.01),棒柄花水提物低剂量组能降低血清中IL-1的含量(P<0.05),见表4。
表4 棒柄花叶水提物对肝纤维化大鼠炎症反应的影响,n=10
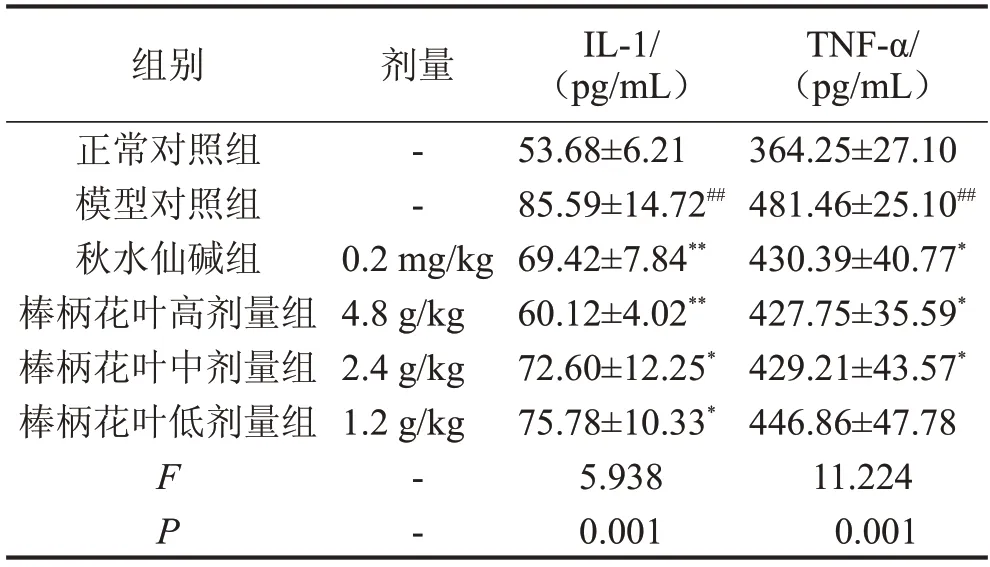
表4 棒柄花叶水提物对肝纤维化大鼠炎症反应的影响,n=10
与正常对照组比较,##P<0.01;与模型对照组比较,*P<0.05,**P<0.01。
2.5 对肝纤维化大鼠肝组织病理的影响(1)HE染色结果:正常对照组,肝小叶结构正常,中央静脉和肝索呈放射状排列,肝组织未见病变;模型对照组肝小叶正常结构被破坏,肝细胞严重肿胀,排列紊乱,肝组织内有广泛的脂肪变性,伴有纤维组织增生和部分组织坏死;秋水仙碱组和棒柄花叶水提物高、中、低剂量组可见减轻肝细胞组织损伤,见图1;(2)Masson染色结果:正常对照组肝小叶内、汇管区见少量纤维组织。模型对照组肝小叶和汇管区结构破坏,并且有大量的纤维组织增生,有较多的炎性细胞浸润。秋水仙碱组及棒柄花叶水提物高、中、低剂量组可见肝组织中纤维增生有减少,棒柄花叶水提物对肝纤维组织增生的情况有改善作用,见图2。

图1 棒柄花叶水提物对肝纤维化大鼠肝组织病理影响(HE染色,×200)

图2 棒柄花叶水提物对肝纤维化大鼠肝组织病理影响(Masson 染色,×100)
2.6 对肝纤维化大鼠PDGF-FAK/Akt信号通路的影响 与正常对照组相比,模型对照组显著上调肝组织中PDGF、FAK、AktmRNA 表达水平(P<0.01);与模型对照组相比,秋水仙碱组及棒柄花叶水提物高、中剂量组的肝组织PDGF、FAK、AktmRNA表达水平降低(P<0.01),见表5。
表5 棒柄花叶水提物对肝纤维化大鼠PDGF-FAK/Akt信号通路的影响,n=10
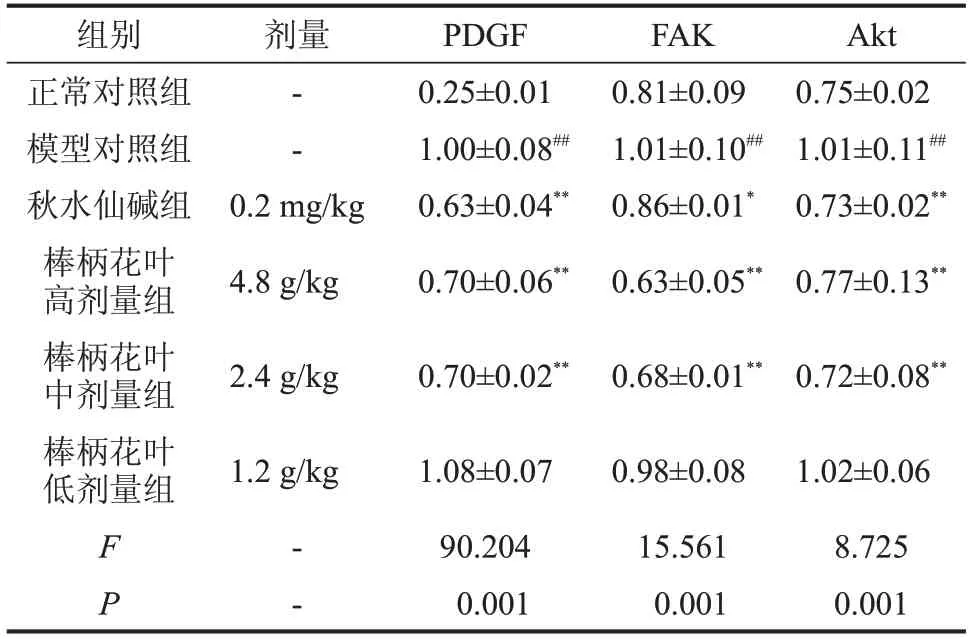
表5 棒柄花叶水提物对肝纤维化大鼠PDGF-FAK/Akt信号通路的影响,n=10
与正常对照组比较,##P<0.01;与模型对照组比较,*P<0.05,**P<0.01。
3 讨论
肝纤维化是肝脏对各种致病因素的损伤进行修复时,引起以胶原蛋白为主的细胞外基质(extracellular matrix,ECM)合成与降解失衡,导致肝内纤维结缔组织异常堆积的病理过程。肝纤维化的发展过程是由多种细胞、细胞因子、信号通路等参与、相互作用、相互调控的结果。尽管肝纤维化的发生机制尚不明确,但目前认为其发病可能与以下几种因素有关:免疫炎症反应、肝星状细胞(hepatic stellate cell,HSC)的活化(中心环节)、细胞因子及其信号途径和细胞外基质的合成增多降解减少等。
ALT 存在于细胞胞质,AST 存在于细胞器中,当肝细胞损伤,肝细胞膜通透性改变,ALT、AST 会大量进入到血液,血清中AST、ALT 被广泛应用于判断肝损伤的敏感和重要的指标[6-7]。Ⅲ、Ⅳ型胶原是构成基底膜胶原的主要成分[8],正常情况下Ⅲ、Ⅳ胶原的合成和降解是一个平衡的状态,当肝脏发生纤维化时,肝星状细胞大量合成,降解下降,血清Ⅲ、Ⅳ胶原含量水平显著上升。本研究结果显示,相对于模型对照组的大鼠,灌胃给予棒柄花叶水提物,大鼠的肝损伤指标AST、ALT 活性降低和肝纤维化指标Ⅲ胶原、Ⅳ胶原含量降低。组织病理学结果表明,棒柄花叶水提物可以显著改变肝细胞松弛及脂肪变性,减少肝细胞的炎症、坏死以及假小叶形成,减轻肝纤维化增生程度。表明棒柄花叶水提物对CCl4诱导的肝纤维化损伤具有较好的改善作用。炎症损伤是诸多病因引起肝损伤向肝纤维化发展的中间环节[9-13]。肝细胞损伤导致大量炎症因子的释放,炎症加剧机体损伤,进一步促进肝脏胶原合成、积累。IL-1是机体内一种促炎因子,TNF-α是机体内炎症反应重要的介质[13]。本研究结果显示,给予不同剂量棒柄花水叶水提物处理后,肝纤维化大鼠血清中IL-1、TNF-α 的含量有不同程度降低,提示棒柄花叶水提物可能通过减轻炎症损伤进而影响肝纤维化的发生。
PDGF是重要的有丝分裂源[14-15],是目前发现最强的HSC 活化激活因子之一,大量研究证实它能通过多种信号途径促进HSC 的增殖、胶原纤维形成[16]。FAK-Akt就是其中一条信号通路。FAK是一种非受体酪氨酸激酶,具有酪氨酸蛋白激酶活性,作为整合素蛋白的下游信号分子,FAK蛋白的N端可以和整合素分子的胞质端结合,将整合素信号传递至细胞内,调节细胞的增殖、黏附等生物学作用。姜慧卿[17]研究发现FAK 可激活HSCs 的活化,致纤维化发生。白瑞丹等[18]、张坤[19]研究发现抑制FAK 的表达,可以抑制LX-2 细胞的增殖,促进凋亡,进而减轻肝纤维化程度。Akt 为丝氨酸/苏氨酸蛋白激酶B,是FAK 信号通路中的下游细胞因子之一。其可通过磷酸化机体内含有丝氨酸/苏氨酸残基的底物,激活mTOR 和p70S6K 等多种激酶而发挥它的促进增殖、抑制凋亡等各种生物学效应[20]。研究发现在慢性肝纤维化患者中Akt 表达水平升高,抑制Akt的活性可抑制HSCs的增殖,增加HSCs凋亡,对Akt 活化抑制可抑制肝纤维化信号路径[21-22]。本实验结果显示,与模型对照组比较,棒柄花叶水提物高、中剂量组均能下调PDGF、FAK、AktmRNA的表达,表明棒柄花叶水提物抗肝纤维化的作用机制可能与调控PDGF-FAK/Akt信号通路有关。
本实验表明棒柄花叶水提物可能通过抑制肝脏胶原纤维生成、减轻肝脏炎症刺激、抑制PDGFFAK/Akt信号通路来逆转大鼠的肝功能和肝纤维化。本研究为进一步探索棒柄花叶治疗肝纤维化的潜在作用机制和对棒柄花叶的进一步制剂开发提供研究基础。

