痛转化大鼠模型焦虑样情绪行为探索及其前扣带皮层兴奋性变化研究
邱梦婷席丹宁韦乃瑄王思思易敏郭子房军帆方剑乔杜俊英
(浙江中医药大学第三临床医学院,浙江省针灸神经病学研究重点实验室,杭州 310053)
痛情绪是由慢性疼痛伴发或诱发的异常情绪反应,其能进一步加重患者的痛感觉,严重影响患者的身心健康和生活质量[1]。据流行病学调查显示,慢性疼痛患者中痛情绪的发生率高达50%[2],两者相互促进,形成恶性循环[3],由于身体和精神状况并存,慢性疼痛患者饱受折磨甚至具有更高的自杀倾向[4]。慢性疼痛和痛情绪之间的相互作用使得慢性疼痛的治疗在临床上具有挑战性,然而两者之间相互作用的时间点及其机制有待研究。
前扣带皮层(anterior cingulate cortex,ACC)是边缘系统的关键区域[5],在急性和慢性疼痛中都被激活,且ACC中的突触长时程增强有助于维持疼痛状态的情感成分[6]。c-Fos被认为是伤害性刺激的标志物,已有大量研究表明c-Fos的表达水平可以作为前扣带皮层、海马、丘脑、杏仁核等核团兴奋性改变的标志物[7-10]。γ-氨基丁酸(GABA)能中间神经元是抑制性中间神经元,其在不同脑区中的作用近年来被广泛报道[11-13],而PV中间神经元在GABA能中间神经元中占比最大,高达40%[14],其在ACC或其他脑区中的作用也有着重要意义[15-16]。前期研究发现,弗氏完全佐剂诱导的慢性炎性痛大鼠在模后4周产生痛焦虑样行为,其痛焦虑样行为的发生与ACC内PV阳性中间神经元兴奋性降低有关[17],且特异性调控ACC内PV阳性中间神经元的表达可以影响ACC内c-Fos的表达水平[18]。近年来有研究指出,当急性痛转化为慢性痛(痛转化)时,疼痛的发生机制产生了巨大的变化[19-20],其变化是否与痛情绪的发生有关,尚未可知。痛转化模型是一个经典的急性痛转慢性痛模型,那么是否可以诱发痛转化模型大鼠的焦虑样情绪,有待研究。本研究旨在探索痛转化模型大鼠的焦虑情绪样行为及研究其ACC的兴奋性变化,结合课题组前期研究基础,动态观察角叉菜胶-前列腺素E2诱导的痛转化模型大鼠不同时间点机械缩足阈及焦虑样情绪行为改变,检测各组大鼠双侧ACC内c-Fos、PV阳性细胞的表达变化,为痛情绪的进一步研究和机制探讨提供一定的参考价值。
1 材料与方法
1.1 材料
1.1.1 实验动物
76只清洁级雄性SD大鼠,8周龄,体重约200 g,购自上海斯莱克实验动物公司【SCXK(沪)2017-0005】。自由进食和饮水,12 h昼夜循环光照,室温(23 ± 2)℃,恒定湿度。实验时间:9:00 ~ 17:00,饲养于浙江中医药大学动物实验研究中心【SYXK(浙)2021-0012】。所有实验操作符合中华人民共和国《实验动物管理条例》,符合浙江中医药大学动物伦理学要求(审批号:IACUC-20200302-06)。
1.1.2 主要试剂与仪器
角叉菜胶(λ-Carrageenan,Car,Sigma,22049),前列腺素E2(prostaglandin E2,PGE2,Sigma,P 5640),兔抗c-Fos抗体(Abcam,ab 190289),兔抗PV抗体(Abcam,ab 11427),Alexa Flour-488标记驴抗兔二抗(Abcam,ab 150061),von Frey纤维刺激针(Stoelting,美国),高架O迷宫(瑞沃德,中国),旷场(瑞沃德,中国),Smart 3.0分析软件(Panlab,美国)。
1.2 方法
1.2.1 分组及造模
分组:大鼠随机分为假敏化组和敏化组,每组分为Car注射后10 d和PGE2注射后4 h、24 h、8 d、15 d(Car 10 d、PGE24 h、PGE224 h、PGE28 d、PGE215 d)5个时间点,其中Car 10 d、PGE24 h和PGE224 h每组6只,PGE28 d和PGE215 d每组10只。
造模:参考本课题组以往造模方法[21-22],敏化组大鼠于左后足足底皮下注射1%角叉菜胶(Car)100 μL,待痛阈恢复至基础水平后,于左足足背中央注射浓度为100 ng/25 μL的PGE225 μL;假敏化组第1次注射25 μL生理盐水,第2次注射同等PGE2。
1.2.2 机械缩足阈(paw withdrawal thresholds,PWTs)
将大鼠置于铁丝网架透明箱内,适应环境30 min,待大鼠笼子探索和主要梳理活动停止后,采用Chaplan等[23]建立的up and down法检测PWTs,选取0.4、0.6、1.0、2.0、4.0、6.0、8.0、15.0、26.0 g总计9种强度的纤维丝套组,强度从4.0 g开始,von Frey丝垂直刺向大鼠足底中央,稳定持续用力6 s。如果大鼠有明显的缩足、甩足、抬足及舔足等躲避反应时,记为“X”,更换临近低一强度刺激丝继续检测;如果没有躲避反应,则记为“O”,更换临近高一强度刺激丝继续检测,以第1次出现“XO”或“OX”为开始,再连续测4次,得到一串以“O”或“X”组合的序列,如“OOXOXOX”。用公式:PWTs(g)=(10[Xf+κδ])/10000,计算并记录。Xf为刺激丝强度的对数值,序列组合查表获得κ值,δ此处为0.231。若计算得出PWTs > 26.0 g或< 0.4 g,仍以26.0 g或0.4 g作为最大或最小值。
1.2.3 旷场实验(open field,OF)
参考课题组前期的实验方法[24],测试前将实验大鼠放入实验室中适应环境30 min,环境安静,室温(23 ± 2)℃,避免直射光线,保持较暗的环境。旷场实验箱长宽均100 cm,高50 cm,将大鼠置于旷场中央区域,先适应30 s,再记录5 min的活动情况,结束后取出大鼠,用10%乙醇清洗避免气味干扰。Smart 3.0软件进行数据分析:将旷场等分为16个边长为25 cm的正方形区域,设置最中心4个正方形区域为中央区,其他区域为周围区。分析大鼠的总运动距离、中央区运动距离、中央区停留时间和中央区进入次数。
1.2.4 高架O迷宫(elevated zero maze,EZM)
环境要求及适应条件同OF实验。高架O迷宫为直径100 cm,高50 cm的圆形平台,圆形平台由两个开放臂和闭合臂组成。将实验大鼠头部面向开放臂,轻缓地放置于闭合臂和开放臂的交界处,进行摄像,先适应30 s,再记录5 min的活动情况,结束后取出大鼠,用10%乙醇清洗避免气味干扰。Smart 3.0软件进行数据分析:将高架O迷宫分为开放臂和闭合臂交替的4个区域,有挡板的为闭合臂,无挡板的为开放臂。分析大鼠的总运动距离、开放臂运动距离、开放臂停留时间和开放臂进入次数。
1.2.5 免疫荧光(immunofluorescence,IF)样本制备
所有行为学实验结束后,用戊巴比妥钠(80 mg/kg)腹腔注射麻醉,经主动脉快速灌注生理盐水(4℃预冷),至大鼠眼球和肝变白。再缓慢灌注4%多聚甲醛,至大鼠身体全身僵硬。将大鼠全脑快速取出,4%多聚甲醛固定24 h,15%和30%的蔗糖梯度脱水至脑组织沉底,液氮速冻,冰冻切片机切取30 μm脑组织样本,-80℃冰箱保存备用。
1.2.6 IF检测
脑组织切片TBST清洗6遍,37℃水浴箱内封闭液(10%驴血清、90% TBST、0.3% Triton X-100)封闭1 h,加入兔抗c-Fos抗体(1∶500)或兔抗PV抗体(1∶400)4℃孵育,18 h后于37℃水浴箱复温2 h,TBST清洗6遍。避光条件下,加入Alexa Flour-488驴抗兔二抗(1∶500),于37℃水浴箱孵育1 h,TBST清洗6遍。切片干燥后,抗荧光淬灭封片液(含DAPI)封片。使用蔡司荧光显微镜20倍物镜拍摄图像。通过大鼠脑图谱确定ACC解剖区域的边界,手动计数双侧ACC区域PV阳性细胞数量;在双侧ACC区域分别框选0.1 mm2矩形选区,手动计数此区域中c-Fos阳性细胞数量。
1.3 统计学分析
实验数据用平均值 ± 标准差(±s)表示,SPSS 20.0软件统计分析。PWTs、OF、EZM、IF数据,均采用独立样本t检验,以P< 0.05表示有统计学意义。
2 结果
2.1 痛转化模型大鼠不同时间点PWTs
分别检测各组大鼠Car注射前(base),Car注射后4、24、48、72 h、10 d,PGE2注射后1、4、24、48、72 h、7 d和14 d的PWTs。
如图1A,与假敏化组比较敏化组大鼠PWTs于Car注射前无统计学意义(P> 0.05),于Car注射后4 h显著降低(P< 0.01),48 h后逐渐上升,第10天恢复至基础水平(P> 0.05)。PGE2注射后1 h两组大鼠PWTs均显著降低且两组间无统计学意义(P> 0.05)。PGE2注射后4 h,假敏化组大鼠PWTs恢复正常,但敏化组大鼠PWTs仍保持在较低水平,并持续14 d。如图1B,与假敏化组大鼠比较,敏化组大鼠PWTs曲线下面积显著降低(P< 0.01)。以上结果说明痛转化大鼠模型制备成功且大鼠机械痛觉敏化可持续至PGE2注射后14 d。
2.2 痛转化模型大鼠不同时间点OF行为学
分别在PGE2注射后24 h、7 d和14 d进行OF实验,观察痛转化模型大鼠焦虑样行为。如图2A,2B所示,PGE2注射后24 h,与假敏化组比较,敏化组大鼠OF总运动距离、中央区运动距离、中央区停留时间和中央区进入次数显著减少,差异具有统计学意义(P< 0.01),结果表明PGE2注射后24 h敏化组大鼠运动能力减弱且焦虑行为增加,出现焦虑样情绪。由图2A,2C,2D可见,PGE2注射后7 d和14 d,与假敏化组比较,敏化组大鼠OF总运动距离、中央区运动距离、中央区停留时间和中央区进入次数均无统计学差异(P> 0.05),结果表明PGE2注射后7 d和14 d敏化组大鼠运动能力恢复,未出现明显的焦虑样行为。
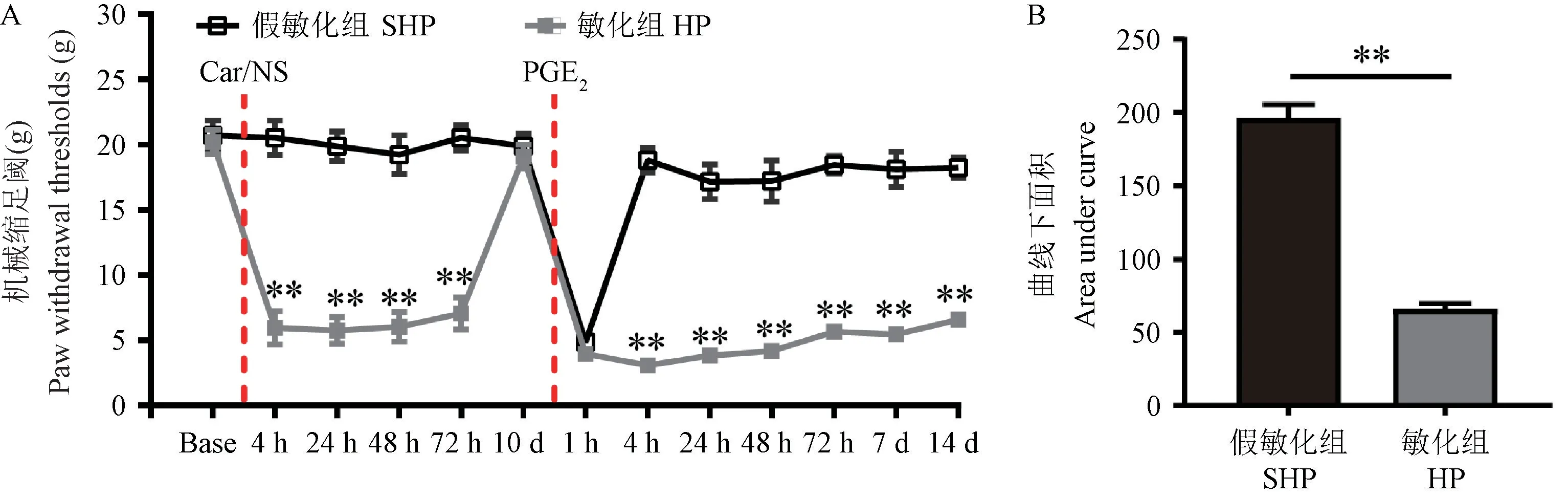
注:与假敏化组相比,**P < 0.01。图1 各组大鼠不同时间点PWTsNote.Compared with the SHP, **P < 0.01.Figure 1 PWTs at different time points in each group rats

注:与假敏化组相比,*P < 0.05,**P < 0.01。(下图同)图2 各组大鼠不同时间点OF行为学Note.Compared with the SHP, *P < 0.05, **P < 0.01.(The same in the following figures)Figure 2 OF behavior at different time points in each group rats
2.3 痛转化模型大鼠不同时间点EZM行为学
分别在PGE2注射后24 h、8 d和15 d进行EZM实验,观察痛转化模型大鼠焦虑样行为。由图3A,3B所示,PGE2注射后24 h,与假敏化组比较,敏化组大鼠EZM总运动距离、开放臂运动距离、开放臂停留时间和开放臂进入次数显著减少,差异具有统计学意义(P< 0.05),结果表明PGE2注射后24 h敏化组大鼠运动能力减弱且焦虑行为增加,出现焦虑样情绪。由图3A,3C,3D可见,PGE2注射后8 d和15 d,与假敏化组比较,敏化组大鼠EZM总运动距离、开放臂运动距离、开放臂停留时间和开放臂进入次数均无显著性差异(P> 0.05),结果表明PGE2注射后8 d和15 d敏化组大鼠运动能力恢复,未出现明显焦虑样行为。

图3 各组大鼠不同时间点EZM行为学Figure 3 EZM behavior at different time points in each group rats
2.4 痛转化模型大鼠不同时间点ACC中c-Fos阳性细胞表达
分别检测Car注射后10 d,PGE2注射后4 h、24 h、8 d和15 d各组大鼠ACC内c-Fos阳性细胞的表达。如图4A,4B所示,Car注射后10 d,与假敏化组比,敏化组大鼠双侧ACC内c-Fos阳性细胞数量显著减少(P< 0.01)。如图4A,4C所示,PGE2注射后4 h,与假敏化组比较,敏化组大鼠ACC内c-Fos阳性细胞数量无显著性差异(P> 0.05)。如图4A,4D,4E所示,PGE2注射后24 h和8 d,与假敏化组比较,敏化组大鼠双侧ACC内c-Fos阳性细胞数量显著增多(P< 0.01)。如图4A,4F所示,PGE2注射后15 d,与假敏化组比,敏化组大鼠ACC内c-Fos阳性细胞数量无显著性差异(P> 0.05)。
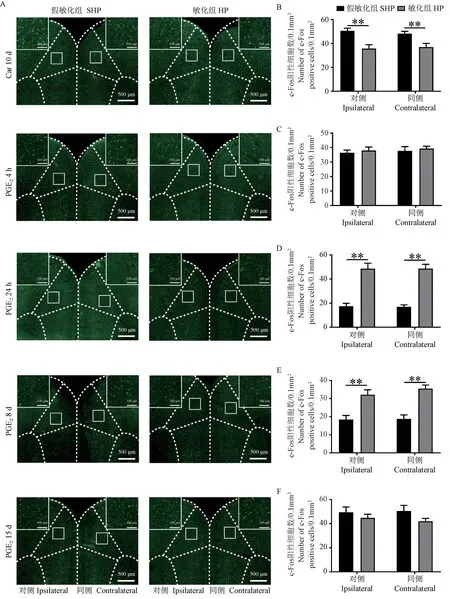
图4 各组大鼠不同时间点ACC内c-Fos阳性细胞表达Figure 4 Expression of c-Fos positive cells in ACC at different time points in each group rats
2.5 痛转化模型大鼠不同时间点ACC中PV阳性细胞表达
分别检测Car注射后10 d,PGE2注射后4、24 h、8 d和15 d各组大鼠ACC内PV阳性细胞的表达。如图5A ~ 5E所示,Car注射后10 d和PGE2注射后4 h、24 h、8 d,与假敏化组比,敏化组大鼠双侧 ACC内PV阳性细胞数量均无显著性差异(P> 0.05)。如图5F所示,PGE2注射后15 d,与假敏化组比,敏化组大鼠ACC内同侧PV阳性细胞数量显著减少(P< 0.05),对侧无显著性差异(P> 0.05)。

图5 各组大鼠不同时间点ACC内PV阳性细胞表达Figure 5 Expression of PV positive cells in ACC at different time points in each group rats
3 讨论
随着疼痛研究的深入,认为疼痛不仅是一种与组织损伤相关的感觉,而且包括情绪、认知等主观体验[25]。流行病学研究表明20% ~ 50%的慢性疼痛患者伴有负性情绪,如焦虑、抑郁等,使慢性疼痛的临床治疗变得更加困难[26]。因此,有效控制痛情绪的产生对慢性疼痛的治疗意义非常。目前一种痛觉敏化诱发模型广泛用于研究从急性疼痛到慢性疼痛转变的潜在机制[27-29],然而急慢性痛转化是否会引起痛相关情绪的变化尚缺少相关研究。
本研究通过二次注射来建立痛觉敏化诱发即急慢性痛转化模型,第1次注射角叉菜胶给予大鼠足底炎性刺激,待大鼠痛阈恢复正常第2次注射PGE2再次诱发疼痛,该疼痛与单纯PGE2诱发的短暂急性痛不同,持续时间超过14 d,此结果与前人的研究趋势一致[30]。本实验在痛觉敏化诱发后不同时间点采用OF和EZM行为检测大鼠的焦虑样行为,结果显示PGE2注射后24 h敏化组大鼠运动能力下降且产生焦虑样情绪,然而在PGE2注射后1周和2周均未出现焦虑样行为的改变。此结果表明痛转化模型大鼠1 ~ 2周难以诱发出焦虑样行为,而PGE2注射后24 h出现的短暂性焦虑样情绪,可能是因为疼痛的急剧加重导致的应激行为。前期研究发现CFA诱导的慢性炎性痛模型大鼠,在2 ~ 3周时并未表现出明显的焦虑样情绪,而在4周以后出现明显的焦虑样情绪[24]。这提示,慢性疼痛诱发的负面情绪是随着时间的推移而出现的,所采用的痛转化模型大鼠前期出现应激性焦虑样情绪,当慢性疼痛趋于稳定后,其焦虑样情绪反而消失了,若疼痛持续时间延长至4周以上,其焦虑样情绪有可能再次诱发。
众所周知,ACC是疼痛感知和情感控制的关键皮质区域[31-32]。本实验检测了急慢性痛转化模型大鼠ACC水平不同时间点c-Fos和PV阳性细胞数变化情况。c-Fos是一种早期即刻基因,常被认为是神经元活性的标志物[33]。PV阳性中间神经元是GABA能中间神经元中占比最大的一种亚型,具有高代谢性和高电活性,是中枢神经抑制系统的重要标志[34-35],在疼痛和焦虑抑郁等精神疾病中表现出重要的调节作用[36-38]。研究表明,组织损伤或急性疼痛会诱导持续的神经元可塑性变化,即使组织损伤修护后,其神经元可塑性改变仍然存在,这种现象称为潜伏性疼痛敏化(latent pain sensitization,LS),通过代偿性疼痛抑制系统(包括阿片类药物、神经肽Y和α2-肾上腺素能受体信号传导)将疼痛保持在缓解状态[39-42]。实验中观察到,注射角叉菜胶后大鼠足底出现急性疼痛,10 d后疼痛恢复正常,双侧ACC内c-Fos阳性细胞数显著减少。由此推测敏化组大鼠机械痛阈恢复至正常水平后处于LS状态,此时疼痛的缓解可能与ACC兴奋性的抑制相关。大量研究表明,当患者或动物处于慢性疼痛或精神障碍时,ACC的兴奋性会增强[43-45]。实验中也观察到类似结果,注射PGE2后24 h、8 d,敏化组大鼠双侧ACC区域c-Fos阳性细胞数显著增加;注射PGE2后15 d双侧ACC区域c-Fos阳性细胞表达无明显改变,而同侧ACC区域PV阳性细胞数显著减少。当注射PGE2后,敏化组大鼠接受二次疼痛刺激,此时LS状态失衡,ACC内神经元兴奋性增强,诱导痛觉敏化的产生;且ACC中神经元的兴奋有其时间特异性:前期以c-Fos表达增加,兴奋性神经元功能增强为主;而后期以PV表达减少,抑制性神经元功能减弱为主。
本实验通过建立急慢性痛转化模型,观察不同时间点疼痛和情绪行为,发现Car和PGE2诱发的痛转化模型大鼠痛觉敏化状态可超过14 d;此模型可出现短暂的应激性焦虑样行为改变,但在1 ~ 2周内未观察到焦虑样行为改变,由此我们认为此模型不易诱发焦虑样情绪或者其情绪改变需要更长时间的观察;通过检测不同时间点ACC内c-Fos和PV阳性细胞的数量,发现痛转化模型大鼠ACC兴奋性发生改变,Car诱导的炎性痛恢复后ACC兴奋性处于抑制状态,而注射PGE2后诱发痛觉敏化后ACC兴奋性增强。本研究探讨了急慢性痛转化模型诱发痛焦虑样情绪的情况,为痛情绪的进一步研究提供一定的参考价值。

