不同条件下建立自身免疫性甲状腺炎小鼠模型的比较研究
丁习赵洋伍丽萍吕宏军许华阳周一坤施秉银
(西安交通大学第一附属医院,西安 710061)
自身免疫性甲状腺炎(autoimmune thyroiditis,AIT)是一种器官特异性的自身免疫性疾病,以甲状腺内淋巴细胞炎性浸润、滤泡结构破坏,血中甲状腺过氧化物酶抗体(antithyroperoxidase antibodies,TPOAb)和甲状腺球蛋白抗体(antithyroglobulin antibodies,TgAb)水平升高为特征[1]。AIT是引起甲状腺功能减退最常见的病因,年患病率约为0.3 ~ 1.5/1000,女性居多[2-3]。其发病机制仍未完全明确,可能与遗传易感性及环境(微量元素摄入、吸烟、饮酒、感染、应激、药物)等多因素有关[2,4]。
在动物活体水平,建立起能真实反应人类疾病发生发展的疾病动物模型,对研究疾病的发病机制、病情进展、治疗药物的筛选评估都极为重要。高碘诱导法和免疫介导法是目前最常见的两种建立AIT小鼠模型的方法[5]。其中,免疫介导法是指利用抗原(同种或异种)配合佐剂免疫易感品系小鼠,建立实验性自身免疫性甲状腺炎(experimental autoimmune thyroiditis,EAT)模型。此种方法因实验小鼠(CBA/J)易获得、造模方法简单、造模时长较短、模型成功率较高等优点而被广泛认可及应用。
常用于免疫介导法造模的抗原有两种:小鼠甲状腺球蛋白(mouse thyroglobulin,mTg)及猪甲状腺球蛋白(porcine thyroglobulin,pTg)。目前没有市售的mTg标准试剂,需实验者自行从粉碎后的小鼠甲状腺中提取并纯化。制备mTg尚无规范化流程,实验者的操作技术水平及各实验室的设备条件均会直接影响到所制备mTg的蛋白纯度。而pTg已有标准成品试剂,可直接购买,便于操作,实验流程较为简单规范,利于实验结果复刻。常用的佐剂有完全弗氏佐剂(complete Freund’s adjuvant,CFA),不完全弗氏佐剂(incomplete Freund’s adjuvant,IFA)及脂多糖(lipopolysaccharide,LPS)。CFA及IFA为传统含油佐剂,需与抗原充分混合制成粘稠的乳化剂,免疫小鼠时采用皮下多点注射,能够刺激机体产生较强的体液及细胞免疫应答,但副作用也较强,常在皮下形成不易消退的硬结,造成注射部分炎症及溃疡。LPS为细菌内毒素,通过类脂A成分发挥增强免疫的作用,无色透明,使用时不需与抗原混合,采用尾静脉注射法,副作用较少。
目前比较多见的是采用mTg或pTg,辅以CFA或LPS作为佐剂建立EAT模型,但都基于雌性CBA/J小鼠,少有探索雄性小鼠造模的研究。此外,在抗原剂量选择上,除郭丹等[6]研究了mTg不同剂量(100、200、400 μg)造模效果后,发现200 μg为最佳剂量之外,国内鲜有此类研究。而针对不同注射频次结合造模时长影响EAT造模效果的研究更是未见报道。
因此,本研究使用公认的易感CBA/J小鼠,采用pTg+LPS造模法,分别研究不同性别、不同pTg剂量、不同注射频次结合造模时长对EAT造模的影响,进一步探索用pTg建立小鼠EAT模型最适宜的方案选择。
1 材料与方法
1.1 材料
1.1.1 实验动物
SPF级60只雌性及20只雄性CBA/J小鼠,8周龄,体重约17 ~ 25 g,购于北京华阜康生物科技股份有限公司【SCXK(京)2019-0008】。小鼠饲养于IVC笼内,自由进食饮水,昼夜各12 h交替光照,温度20 ~ 22℃,湿度24% ~ 28%,饲养于西安交通大学实验动物中心【SYXK(陕)2020-001】。所有操作均符合西安交通大学实验动物中心实验伦理学要求(审批号:2021-1457)。
1.1.2 主要试剂与仪器
猪甲状腺球蛋白(Sigma,T1126),脂多糖(Sigma,L2630),磷酸盐缓冲盐溶液(Hyclone,SH30256),一次性使用无菌胰岛素注射器(德国贝朗公司,20183142477),TMB单组分显色液(Solarbio,PR1200),碘[1251]甲状腺素放射免疫分析试剂盒(天津市协和医药科技集团有限公司,RA10102),逆转录试剂盒(TaKaRa,RR036A),荧光定量试剂盒(TaKaRa,RR820A),抗小鼠CD4 FITC抗体(eBioscience,11-0041-82),抗小鼠CD25 APC抗体(eBioscience, 17-0251-81),抗小鼠Foxp3 PE抗体(eBioscience, 12-5773-82),抗小鼠IL-17 PE抗体(eBioscience,12-7177-81),破膜固定剂(eBioscience,51-9008101)。
PCR仪(Bio-Rad,美国),荧光定量PCR仪(Bio-Rad,美国),正置光学显微镜(Olympus,日本),流式细胞仪(BD,美国),Enspire多功能酶标仪(PerkinElmer,美国)。
1.2 方法
1.2.1 小鼠分组及造模步骤
将60只8周龄雌性CBA/J小鼠随机分成6组,每组10只,将20只8周龄雄性CBA/J小鼠随机分成2组,每组10只。分组及实验安排如表1所示。各组小鼠同步开始实验。

表1 小鼠分组及实验安排(n = 10)Table 1 Grouping and experimental arrangement of mice(n = 10)
本实验主要分为3部分:第1部分雌雄小鼠均有;第2、3部分均只在雌性小鼠上实施。第1部分(比较不同性别):F-C、M-C、F-100×2-28及M-100×2-28。第2部分(比较不同抗原剂量):F-100×2-28、F-50×2-28及F-200×2-28。第3部分(比较不同注射频次结合造模时长):F-100×2-28、F-100×3-28及F-100×3-35。
1.2.2 甲状腺病理
小鼠甲状腺用4%多聚甲醛固定,石蜡包埋切片,HE染色,显微镜下观察甲状腺滤泡破坏及淋巴细胞浸润情况,用Image J软件分析浸润面积,并按照EAT模型评分标准评价[7]:0为正常、1+为1% ~ 10%、2+为10% ~ 30%、3+为30% ~ 50%、4+为>50%。
1.2.3 血清TgAb及总甲状腺素(TT4)测定
小鼠血清TgAb采用ELISA检测。96孔酶标板每孔加入100 μL的2 μg/mL的pTg溶液,4℃过夜,次日取出洗涤3次后用封闭液封存过夜。洗涤后每孔加入100 μL按1∶2000稀释的小鼠血清,密封过夜。取出洗涤之后,加入100 μL按1∶5000稀释的HRP标记的山羊抗小鼠IgG,静置1 h,洗涤后加入TMB显色剂室温静置5 min,加入硫酸终止反应。在酶标仪上读取各孔450 nm波长处的OD值。
血清总甲状腺素(TT4)测定采用放射免疫法检测:小鼠血清和碘[1251]标记的T4与相应抗体反应,结合成抗原抗体复合物,在二抗及聚乙二醇作用下,形成免疫复合物,离心后沉淀,使用γ计数器测定放射性强度。最终通过标准曲线计算出血清TT4浓度。
1.2.4 流式细胞检测
分离并研磨脾,收集细胞悬液,裂红洗涤后制成单细胞悬液(细胞浓度为5 × 106/mL)。Treg(CD4+CD25+Foxp3+)细胞染色:使用FITC标记的CD4抗体及APC标记的CD25抗体进行细胞表面染色,固定破膜后用PE标记的Foxp3核内染色。Th17(CD4+IL-17A+)细胞染色:取单细胞悬液置于细胞培养板中,加入RPMI 1640培养基、胎牛血清及细胞激活剂,37℃,5% CO2,孵箱培养5 h后取出。使用FITC标记的CD4抗体进行表面染色,固定破膜后用PE标记的IL-17A抗体核内染色。最终使用多通道流式细胞仪进行检测,Cell Quest Pro软件分析数据。
1.2.5 小鼠脾转录因子检测
TRIzol法提取小鼠脾总RNA,用Prime ScriptTMRT reagent试剂盒逆转录为cDNA,加入引物进行Real time PCR扩增,引物序列如表2所示。

表2 实时荧光定量PCR引物序列Table 2 Real-time PCR primer sequences
1.3 统计学分析
实验数据采用SPSS 22.0及GraphPad Prism 8.0整理分析。计量资料数据以平均值 ± 标准差(±s)表示。多组间采用单因素方差分析(One-way ANOVA),组间两两比较采用LSD法,以P< 0.05表示差异具有显著性。
2 结果
2.1 小鼠甲状腺炎病理情况
由图1可见,对照组小鼠甲状腺组织中甲状腺滤泡大小较为均一,结构完整无破坏无萎缩,滤泡腔内充满胶质,分布较均匀,未见炎性细胞浸润;造模组小鼠甲状腺滤泡大小不一,可见不同程度的滤泡萎缩及破坏,有明显淋巴细胞浸润表现。F-200×2-28、F-100×3-28及F-100×3-35淋巴细胞浸润程度较其他各组更重。
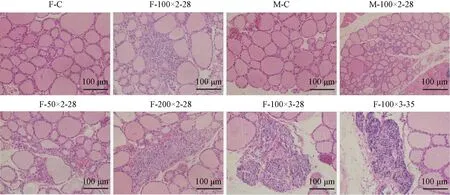
图1 各组小鼠甲状腺病理切片Figure 1 Pathological sections of thyroid gland in each groups of mice
各组小鼠甲状腺炎病理评分情况如表3所示。比较不同性别对EAT造模影响,F-100×2-28与M-100×2-28之间无显著性差异;F-50×2-28<F-100×2-28<F-200×2-28,但3组之间无显著性差异(F= 3.135,P= 0.06);F-100×2-28<F-100×3-35<F-100×3-28,其中F-100×3-28显著高于F-100×2-28(P< 0.05)。

表3 各组小鼠自身免疫性甲状腺炎病理评分Table 3 Pathological scores of EAT model in each groups of mice
2.2 小鼠血清TgAb及TT4水平
不同性别、抗原剂量、造模频次及时长对小鼠血清TgAb相对浓度影响如图2A所示。与各自对照组相比,雌性及雄性任一造模条件组TgAb相对浓度均显著性升高(P< 0.05)。比较不同性别因素时,F-100×2-28的TgAb相对浓度(15956.72 ± 2465.47)较M-100×2-28(11148.90 ± 2136.91)显著升高(P< 0.001)。与F-100×2-28相比,F-50×2-28的TgAb相对浓度显著降低,F-100×3-28及F-100×3-35均显著升高(P< 0.001),其中F-100×3-28的TgAb相 对 浓 度 最 高(20504.09 ± 4499.52)。
各组小鼠TT4水平如图2B所示,F-100×2-28、M-100×2-28虽较各自对照组相比,TT4水平均显著升高(P< 0.001),但雌雄两造模组之间未有显著性差异。与F-100×2-28比较,F-50×2-28的TT4水平显著降低,F-200×2-28、F-100×3-28均显著升高。其中F-100×3-28的TT4水平最高(102.34 ± 17.69)μg/dL,较F-100×3-35(84.16 ± 11.69)μg/dL也有显著性升高。而F-100×3-35与F-100×2-28相比,TT4水平未有明显差异。
2.3 小鼠脾Treg及Th17淋巴细胞比例
如图3所示,与F-C相比,F-100×2-28的CD4+CD25+Foxp3+Treg细胞比例降低,不具有显著性((12.20 ± 1.45)% vs(13.13 ± 2.26)%),但CD4+IL17A+Th17细胞比例显著升高((1.03 ± 0.24)% vs(0.17 ± 0.14)%,P< 0.001)(见图4);与此同时,与M-C相比,M-100×2-28的Treg细胞比例降低,但不具有显著性,而Th17细胞比例却显著性升高(P< 0.01)。雌、雄小鼠对比,雄鼠Treg细胞未见明显差异,Th17细胞比例显著低于雌鼠(P< 0.01)。此结果可能提示,在本实验条件下,就反映体内免疫学状态而言,小鼠Th17细胞较Treg细胞或许更具有代表性。
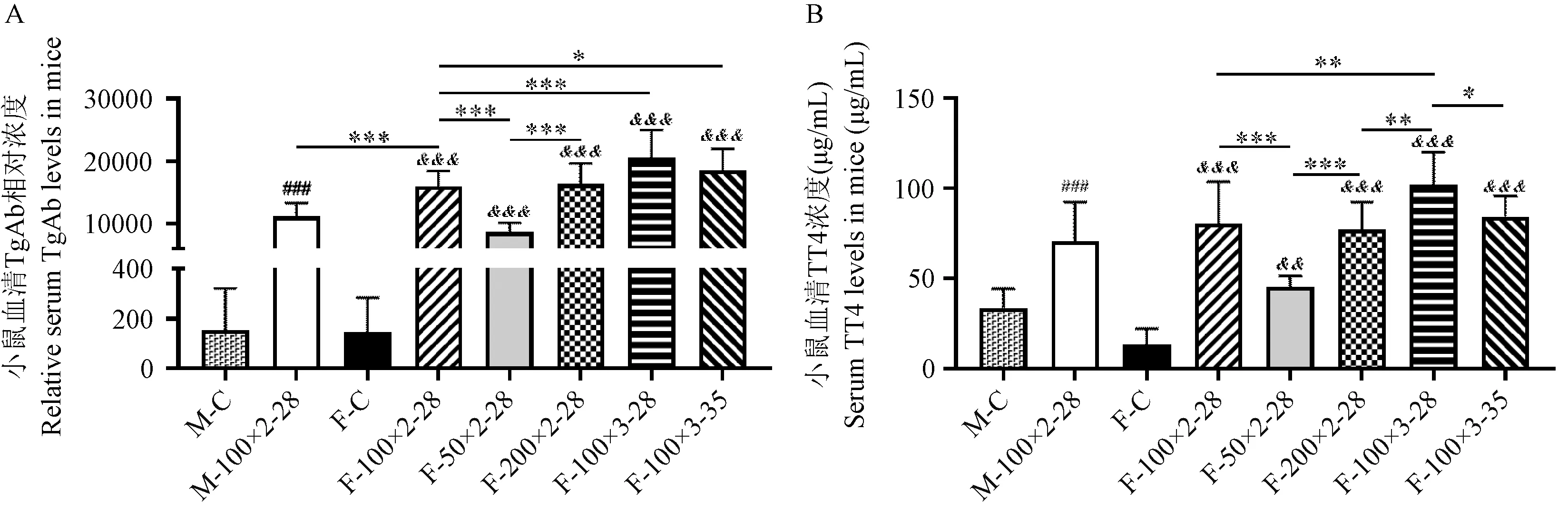
注:与M-C相比,#P < 0.05,##P < 0.01,###P < 0.001;与F-C相比,&P < 0.05,&&P < 0.01,&&&P < 0.001;其余组之间的比较,*P < 0.05,**P < 0.01,***P < 0.001。(下图同)图2 各组小鼠血清TgAb相对浓度及TT4水平Note.Compared with M-C, #P < 0.05, ##P < 0.01, ###P < 0.001.Compared with F-C, &P < 0.05, &&P < 0.01, &&&P < 0.001.Compared with the rest of the groups, *P < 0.05, **P < 0.01, ***P < 0.001.(The same in the following figures)Figure 2 Serum TgAb relative levels and TT4 levels in each groups of mice
与F-100×2-28相比,F-50×2-28的Th17细胞比例显著降低(P< 0.01),F-100×3-28及F-100×3-35均显著升高(P< 0.001),其中F-100×3-28的Th17细胞比例最高(1.54 ± 0.32)%。而与F-100×2-28的Treg细胞比例相比,F-200×2-28及F-100×3-28差异不显著,F-100×3-35显著降低(P< 0.05),F-100×3-35的Treg细 胞 比 例 最 低(10.47 ± 1.48)%。
2.4 小鼠脾Foxp3、mRNA、TGF-β mRNA、RORγt mRNA及IL-17A mRNA相对表达水平
各组小鼠脾Treg细胞特异性转录因子Foxp3、TGF-β及Th17细胞特异性转录因子ROR-γt与IL-17A的mRNA相对表达水平如图5所示。
与F-C相比,F-100×2-28的Foxp3 mRNA表达量显著性降低(P< 0.01),TGF-β mRNA表达量无显著性差异,F-100×2-28的ROR-γt mRNA及IL-17A mRNA表达量均显著性增高(P< 0.001)。M-100×2-28与M-C相比,只有IL-17A mRNA表达量显著性升高(P< 0.01),而Foxp3 mRNA、TGF-β mRNA以及ROR-γt mRNA表达量未有显著性差异。
与F-100×2-28相 比,F-50×2-28的ROR-γt mRNA及IL-17A mRNA表达量显著性降低(P< 0.001),而Foxp3 mRNA、TGF-β mRNA表达量未有显著变化;F-200×2-28只有Foxp3 mRNA表达量显著性降低(P< 0.05)。与F-100×2-28相比,F-100×3-28及F-100×3-35在TGF-β mRNA表达水平上未有明显变化,而Foxp3 mRNA表达均显著降低(P< 0.001,P< 0.01),IL-17A mRNA表达均显著升高(P< 0.001),其中F-100×3-28的Foxp3 mRNA表达量最低,IL-17A mRNA表达量最高。
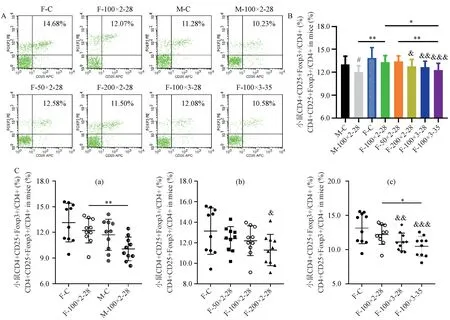
注:A:各组小鼠CD4+CD25+Foxp3+T细胞(Treg细胞)占CD4+T细胞比例的流式分析图;B:整体比较各组小鼠Treg细胞比例;C:在不同性别(a)、不同抗原剂量(b)、不同注射频次结合造模时长(c)条件下比较各组小鼠Treg细胞比例。图3 各组小鼠Treg细胞比例Note.A.Flow cytometry of the proportion of CD4+CD25+Foxp3+T cells (Treg cells) in CD4+T cells in each group of mice.B.Proportion of Treg cells in each groups of mice.C.Proportion of Treg cells in different groups of mice under the conditions of different genders (a), different antigen doses (b), and different injection frequency and modeling durationunder (c).Figure 3 Proportion of Treg cells in each groups of mice
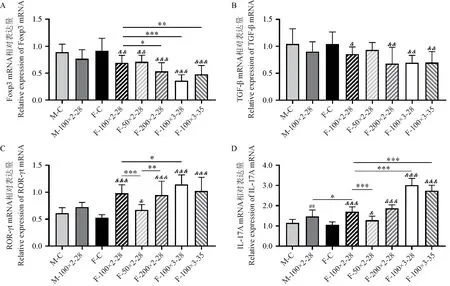
注:A:Foxp3 mRNA相对表达水平;B:TGF-β mRNA相对表达水平;C:ROR-γt mRNA相对表达水平;D:IL-17A mRNA相对表达水平。图5 各组小鼠脾Foxp3 mRNA、TGF-β mRNA、ROR-γt mRNA及IL-17A mRNA相对表达水平Note.A.Relative expression levels of Foxp3 mRNA.B.Relative expression levels of TGF-β mRNA.C.Relative expression levels of ROR-γt mRNA.D.Relative expression levels of IL-17A mRNA.Figure 5 Relative expression levels of Foxp3 mRNA、TGF-β mRNA、ROR-γt mRNA and IL-17A mRNA in each groups of mice
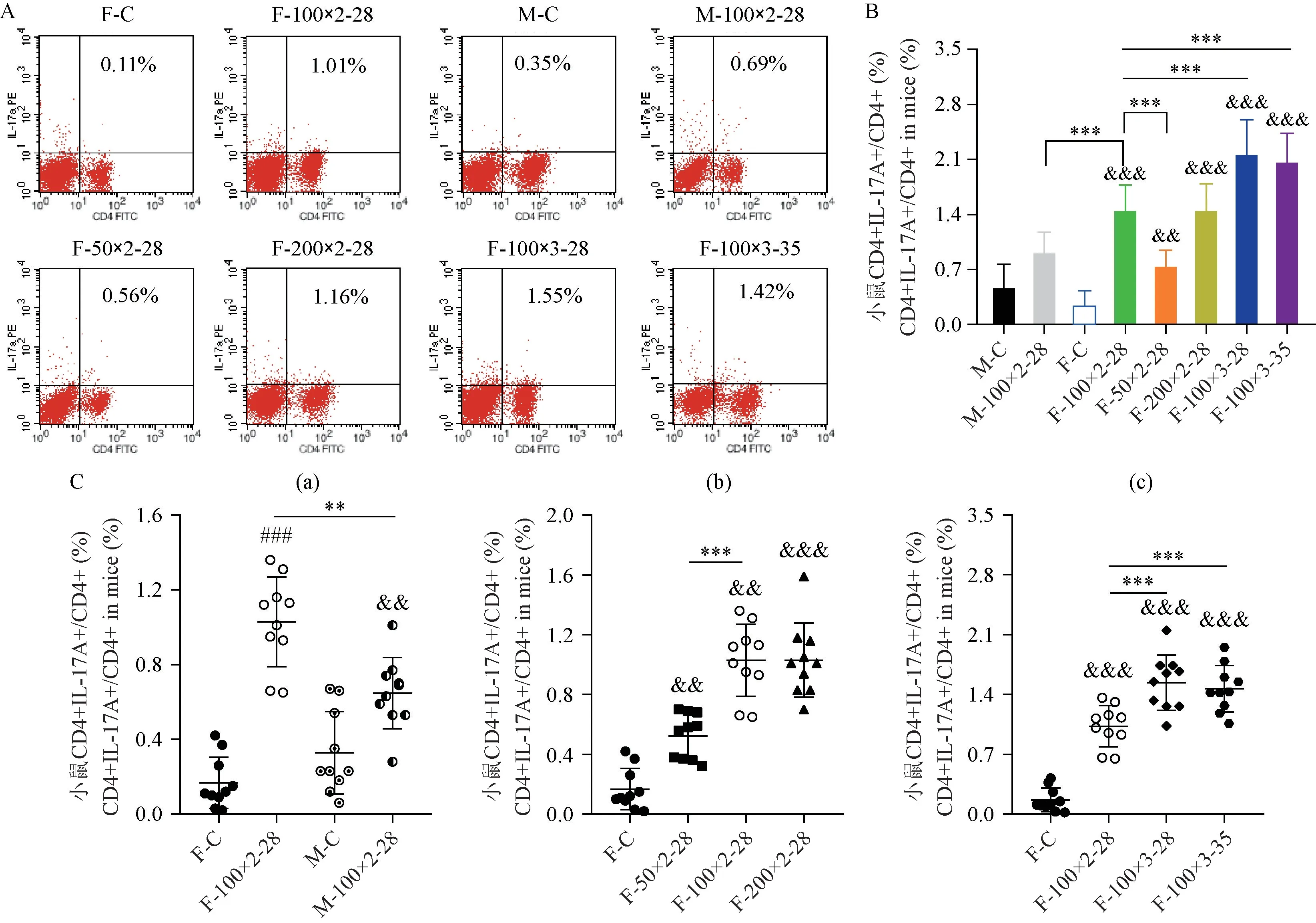
注:A:各组小鼠CD4+IL-17A+T细胞(Th17细胞)占CD4+T细胞比例的流式分析图;B:整体比较各组小鼠Th17细胞比例;C:在不同性别(a)、不同抗原剂量(b)、不同注射频次结合造模时长(c)条件下比较各组小鼠Th17细胞比例。图4 各组小鼠Th17细胞比例Note.A.Flow cytometry of the proportion of CD4+IL-17A+T cells (Th17 cells) in CD4+T cells in each group of mice.B.Proportion of Th17 cells in each groups of mice.C.Proportion of Th17 cells in different groups of mice under the conditions of different genders (a), different antigen doses (b), and different injection frequency and modeling durationunder (c).Figure 4 Proportion of Th17 cells in each groups of mice
3 讨论
EAT小鼠模型是研究人类AIT的重要手段。成功的EAT模型应具备至少2个特征:(1)病理检查可见甲状腺组织内出现不同程度的淋巴细胞浸润及滤泡破坏等表现,并可按其严重程度分等级量化评价;(2)血清学检查出现高滴度的甲状腺自身抗体[5,7]。目前公认的经典造模方法是采用甲状腺球蛋白联合免疫佐剂,诱导具有MHCH2k及H2s基因遗传背景的免疫易感鼠。由于AIT女性高发,因而EAT小鼠模型绝大多数以雌性为研究对象。既往曾有给予新生期雄性AKR小鼠注射抗IgM单抗后再诱导EAT的研究[8],也有在雄性NOD小鼠上成功诱导EAT[9]以及使用雄性BALB/c小鼠建立Graves甲亢模型的研究[10],但少有使用CBA/J雄鼠诱导EAT的先例。
与此同时,自1971年首个EAT小鼠模型建立以来[11],许多研究者曾在经典造模方案基础上做过改进。Choi等[12],Cai等[13]及Tan等[14]均选择在第0天、第14天各注射1次;Gudi等[15]选择在第0、10天各注射1次,第30天处死小鼠;而Lin等[16]则在频次及时长上均有所变化,将方案改为在第0、14、28、42天注射,第56天处死。以上均属于利用EAT模型探索药物等其他干预方式治疗效果的研究,未对改进后的EAT模型造模效果有所探讨。
因而,本实验旨在通过比较雌雄CBA/J小鼠低、中、高3种抗原剂量、以及不同注射频次结合造模时长,对小鼠EAT造模效果的影响,继而探讨最佳造模方式,并抛砖引玉为今后EAT小鼠模型的建立提供新方法及思路。
3.1 本研究中pTg+LPS常规造模法的确定
1971年Rose等[11]使用mTg联合CFA免疫雌性C3H小鼠诱导出首个EAT模型,之后1977年Esquivel等[17]采用mTg联合LPS也成功诱导出B10.BR小鼠EAT模型,1997年Damotte等[9]也在NOD小鼠上分别利用mTg及pTg成功造模。事实上,有关mTg与pTg抗原选择的讨论一直存在。一方面,国外Kong[5]认为mTg较pTg因具有更高的同源性,可能更适合诱导小鼠的EAT,但若EAT造模实验规模大,则需要制备较大量的mTg(制备30 ~
60 mg的mTg需要约300 ~ 500个小鼠甲状腺)。郭丹等[6]发现,相比pTg诱导出的EAT小鼠甲状腺滤泡上皮细胞增生显著的特点,mTg诱导出的小鼠甲状腺病理形态更接近人类甲炎表现,但相同剂量下pTg诱导组的小鼠甲炎评分显著高于mTg组,同时EAT发病率,血清TgAb滴度也明显高于mTg组,100 μg pTg组效果与200 μg mTg组相近。这证明pTg在诱导EAT成模率上并不逊于mTg;另一方面,由于mTg制备目前尚无规范化流程,蛋白纯度受实验者技术水平及实验室硬性设备条件等影响,而pTg有现售标准试剂,操作简便,利于实验复刻。故在本次实验中,我们选择了pTg作为诱导抗原。
在佐剂的选择上,选择LPS而非CFA/IFA,理由有二:其一,相较CFA,LPS不需与抗原乳化混合,可直接从尾静脉注射,诱导EAT造模均质性更好,更重要的是其副作用小;其二,Kong[5]研究已表明,LPS诱导出的EAT小鼠模型,免疫学细胞分析更适合使用脾,而CFA诱导的EAT模型则应选用淋巴结,脾较淋巴结体积更大,更方便摘取,且淋巴细胞数量更为丰富。因而在本实验中,选择了pTg+LPS法诱导8周龄CBA/J小鼠造模。在pTg及LPS剂量确定,注射频次及造模时长的选择上,延续了经典造模法中100 μg pTg配比20 μg LPS,第0、7天各注射1次,28 d 内2次造模的方案。
3.2 不同性别CBA/J小鼠EAT造模
本研究中发现,相同造模条件下,雄性CBA/J小鼠甲状腺内滤泡结构较雌鼠更完整,淋巴细胞浸润程度普遍轻于雌鼠,EAT评分也较雌鼠低。雄鼠血清TgAb滴度显著低于雌鼠,TT4水平未有明显差异。值得注意的是,雄鼠的Treg细胞比例与雌鼠相比无明显差异,但Th17细胞比例显著降低,Th17转录因子IL-17A表达量也显著低于雌鼠。Treg细胞在维持外周耐受及免疫稳态中发挥不可或缺的作用,而Th17细胞作为促炎性辅助性T淋巴细胞,其细胞比例及相关因子表达水平已被证实与多种自免疾病进程正向相关[18-21]。据此我们推测,相同抗原诱导条件下,较之雌鼠,雄性CBA/J小鼠自身免疫反应较轻,EAT模型成功率较低。此差异可能与X染色体关联基因影响免疫[22],性激素对B、T淋巴细胞的作用有关[23],具体机制还需进一步探索。
3.3 不同剂量pTg诱导雌性CBA/J小鼠EAT造模
既往郭丹等[6]曾针对不同剂量(100、200、400 μg)的mTg诱导雌性CBA/J小鼠EAT造模进行对比,发现200 μg效果最佳。本研究与其相似之处在于也分别设置了低(50 μg)、中(100 μg)、高(200 μg)3种抗原剂量进行比较,不同之处在于所研究的是pTg而非mTg,佐剂选择LPS而非CFA。相比他们每组仅5只样本量的设定,本研究增加了每组只数(10只),同时在他们原有评价EAT造模指标(甲状腺病理、炎症评分、TgAb滴度)基础上增加了对Th17、Treg细胞的流式分析及特异性转录因子表达水平的测定,这也是国内同类型研究中首次对EAT小鼠模型进行免疫学指标分析。本研究发现,与常规剂量100 μg pTg造模组相比,50 μg低剂量诱导的小鼠其甲状腺炎性浸润程度较轻,TgAb、TT4水平显著降低;200 μg高剂量组甲状腺炎浸润程度更重,但TgAb、TT4水平未有明显差异,此点与郭丹等[6]报道的200 μg组与400 μg组在TgAb水平上无显著性差异的发现一致。值得一提的是,在本研究中我们观察到使用pTg造模的小鼠甲状腺淋巴细胞浸润明显,而滤泡上皮增生并不显著,似与郭丹等[6]观察到的并不完全一致。特别值得注意的是,50 μg pTg组小鼠Treg细胞比例未有显著差异,而Th17细胞比例及其特异性转录因子RORγt及IL-17A的表达量较之100 μg pTg组均显著降低;200 μg pTg组小鼠Treg、Th17细胞比例均无显著性变化。由此我们判断,在本实验条件下pTg 50 μg 造模效果不如常规100 μg。而造成200 μg造模效果未有显著提升的原因较为复杂:可能是因抗原剂量与EAT造模效果并不成简单线性依赖关系,这也与郭丹等[6]对200 μg组与400 μg组差异不显著的解释一致;也可能是因现有EAT模型的评价标准较为简单,在本研究中我们仅通过甲状腺病理评分、TgAb、TT4及Treg与Th17细胞比例等指标,仍不能够完全贴合、动态反映、准确描摹出小鼠EAT造模过程中的差异变化;抑或是因实验中存在的各项误差而导致的。此现象后续仍值得我们深入研究。
3.4 不同注射频次结合造模时长的雌性CBA/J小鼠EAT造模
在本实验中发现,较之常规造模组,100 μg pTg在28 d 3次注射的条件下效果最优,其在甲状腺病理评分、TgAb、TT4水平及Treg、Th17细胞比例及相应转录因子表达量上均有非常显著的差异。而35 d 3次注射造模,TgAb水平显著升高,TT4未有明显差异,Treg细胞比例及Foxp3表达显著减少,Th17细胞比例及IL-17A表达显著增多,但不如28 d 3次注射的差异更显著。这可能提示,短期内增加注射造模的频次,比延长每次注射造模的间隔时间、增加造模时长的方案效果更好。
综上所述,本研究是国内首个较为系统地探讨性别、抗原剂量、注射频次结合造模时长因素对EAT小鼠造模效果影响的研究。选择雌性CBA/J小鼠、增大抗原剂量、短期内增加注射造模频次对改进EAT造模效果具有重要作用。

