C57BL/6小鼠Lewis皮下移植瘤肺转移灶的病理及超微结构观察
张娜刘学芳王自闯冯素香*张鹏飞
(1.河南中医药大学医学院,郑州 450046;2.河南中医药大学中医药科学院,郑州 450046;3.河南中医药大学第二附属医院,郑州 450046)
肺癌是中国癌症死亡的首要原因,近年来肺癌发病率和死亡率呈上升的趋势[1],肺癌死亡的最重要原因是发生单部位或多部位转移,临床常见的转移部位是骨、脑、对侧肺、淋巴结、肝等[2],广泛肺癌远处转移提示预后差,转移的器官越多,病人生存期越短,因此建立小鼠肺癌转移模型对肺癌研究具有重要意义。C57BL/6小鼠Lewis肺癌模型是进行肺癌研究的重要工具,以“小鼠Lewis”和“肺癌”为主题词在中国知网检索,可搜索出2500余条文献,该模型广泛应用于肿瘤学、药理学[3]、中药学[4]等多个领域。Lewis细胞是从小鼠Lewis肺癌中分离的细胞株,在体外传代培养后,仍然在C57BL/6小鼠体内保持高致瘤性和肺转移性。目前针对C57BL/6小鼠Lewis肺癌模型的病理和超微结构的描述多集中在皮下移植瘤[5],而对肺转移灶的病理和超微形态描述较少,本研究制备C57BL/6小鼠Lewis皮下移植瘤模型后,重点观察肺转移情况,结合光学显微镜和电子显微镜技术,从解剖学水平、组织学水平和超微结构水平对肺癌转移灶进行研究,以期为C57BL/6小鼠Lewis肺癌模型的更加广泛的应用提供科学的参考。
1 材料与方法
1.1 材料
1.1.1 实验动物
12只5周龄SPF级C57BL/6雄性小鼠,体重14 ~ 16 g,购自郑州市惠济区华兴实验动物养殖场【SCXK(豫)2019-0002】。环境温度(20 ± 2)℃,相对湿度40%,昼夜各半循环照明,饲养于河南中医药大学动物实验中心【SYXK(豫)2020-0004】。所有操作均符合河南中医药大学实验动物伦理学要求(DWLL202003222)。
1.1.2 细胞株
小鼠Lewis肺癌细胞株(Lewis lung cancer cell line,LLC)由中国科学院生命科学研究院细胞库提供(上海),细胞目录号:TCM 7。
1.1.3 主要试剂与仪器
胎牛血清(四季青,中国),DMEM培养液(Hyclone,美国),胰酶(Hyclone,美国)。游标卡尺(上海美奈特,中国),CO2培养箱(Thermo Fisher Scientific,美国),微量移液器(Eppendorff,德国),超净工作台(苏州苏洁净华,中国),分析天平(Mettler toledo,瑞士),石蜡包埋机(Leica,德国),病理组织切片机(Leica,德国),显微镜(Leica,德国),透射电子显微镜(JEM1400,日本电子,日本)。
1.2 方法
1.2.1 细胞培养
从液氮中取出Lewis细胞冻存管后,立即投入37℃水浴箱中水浴,复苏Lewis肺癌细胞,使用含10%胎牛血清的DMEM培养基吹散转移至培养瓶中,置于37℃ CO2培养箱中进行培养,待细胞生长至对数生长期时,0.25%胰酶消化收集细胞,离心去上清,加入生理盐水,使细胞悬浮,台盼蓝染色测定细胞活力,并进行细胞计数,制成每毫升1 × 107的细胞悬液,接种备用。
1.2.2 小鼠Lewis皮下移植瘤模型制备
10只小鼠右前肢腋下75%乙醇消毒,使用无菌注射器吸取上述制备的细胞悬液,沿腋前线下斜行刺入皮下,每只注射0.1 mL,制备Lewis皮下移植瘤模型。另外2只小鼠按照相同操作注射生理盐水,设为空白组。
1.2.3 移植瘤体积计算
接种后每周使用游标卡尺测量小鼠肿瘤长径(L)和短径(W),计算瘤体积,瘤体积=(L×W2/2)。
1.2.4 生存曲线的绘制
记录小鼠发生死亡的时间点,绘制生存曲线。
1.2.5 解剖学与病理学观察
将自然死亡的小鼠解剖观察肺部病变,将生存期大于35 d的小鼠脱颈椎处死,快速分离腋下瘤体与肺,冲洗血污,观察并记录双肺转移灶的形成情况,置入4%多聚甲醛中固定,经脱水、透明、石蜡包埋、切片、HE染色及封片等常规步骤处理,光镜下观察瘤体与肺病理学变化,重点观察肺部转移灶情况。同时取材2只空白组小鼠,作为对照。
1.2.6 透射电镜标本处理及观察
取出现典型肺转移的小鼠肺,取肺转移灶及周围肺组织,将组织修成体积为1 mm × 1 mm × 1 mm的小块,投入2.5%戊二醛固定液中固定4 h,PBS漂洗,1%锇酸后固定1.5 h,PBS漂洗,梯度乙醇脱水,渗透、环氧树脂812包埋、超薄切片,饱和醋酸双氧铀水溶液染色20 min,柠檬酸铅溶液染色5 min,水洗烘干后透射电镜观察拍照。
1.3 统计学分析
所有数据均采用SPSS 20.0软件进行统计分析,计量数据用平均值 ± 标准差(±s)表示,统计数据采用GraphPad Prism 5 软件进行绘图。
2 结果
2.1 移植瘤体积计算
小鼠皮下移植瘤体积变化如图所示(见图1),结果显示接种后7 d肿瘤体积较小,肉眼不可见,14 d时肿瘤生长明显,肉眼可见如花生大小的肿瘤,21 ~ 28 d时肿瘤生长迅速,肿瘤表面皮肤有破损出血现象。
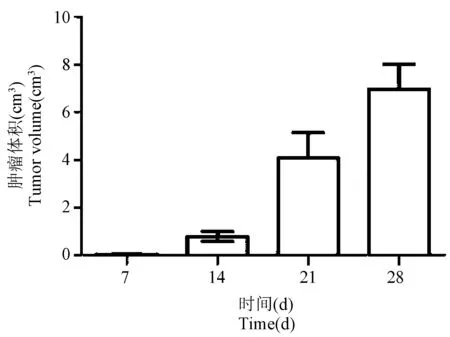
图1 小鼠Lewis皮下移植瘤体积变化曲线Figure 1 Volume change curve of Lewis subcutaneous transplanted tumor in mice
2.2 生存曲线绘制
小鼠的生存曲线如图所示(见图2)。结果显示,接种后22 d时小鼠出现死亡,22 ~ 25 d死亡2只,26 ~ 30 d死亡1只,30 ~ 35 d死亡3只,36 ~ 40 d死亡2只,截至40 d时2只存活。平均生存周期(33.00 ± 6.98)d。
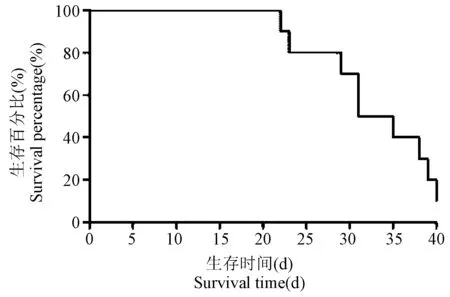
图2 Lewis皮下移植瘤小鼠生存曲线Figure 2 Survival curve of Lewis subcutaneous transplanted tumor in mice
2.3 肺转移灶成瘤情况
解剖学观察显示典型的肺转移灶形成时间在接种后35 ~ 40 d,小鼠外观被毛紊乱无光泽,弓步前行,出现典型肺转移的小鼠数量为2只,解剖学病变表现为小鼠肺表面出现暗红色的出血点或出血块,在出血块中央出现圆形半透明状的转移灶(图3A),而空白小鼠的肺为粉红色(图3B)。

注:A:皮下移植瘤组小鼠肺;B:空白组小鼠肺。图3 小鼠肺解剖学观察Note.A.Lung of mice in subcutaneous transplanted tumor group.B.Lung of mice in blank group.Figure 3 Anatomical observation of lung in mice
2.4 病理学观察
HE染色显示,在低倍镜下即可观察到肺内多处出现肺转移灶,转移灶形似圆形,或近似圆形,染色深,细胞排列紧密,与周围组织分界清楚(见图4A低倍),空白组小鼠肺组织结构正常,肺内支气管及各级分支组织结构明显(见图4B低倍)。中倍镜下观察肺转移灶内部肿瘤细胞排列紧密,可见包裹的小气道结构以及大量的新生血管,周围肺泡结构紊乱(见图4A中倍),空白组小鼠各级支气管、细支气管及分支结构组织结构正常,周围肺泡结构正常(见图4B中倍)。高倍镜下可见肿瘤细胞排列紧密,呈交织状排列,细胞核染色深,多有病理性核分裂相。转移灶内部可见新生血管,包裹的小气道上皮较矮,结构不清晰(见图4A高倍)。空白组小鼠小气道上皮结构清晰,排列紧密,周围肺泡结构正常(见图4B高倍)。
2.5 透射电镜观察
电镜下可见肺转移灶内肿瘤细胞排列紧密,细胞具有显著的异型性,大小形态不一,可见瘤巨细胞,细胞核大小、形态各异,出现巨核、双核和奇异型核,呈不对称分裂,此外肿瘤细胞之间多处可见红细胞(图5A)。周围肺组织可见典型的肺泡形态,肺泡腔、肺泡壁及肺泡上皮细胞结构清晰,肺泡壁上可见毛细血管(图5B)。肺转移灶内瘤巨细胞放大可见,细胞核异型性明显,内部出现2个核仁,胞质内富集大量的糖原颗粒,线粒体数量多(图5C)。周围肺组织可见典型的Ⅰ型肺泡上皮细胞和Ⅱ型肺泡上皮细胞(图5D)。肺转移灶内肿瘤细胞间可见细胞连接,细胞连接是相邻细胞之间的一种致密结构,电子密度高(如图5E箭头指示)。肺泡上皮细胞间可观察到大量的典型的细胞连接(如图5F箭头指示),保证肺泡壁和气血屏障的的完整性。
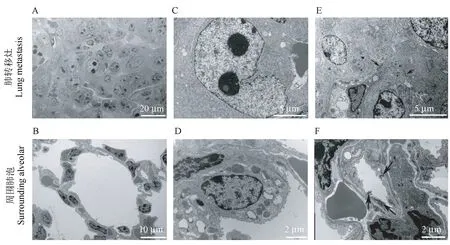
图5 Lewis皮下移植瘤小鼠肺透射电镜观察Figure 5 Transmission electron microscope observation on lung of Lewis subcutaneous transplanted tumor mice
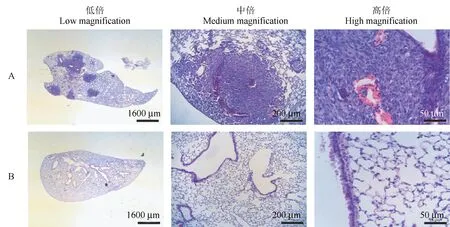
注:A:皮下移植瘤组小鼠肺;B:空白组小鼠肺;低倍:×12.5,中倍:×100,高倍:×400.图4 小鼠肺病理学观察Note.A.Lung of mice in subcutaneous transplanted tumor group.B.Lung of mice in blank group.Low magnification.×12.5.Medium magnification.×100.High magnification.×400.Figure 4 Pathological observation of lung in mice
3 讨论
皮下注射是C57BL/6小鼠Lewis肺癌模型常用的接种方法[6]。皮下注射包括前肢腋下注射和腹股沟注射,该方法操作简便,在接种部位形成典型的瘤块,可动态检测肿瘤大小,并且小鼠生存周期较长,能够进行一定周期的药理学研究[7]。马雪曼等[8]右腋下注射和右腹股沟下注射Lewis细胞,21 d时,小动物活体成像结果显示两种方法均可以发生肺转移,肺转移率分别为70%和50%。与右腋下注射比较,右腹股沟注射肿瘤生长较快,容易发生破溃,不适用于观察期较长的研究。尾静脉注射也是制备肺癌转移模型的常用方法,能够模拟肿瘤细胞经血液传播定植在特定器官的过程,具有成瘤时间短,肺转移率高(100%)的特点,缺点是小鼠的死亡率较高,能够为实验留下处理和观察的窗口期较短。故本实验采用前肢腋下注射的方法建立模型。
本实验采用前肢腋下注射Lewis细胞的方法成功构建了皮下移植瘤模型,14 d时成瘤率为100%,肿瘤14 ~ 35 d生长迅速,22 d时动物开始出现死亡,至35 d时死亡率达到50%,平均生存周期(33.00 ± 6.98)d,与马雪曼等[8]、李春艳等[9]的报道基本吻合。针对肿瘤体积不同文献报道略有不同。分析原因可能与注射细胞的活性有关,其中胰酶消化、离心、温度等条件对细胞活性都有影响,操作者在注射前使用台盼蓝染色测定细胞活力,并严格进行细胞计数。以确保结果的一致性。
解剖学研究可见小鼠肺转移灶呈圆形半透明状外观,周围有出血。文献中关于转移灶的表述通常为白色或灰白色隆起[10],与本研究的结果略有不同,分析原因可能与采样时间有关,本研究中观察的接种后35 d的小鼠肺,而文献的为接种后28 d的病变,采样时间不同,病变程度不同,当然也存在个体差异[10]。为了确定解剖学观察的病灶是肺癌转移灶,使用石蜡切片技术结合HE染色,对肺标本进行处理,光镜下可见肺转移灶近似圆形,染色深,内部肿瘤细胞排列紧密,细胞核染色深,多有病理性核分裂相,符合恶性肿瘤的特点。
本研究详细报道了肺转移灶的超微结构变化,并与周边肺泡结构进行了对比研究,电镜下肺转移灶内肿瘤细胞具有显著的异型性,细胞核出现巨核、双核和奇异型核,呈不对称分裂,符合恶性肿瘤的形态特点。此外本研究对转移灶内肿瘤细胞之间的细胞连接进行观察,细胞连接是相邻上皮细胞之间特化的区域,包括:紧密连接、中间连接、桥粒、缝隙连接4种,细胞连接使细胞之间能够沟通信息、交换代谢产物、增强细胞之间的牢固性,对细胞的增殖分化具有重要的调节作用[11]。此外,靶向细胞连接的药物在抗肺癌脑转移中发挥重要作用[12]。Lewis细胞是从小鼠肺腺癌中分离得到的体外培养株,肺腺癌是起源于上皮组织的恶性肿瘤[13],故Lewis细胞之间也存在细胞连接,如本实验中电镜下观察所见。肿瘤细胞间与肺泡上皮细胞间的细胞连接不同在于,肿瘤细胞间的细胞连接体积小,长度短,电子密度低,肺泡上皮细胞间的细胞连接体积大、长度长、多弯曲及电子密度高。肺癌肿瘤细胞间的细胞连接与上皮-间质转化有密切关系[14],自原发部位发生侵袭转移的癌细胞,细胞连接降低,细胞骨架重组,获得间质细胞的特点,具有迁移性,在到达转移器官后,通过间质-上皮转化播下新的继发肿瘤的种子[15],恢复上皮细胞黏附特性,形成肿瘤细胞之间的细胞连接。本研究观察的肺转移灶内实际为肿瘤细胞从皮下移植瘤脱离远端种植在肺部的肿瘤。
由于肺癌易发生转移的特点,研究C57BL/6小鼠Lewis肺癌转移模型具有非常重要的意义,可以为相关药物的研发提供适合的动物模型,而关于Lewis肺转移灶详细的解剖学、病理学以及超微结构的报道可为该模型的应用提供科学参考。

