动态增强磁共振成像术前评估直肠癌肿瘤出芽等级的价值
周 振 沈 浮 陆海迪 王敏杰 白辰光 王 颢 邵成伟
直肠癌是我国常见的恶性肿瘤之一,近年来我国直肠癌的发病率相对平稳,但死亡率仍呈缓慢上升趋势[1],且多数患者在诊断时已为局部进展期直肠癌(locally advanced rectal cancer,LARC)。随着现代技术与临床研究的发展,LARC患者的诊疗方式在不断进步,然而目前临床上对直肠癌的生物学行为及预后因素仍缺乏有效的术前评估手段。肿瘤出芽(tumor budding,TB)作为一种实体肿瘤独特的病理特征,代表了肿瘤侵袭进展的动态过程,在指导肿瘤临床个体化治疗中的作用日渐受到关注[2]。目前已有研究显示,TB是影响结直肠癌患者预后的重要危险因素,高级别TB的患者可能不能从新辅助治疗中获益[3]。而判断TB主要依靠对手术切除标本进行病理检查,目前尚无有效的术前检测方法评估TB等级。动态增强磁共振成像(dynamic contrast‑enhanced magnetic resonance imaging,DCE‑MRI)作为一种功能性影像学技术,可以定量反映组织的灌注情况,对肿瘤微循环状态进行在体评价[4,5]。因此,本研究拟通过分析LARC的DCE‑MRI表现以及其参数指标与TB的相关性,探讨DCE‑MRI术前评估直肠癌TB等级的诊断价值。
方 法
1. 临床资料
回顾性分析2019年10月至2021年3月期间在本院经手术病理证实的LARC患者109例,术前均行DCE‑MRI检查。纳入标准:①MRI检查后行直肠癌根治性切除术,有详细病理报告结果;②单一病灶;③所有患者术前均未行放疗或化疗。排除标准:①图像质量差(13例),如明显伪影导致病灶无法准确勾画感兴趣区(region of interest,ROI);②术前MRI检查距手术间隔时间>4周(11例);③盆腔既往其他肿瘤病史或手术史(5例);④手术切缘阳性(0例);⑤患者血管条件差,达不到DCE‑MRI检查要求流速(8例)。所有患者检查前均签署了知情同意书。
2.MR扫描方法
MR检查均采用联影uMR560 1.5T磁共振扫描仪(上海联影医疗科技有限公司,上海,中国),腹部相控阵线圈。所有患者检查前4 h禁食。常规扫描序列包括矢状面T2WI,横断面T1WI、T2WI、DWI。DCE‑MRI为横断面,扫描层面与T2WI一致,扫描参数:TR 3.24 ms,TE 1.15 ms,翻转角12°,FOV 35 cm×26 cm,矩阵156×208,层厚5 mm,层数20层;采用并行采集技术及加速因子R=2。每期扫描时间为8 s,共扫描30期,总时间4 min。全程自由呼吸。在首次扫描第1期后用高压注射器经肘静脉以3 mL/s的流率注射对比剂钆喷酸葡胺(北京北陆药业股份有限公司,北京,中国),剂量为0.2 mmol/kg,总剂量为15~20 mL,之后以相同流率注射20 mL生理盐水冲管。
3. 灌注数据测量
将DCE‑MRI得到的所有数据传送到uExceedTM功能软件进行定量分析,软件自动生成扫描范围内的伪彩图。2名医师(分别有6年及8年工作经验)对照T2WI图像,独立观察病灶的形态、大小、部位、浸润深度、强化方式、周边侵犯等表现后,在正性增强积分(positive enhancement integral,PEI)伪彩图上选取病灶实质部分最大、强化明显的区域放置3个大小一致的圆形ROI,测量以下灌注参数。①最大上升斜率(maximum slope of increase,MSI);②平均增强时间(mean time to enhance,MTE);③正性增强积分(positive enhancement integral,PEI);④达峰时间(time to peak,TTP)。各参数取平均值作为代表病灶整体的灌注参数。获得时间-信号强度曲线(time‑signal intensity curves,TIC),分为流入型、平台型及流出型。应注意的是肠壁病灶形态往往欠规则,周围往往有炎症反应或血管侵犯造成肠壁与周围脂肪分界欠清,且伪彩图上病灶边界不够光整,所以放置ROI时需要避免过于贴近病灶边缘造成测量不准确(图1)。
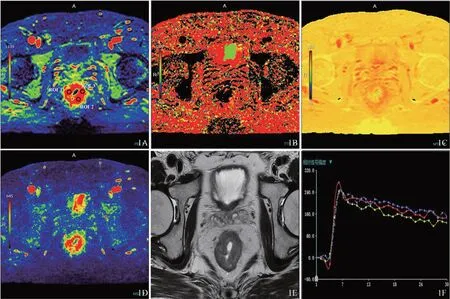
图1 DCE‑MRI伪彩图及ROI示意图
4. 相关病理分析
根据国际肿瘤出芽共识会议(International Tumor Budding Consensus Conference,ITBCC) 标准,TB是存在于肿瘤浸润前缘、散在的呈未分化状态的单个肿瘤细胞或4个细胞构成的小灶状肿瘤细胞群[6]。手术标本常规固定、石蜡包埋切片后进行苏木精-伊红染色,封片后显微镜下观察。在低倍镜下寻找肿瘤出芽最密集的部位,转为高倍镜视野下选取10个视野进行出芽计数。出芽等级用Bd来表示,参照ITBCC标准根据出芽数分为Bd 1级(0~4个出芽)、Bd 2级(5~9个出芽)、Bd 3级(≥10个出芽),分别代表低、中、高水平TB[6]。本次研究划分为低-中水平TB组(Bd 1+2级),以及高水平TB组(Bd 3级)。
5. 统计学分析
采用SPSS 19.0软件进行统计分析。呈正态分布的计量资料以xˉ±s表示,两组间比较采用独立样本t检验;计数资料以例数和百分数表示,两组间比较采用χ2检验。非正态分布的计量资料以中位数(四分位数间距)表示。2名医师独立测得数据采用组内相关系数(ICC)进行一致性检验。最终灌注参数取2名医师所得数据的均值,由于方差不齐,各参数与出芽等级的相关性分析采用Spearman秩相关,组间差异采用Mann‑Whitney或Kruskal‑Wallis秩和检验。根据病理出芽等级绘制ROC曲线,计算各参数的ROC曲线下面积(AUC),分析准确率、灵敏度、特异度、阳性似然比、阴性似然比、阳性预测值、阴性预测值。P<0.05为差异有统计学意义。
结 果
1. 临床资料
最终共纳入72例LARC患者,男62例,女10例,年龄(60.7±11.8)岁。其中Bd 1级、2级、3例,3级7例。2组性别、年龄无统计学差异(P>0.05)。DCE‑MRI可见病灶强化,高水平组TIC曲线流入型及平台型4例,流出型3例;中-低水平组流入型及平台型53例,流出型12例,2组间差异无统计学意义(P>0.05)。
2.灌注参数的一致性检验
2名医师测量得到的MSI、MTE、PEI、TTP各参数ICC(95%CI)值分别为0.724(0.523~0.850)、0.980(0.960~0.990)、0.803(0.647~0.895)、0.743(0.551~0.860),参数MTE与PEI的一致性高,优于MSI与TTP。
3.灌注参数与直肠肿瘤出芽等级的关系
TTP和MTE参数值与TB等级呈负相关趋势,但无统计学意义(P>0.05),而PEI和MSI参数与TB等级呈正相关性,高水平组大于中-低水平组,具有统计学意义(ρ分别为0.452、0.340,均P<0.05,表1)。进一步比较各参数组间差异,结果显示不同TB分级的患者MSI及PEI参数水平差异有统计学意义(P<0.05,表2,图2)。
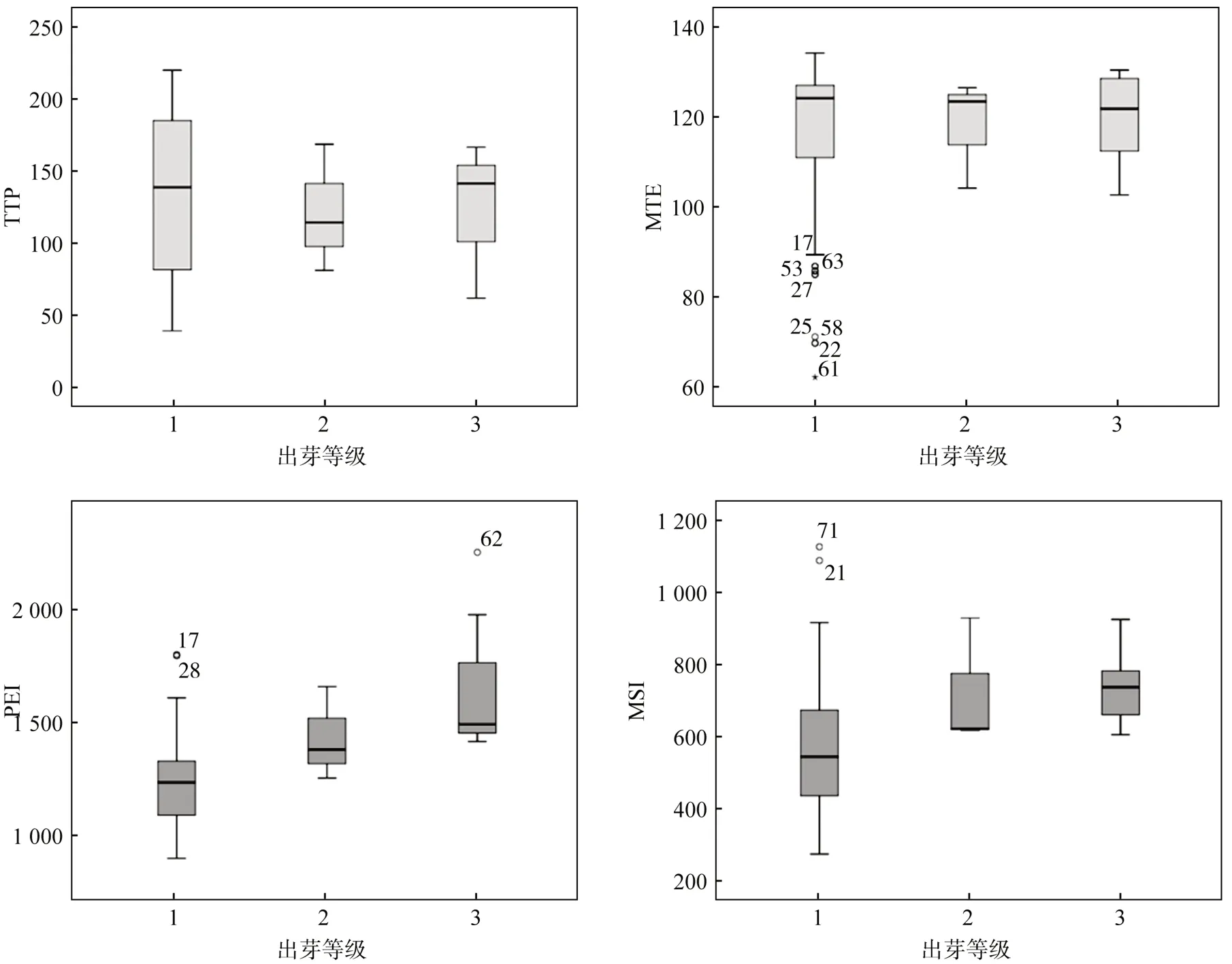
图2 DCE‑MRI参数与肿瘤出芽等级的相关性
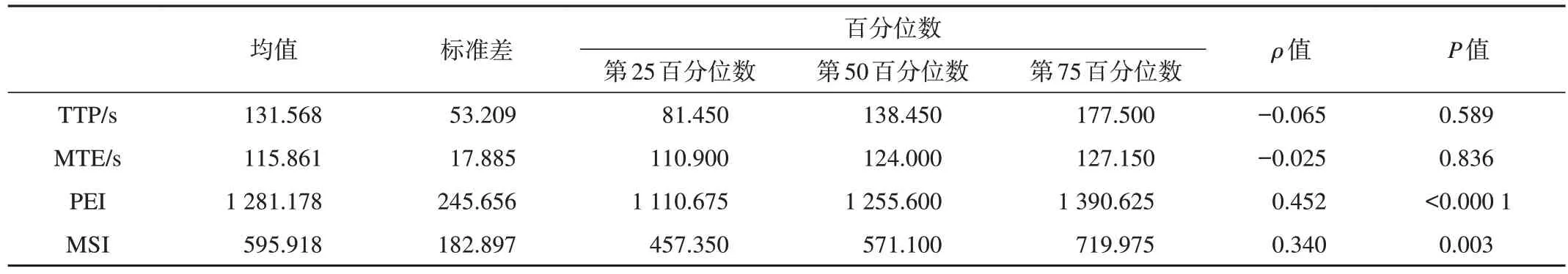
表1 各灌注参数值与肿瘤出芽等级的相关性分析
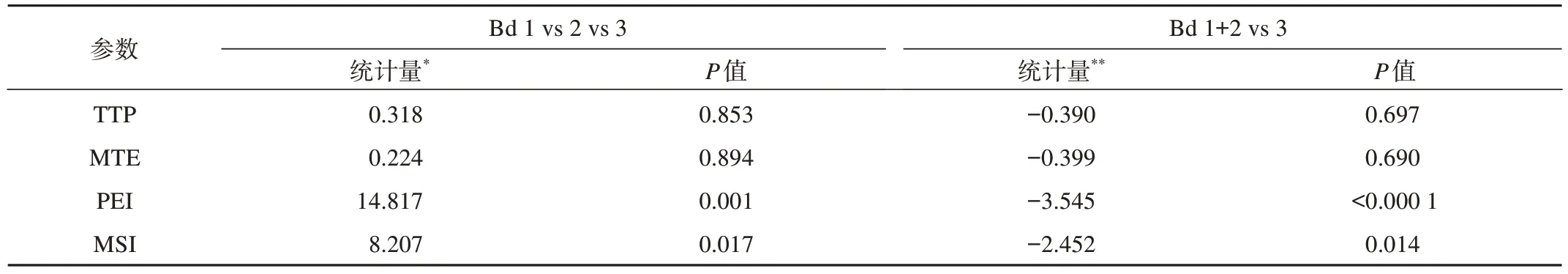
表2 各灌注参数值与肿瘤出芽等级的组间比较
4.灌注参数的诊断效能
PEI与MSI参数的ROC曲线分析均表现出比较好的诊断效能,AUC分别为0.910(95%CI 0.836~0.984)及0.784(95%CI 0.665~0.902),准确度分别为0.875与0.639(图3,表3)。
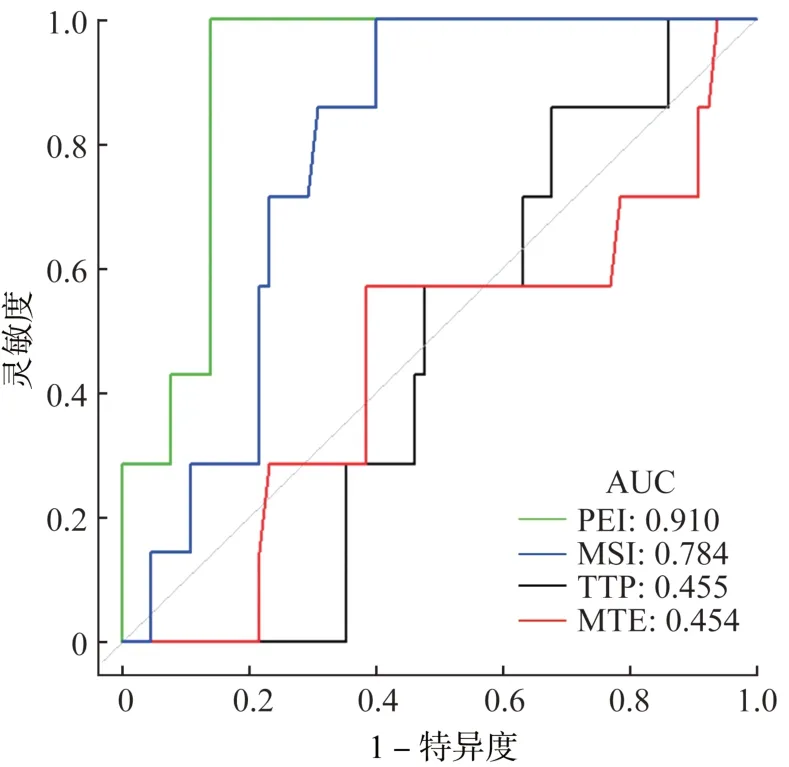
图3 DCE‑MRI参数ROC曲线
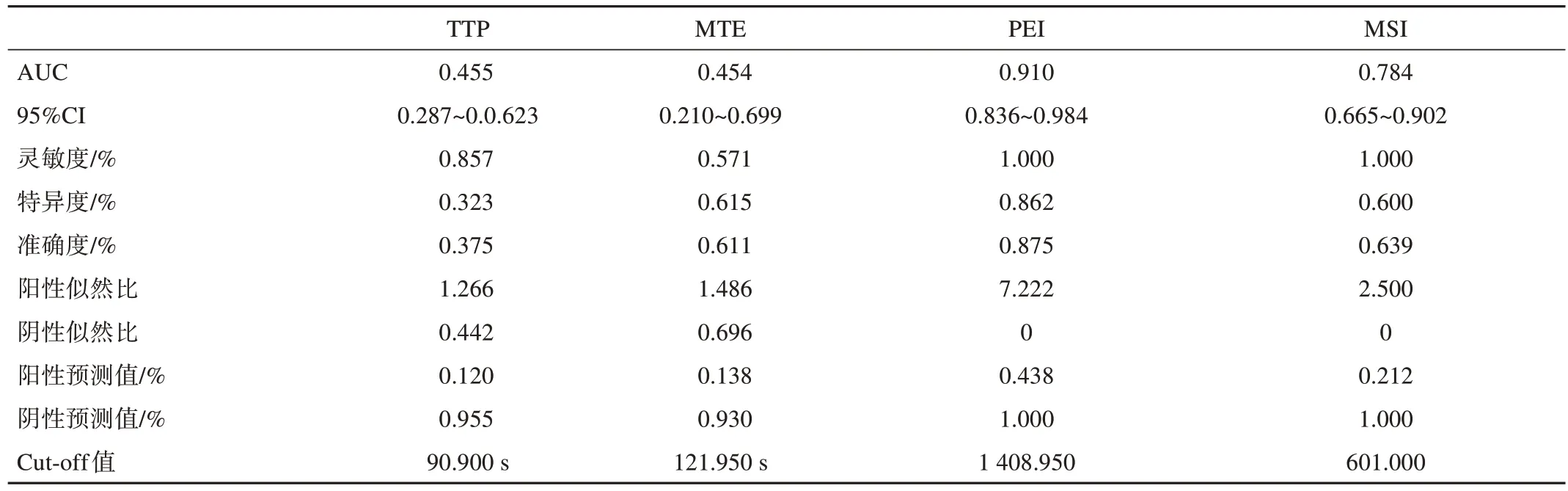
表3 ROC曲线分析
讨 论
肿瘤出芽是指存在于肿瘤浸润前缘出现与肿瘤组织分离的单个或4个肿瘤细胞构成的癌巢样肿瘤细胞聚集,具有上皮-间质转化及肿瘤干细胞的特性,是肿瘤局部浸润或转移的始发阶段。肿瘤细胞可以通过周围组织间隙渗透到小血管中,并通过血液循环形成远处转移。越来越多的研究表明TB与肿瘤的进展密切相关,是肿瘤组织恶性程度高、预后不良的标志。较高的TB等级与较高的转移、复发率和较差的生存率相关。LARC患者如果在新辅助治疗前检测到高级别TB,这是新辅助治疗反应的一个强有力的不良预后因素,也是接受辅助化疗的指征[6-12]。因此,直肠癌TB等级的评估对指导临床个体化治疗意义重大。
但是目前TB等级依靠术后病理检查确定,且只用来评估未接受新辅助治疗的术后标本,尚无有效的治疗前检查方法进行TB等级的评估。DCE‑MRI作为一种功能成像技术,通过参数分析组织毛细血管水平的血流灌注情况,对组织微循环灌注特征进行在体评价[4-5]。目前多名学者证实这个特定的增强模式可以对直肠癌的异质性及侵袭性进行更精确的定量评估[4-5,13-14]。DCE‑MRI通过静脉团注顺磁性钆造影剂后快速重复多期扫描T1加权序列,得到造影剂通过组织通路引起的信号强度变化,最后借助后处理软件生成TIC曲线及灌注参数。一般采用3种方式进行分析:①定性分析(通过观察TIC曲线的形态);②定量参数分析;③半定量参数分析(从TIC提取转化得到)。与定量方法相比,半定量分析需要较少复杂的软件算法,模型直观简单,参数更容易获取和重复[13]。灌注参数MET、TTP、PEI及MSI就是基于此的半定量参数,综合反映了肿瘤的血容量和血流量[15]。影响肿瘤动态增强的因素有很多,如肿瘤新生血管的密度及通透性,肿瘤组织血液灌注水平以及细胞外组织扩散间隙等[5]。半定量参数中MET反映开始增强的平均时间;TTP代表增强后信号达到峰值的时间;正性增强积分PEI为动态增强各期相内TIC曲线下面积的积分,反映了肿瘤组织微循环的相对血容量;MSI代表增强后信号升高的最大斜率,反映了组织微循环的血流量[16]。
由此我们提出假设,DCE‑MRI能够一定程度地反映肿瘤组织的微循环情况,进而可以用于评估直肠癌的TB等级。研究发现,高水平TB组的TIC曲线流入型及平台型4例,流出型3例;中-低水平TB组的流入型及平台型53例,流出型12例,但2组间无明显统计学差异(P>0.05)。分析灌注参数结果发现TTP和MTE与TB等级呈负相关趋势,但无统计学意义,而PEI和MSI与TB等级呈正相关,高水平组大于中-低水平组,组间差异具有统计学意义(P<0.05)。此外,灌注参数PEI和MSI判断是否为高水平TB的AUC较大,并具有较高的灵敏度和特异度,综合诊断效能优于其他两项参数。可能的机制是因为TB水平高的病灶前缘肿瘤新生血管丰富且结构异常,管径减小,体现为组织相对缺氧[17-18],平均增强时间与达峰时间相对延迟,表现为TTP和MTE值与TB等级有负相关趋势,但特异度不高。除了肿瘤新生血管的通透性改变外,TB水平高代表肿瘤侵袭性更大,其细胞形态和组织结构上的异型性更大,核分裂象更多,肿瘤细胞密度高,代谢需要更多的血液灌注,使对比剂流入增多增快,而肿瘤内流入的血容量、血流量与PEI和MSI值呈正相关,因此这两个参数判断TB等级的诊断效能较好。
本研究仍存在以下局限性:①局部进展期直肠癌ROI的选取对灌注参数的测量非常重要,位于肠壁的病灶形态有时非常不规则,而周围渗出及血管侵犯等造成病灶边缘毛糙分界欠清,同时DCE‑MRI的空间分辨率有限,沿肿瘤边界勾画整体ROI有可能会因包含了非肿瘤区域而使测量系统误差增大,测量一致性降低,因此我们采用多次测量圆形ROI后取平均值。②本研究纳入局部进展期的直肠癌患者样本量相对较少,不同出芽等级的病例数量分布不均一,今后还需要扩大样本量进一步统计分析。③目前尚无公认的标准化DCE‑MRI参数获取模式,各研究中心所得数据缺乏可比性,没有操作性强的统一阈值,有待于未来进一步的多中心研究。
综上所述,DCE‑MRI能反映LARC的微循环差异,其参数指标PEI和MSI与肿瘤出芽等级之间具有相关性,可以用于肿瘤出芽等级的术前定量分析。

