帕金森病脑灰质核团微结构变化的DKI及NODDI成像研究
阿卜杜热合曼·阿卜力米提 蒋 爽 邵 华 王少彧 王云玲 丁 爽
帕金森病(Parkinson's disease,PD)是以静止性震颤、初始运动缓慢、僵硬和全身姿态不稳为特征的常见神经退行性疾病[1]。PD患者的运动症状主要归因于黑质致密部多巴胺能神经元变性引起的纹状体多巴胺能缺失,细胞的丧失导致纹状体运动区的多巴胺严重枯竭,其中黑质到壳核的投射受到的影响最大[2]。PD的病理生理学和病理学研究表明,黑质内神经元性破坏是导致脑干萎缩的主要原因,提示核内存在微结构改变,病理学研究也报告了皮质和基底节水平的神经性改变[2-3]。PD的诊断主要依据病史、临床症状及对多巴胺替代药物治疗的反应性,而研究发现脑灰质核团微结构变化PD症状及病程存在一定的相关性,但目前仍缺乏特异敏感的脑深部微结构变化的测量方法。
弥散峰度成像(DKI)及神经突方向离散度和密度成像(NODDI)是基于磁共振弥散成像(dMRI)上发展的MR新序列,能够无创地检测组织微观结构的完整性及复杂性。本研究旨在研究PD病患者脑灰质核团的微结构变化及其与疾病进展的关系,探讨其在诊断PD中的临床应用价值。
方 法
1. 临床资料
搜集本院神经内科确诊的原发性PD患者24例,均符合英国脑库PD的临床诊断标准[4]。由临床神经内科医生诊断为原发性PD,并且排除继发性PD综合征及PD叠加综合征患者;同时所有患者均经常规MRI检查排除脑梗死、出血、其他颅内病变的患者。临床Hoehn‑Yahr分级显示,早期(Ⅰ~Ⅱ级)PD患者10例,中晚期(Ⅲ~Ⅳ级)的PD患者14例。选择性别比例及年龄与PD组相匹配16名健康志愿者作为对照组。纳入标准:①典型临床症状,疾病呈进行性发展;②本次检查前均未接受PD手术,能够耐受头颅MRI检查。本研究经本医院伦理委员会批准。
2.MRI扫描方法
所有受试者均在Siemens 3.0 T MRI仪上采用8通道头颈联合相控阵线圈行颅脑扫描。所有受检者在常规MRI序列基础上进行以前、后联合线及小脑下缘、顶叶为基线的轴位DKI及NODDI序列检查。DKI序列扫描参数:TR=5 100 ms,TE=98.0 ms,FOV=220 mm×220 mm,层厚4 mm,层间距30%,层数25层,每层采集30个梯度方向(b=0、1000、2 000 s/mm2),采集时间为537 s。NODDI序列扫描参数:TR=3 900 ms,TE=111.0 ms,FOV=220 mm×220 mm,层厚5 mm,层间距30%,层数20层,每层采集30个梯度方向(b=3 000 s/mm2),采集时间为515 s。获取DKI及NODDI图像数据并传至工作站。
3. 图像分析
将DKI序列采集图像导入DKE软件,NODDI序列采集得到的DICOM文件转换成4dNIfTI文件,使用NODDI编程软件进行后处理,分别获取DKI、NODDI图像的各功能参数值图像。由2名高年资医师用多边形工具手工勾画双侧黑质、红核、壳核、丘脑、苍白球及尾状核作为ROI区对图像进行绘制(图1)。分别记录各核团DKI参数各向异性分数(FA)、平均扩散率(MD)、平均峰度(MK),NODDI参数神经突内体积分数(Vic)、神经突方向离散度(ODI)及各向同性间隔的体积分数(Viso),并取平均值。
图1 典型病例影像
4. 统计学分析
所有数据采用SPSS26.0软件包进行统计学处理。所有受试者参数值均以表示。采用独立样本t检验比较PD组和对照组间参数值差异。采用单因素方差分析比较对照组、早期和中晚期PD患者间参数值差异,组间比较采用LSD法。临床Hoehn‑Yahr分级与各核团参数值的相关性采用Spearman相关分析。以P<0.05认为差异有统计学意义。
结 果
1.PD组和对照组基本资料比较
参与本研究的PD患者(PD组)与志愿者(对照组)间性别比和年龄的差异无统计学意义。详见表1。
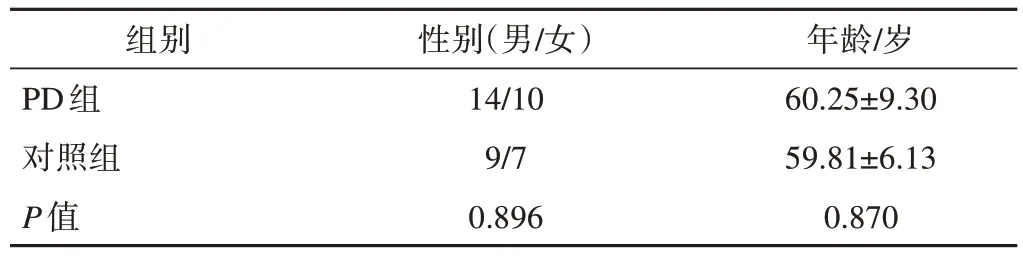
表1 PD组与对照组基本资料
2.2 PD组和对照组参数的比较
与对照组相比,PD患者双侧黑质与壳核Vic、ODI值降低,差异有统计学意义(P<0.05),其中黑质与壳核Vic值显著低于健康对照组(P<0.01)。详见表2。

表2 PD组和对照组参数值的比较
3.早期、中晚期PD患者与对照组的参数值的比较
对照组、早期和中晚期PD组双侧黑质及壳核Vic与ODI值呈递减趋势,对照组与中晚期PD组间具有统计学意义(P<0.05),对照组与早期PD患者组间无统计学意义(P>0.05)。详见表3。

表3 早期、中晚期PD患者与对照组参数值的比较
4.PD患者临床Hoehn⁃Yahr分期与各核团参数值的相关性分析
PD患者临床Hoehn‑Yahr分期与黑质及壳核的Vic、ODI值存在负相关 (r=0.481,0.455,0.414,0.528;P<0.05)。
讨 论
PD患者的病理过程改变包括黑质多巴胺能神经元的变性、缺失,残存神经元内嗜酸性包涵体形成,变性神经元周围小胶质细胞激活、聚集及损伤神经元的修复等[2-3]。病理研究已证实PD患者存在皮质、基底节和中脑3个水平的脑萎缩;病理改变最先出现在脑干,经过边缘系统,最终出现在大脑皮质。
DTI技术已被用来检查黑质纹状体变性[5];然而,先前的研究未能证明足够的临床诊断准确性和可靠性。这可能是由于DTI的局限性,其中包括:①活体组织中水分子的弥散呈非高斯分布;②尽管各向异性分数(FA)很敏感,但不能用来确定PD在黑质及基底节水平的具体病理变化[6]。新兴的DKI及NODDI被认为能够克服这些局限性。DKI是一种基于水分子非高斯分布弥散特性的成像技术,与DTI技术相比,它引入峰度的概念,对灰质核团或白质交叉纤维等相对各向同性组织的检测更加敏感和准确[7]。NODDI可以通过估计神经突内容积比来反映神经突的密度,估计神经突方向离散度来反映神经突方向的离散程度,将弥散成像的应用从白质扩展到灰质微观结构,具有很强的临床转化价值[8]。
本研究通过DKI及NODDI技术对PD患者脑深部灰质核团疾病特异性结构变化进行研究。首先,本研究发现PD患者与对照组相比,黑质与壳核的Vic、ODI值显著降低。这与Kamagata等[6,9]、刘伟星等[10]的研究结果相似。PD的特征是多巴胺能神经元从黑质致密部投射到纹状体,基底神经节输入到壳核,壳核从黑质接受多巴胺。Vic、ODI分别被认为可以反映神经突起密度及纹状体中棘神经元树突结构的变化。组织病理学研究表明,PD发作时多达70%的多巴胺能投射神经元已经丢失,黑质及壳核的Vic减少反映神经突起密度的降低,ODI的减少可能反映了纹状体中棘神经元树突结构的改变(如树突长度减少和棘丢失),这与组织病理学研究结果相一致,证实了PD患者除细胞破坏外,也存在形态学结构的改变。其次,通过分析对照组、早期和中晚期PD患者发现,黑质及壳核Vic、ODI值呈递减趋势,中晚期黑质和壳核中的Vic和ODI值较对照组降低;此外,黑质与壳核的Vic和ODI值与H‑Y分级呈负相关。这可能有助于确定疾病严重程度及评估疾病进展。
先前研究证实DKI技术对PD患者诊断的高度准确性,然而各项研究结果并不一致。Kamagata等[6]和Gao等[11]研究发现,与健康对照组相比,PD患者壳核FA值及丘脑MK值降低;Zhang等[12]认为,PD患者黑质MK值较对照组升高,并与疾病严重程度呈正相关;然而Guan[13]等的研究显示,黑质与晚期红核MK值较对照组降低,FA与MD值无显著差异。与先前研究不同的是,本研究中PD患者与健康对照组各核团DKI参数FA、MD及MK值均无显著性差异,与H‑Y分级也无显著性差异。这可能是因为先前研究获取的是各核团单侧参数,而本研究采用各核团双侧平均值进行研究,而且纳入的病例数较先前研究少。此外,也可能是因为研究所使用MRI机型或磁场强度、线圈、勾画核团ROI范围、序列参数差异级病例纳入标准差异导致结果的不同。多种不同研究结果的出现,需要通过多中心合作和大规模研究对结果加以进一步验证。
本研究中,NODDI技术对帕金森病的诊断与评估疾病严重程度及进展方面较DKI技术显示出较高的诊断价值。DKI技术的参数是非特异性的,其参数的变化很难解释,而NODDI技术通过方向离散圆柱模型和Watson分布可以推断和量化神经突(轴突和树突)的方向和结构,能够克服DKI技术的局限性[6]。因此,NODDI技术可能更适用于神经退行性疾病的临床研究。目前,在国内外比较这两种技术的研究甚少。以后更多的研究可能会比较NODDI及DKI技术作为PD患者诊断及临床分期生物学标志物的价值。
本研究存在一定的不足之处:①由于PD的诊断未经组织病理学证实,存在纳入不严的可能性;②NODDI及DKI图像分辨率较低,准确勾画各核团较困难,在一定程度上影响本研究结果的准确性;③本结果未考虑PD患者症状的偏侧性。
总之,NODDI技术对黑质和壳核的分析结果可能反映了PD患者疾病演变过程中黑质多巴胺能神经元的变性、缺失、黑质纹状体通路轴突及树突结构变性等病理学过程。黑质和壳核中的Vic和ODI值有助于PD患者的早期诊断,并可能有助于确定疾病严重程度及评估疾病进展。

