支持向量机算法与弥散加权成像在鉴别小肝癌和异型增生结节中的比较
张 娟 李 笛 冯亚园 霍 雷 吴钰娴 刘一萍 贾宁阳
原发性肝细胞肝癌(HCC)是最常见的恶性消化系统肿瘤之一,约80%发生在肝硬化基础上,肝硬化HCC的发生是由再生结节、异型增生结节到早期HCC、进展期HCC的多步骤进展[1]。根据AASLD(American Association for the Study of Liver Diseases)的标准,CT或MRI出现“快进快出”(动脉期出现明显强化,门静脉期或延迟期快速清除),即可诊断为HCC[2]。然而,这种典型的强化方式并不是经常出现,对于≤2 cm的小肝癌(sHCC),仅有60.5%表现为“快进快出”[3]。肝脏影像报告及数据系统(Liver Imaging Reporting and Data System,LI‑RADS) 是一种肝脏影像检查规范及诊断分类系统,专门针对肝癌高风险人群,对该类患者的图像作出标准化解释、报告和数据收集;但对于≤2 cm的病灶有时很能难定性,尤其是出现不典型强化时。磁共振弥散加权成像(diffusion weighted imaging,DWI)在检测小肝癌方面具有较高的灵敏度[4];但是DWI的特异度不足,有研究表明部分不典型增生结节在DWI上表现为高信号从而出现假阳性[5-6]。因此,单纯的影像诊断对于肝硬化HCC的鉴别仍存在困难,特别是对于小结节,由于不同个体之间的影像学特征重叠,特别是异型增生结节和分化良好的HCC之间的影像学特征重叠,有时很难通过影像学表现确诊。
支持向量机(support vector machine,SVM)是机器学习最经典的算法之一,SVM是针对二分类任务设计的,在解决小样本、非线性问题上具有独到的优势。Jihye Baek运用SVM区分肝脏状态的不同状态,包括脂肪肝、肝纤维化和炎症[7]。Liu等[8]报道基于MRI的SVM模型可在术前区分混合型肝癌(combined hepatocellular‑cholangiocarcinoma,cHCC)与 HCC和 肝 内 胆 管 细 胞 癌 (intrahepatic cholangiocarcinoma,ICC),获得较好的灵敏度和特异度。此外,SVM在预测肝癌病理分化程度中也体现出较好的效能[9]。由此可见,SVM在肝脏疾病分类中具有一定优势。然而,目前尚未见到使用SVM算法鉴别sHCC与异型增生结节(dysplastic nodules,DNs)的有关研究。因此,本研究探讨基于MRI的SVM在鉴别sHCC与DNs中的诊断价值。
方 法
1. 研究对象
该回顾性研究由海军军医大学第三附属医院的机构审查委员会和伦理委员会批准,研究免除签署患者知情同意书。我们回顾性收集了2015年1月至2020年1月期间接受肝脏MRI增强检查患者。纳入标准:①结节直径≤2 cm且>1 cm;②经手术切除病理证实为sHCC或DNs;③术前无任何与HCC相关治疗史,如肝切除、肝动脉化疗栓塞术(transcatheter arterial chemoembolization,TACE)、射频消融、免疫治疗、化疗与放疗等;④行肝脏肿瘤手术切除者,且完整的组织病理学描述。排除标准:①年龄>18岁或>80岁;②MRI扫描图像质量不清晰;③术后病理为其他肿瘤,如肝内胆管细胞癌、混合型肝癌等;④肝细胞癌伴门静脉癌栓或其他浸润者。根据纳入标准与排除标准,最终共有70例患者[男性58例,女性16例;中位年龄56岁(范围:31~74岁)]入组,70个肝结节(40个sHCC,30个DNs)被纳入研究。
2.MRI检查方法
检查采用Signa Inifinity Twin Speed 8通道体部线圈1.5 T扫描仪扫描(美国GE公司)。T1加权成像采用单独屏气快速扰相梯度回波(fast spoiled gradient‑echo,FSPGR)序列(时间16~20 s)。T2加权成像横断面扫描采用快速旋转回波(fast spin‑echo,FSE)附加脂肪抑制序列(时间120~180 s)。DWI采用自旋回波‑回波平面成像 (spin echo‑echo planar imaging,SE‑EPI)序列。三期动态增强扫描使用的造影剂为钆喷酸葡胺,采用高压注射器,总量为0.1 mmol/kg,流率为2.0~3.0 mL/s,经肘静脉注入造影剂后20~25 s行动脉期扫描,55~65 s扫描,120~160 s延迟期扫描。
3. 图像分析
影像图像分别由2名工作经验丰富的主治医师阅片,意见不统一时共同讨论决定。肝结节的信号特征定义为等信号(与肝实质信号相等)、低信号(低于肝实质信号)、高信号(高于肝实质信号)。记录每个结节DWI及动态增强(动脉期、门脉期、延迟期)的信号特征。
4. 支持向量机
(1)图像分割:将增强扫描后动脉期、门脉期、延迟期的CT图像传至ITK‑SNAP 3.6.0软件,由2名具有5年工作经验的医生手动勾画感兴趣区(region of interest,ROI)。
(2)提取特征:取一阶灰度特征,形状特征、纹理特征和小波变换特征共851个特征。一阶特征可以提供像素值强度在ROI内的空间分布情况,并用于分析图像特征。形状特征主要是对结节三维大小与形状的描述,与ROI中的灰度强度分布无关。本文分析了形状特征、一阶特征、5种类型的纹理特征,并且基于一阶和二阶特征,应用小波滤波,获得了鲁棒性较强的高阶统计特征。
(3)特征筛选:采用LASSO回归方法对851个特征进行特征筛选,如图1所示。最终筛选出84个特征和其系数,LHL、LHH、HLL、LLH、HLH、HHH、HHL、LLL为小波变换提取特征,表示为在3个维度中的每一个维度应用高通(H)或低通(L)滤波器的组合变换后,进而提取一阶统计和纹理特征。
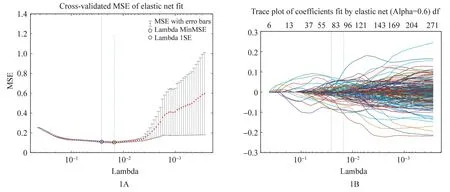
图1 基于LASSO的特征筛选
(4)基于支持向量机的分类:支持向量机(SVM)及其扩展是一类最成功的机器学习方法,并已被广泛应用于各个应用领域。实际上,SVM的目的是根据最大边距原则寻找最优超平面,但忽略了半径最小化,因此存在着较大泛化误差,其范围是半径与边距之比的函数,即半径‑边距误差界。基于本实验采用基于特征变换的F‑SVM(F‑feature‑transportation)算法建立分类模型,该方法将特征变换与SVM进行联合学习,进行了半径最小化减少了SVM的泛化误差,提高分类性能。本研究随机抽取70%作为训练集,30%作为测试集。
5. 统计学分析
采用SPSS 26.0统计分析软件进行统计学分析。采用独立样本t检验比较sHCC与DN组间年龄的差异,采用卡方检验比较sHCC与DN组间性别、甲胎蛋 白 (α ‑fetoprotein,AFP)、 异 常 凝 血 酶 原(prothrombin induced by vitamin K absence or antagonist‑Ⅱ,PIVKA‑Ⅱ)、Child‑Pugh分级、肝炎以及信号特征(DWI、动脉期、门脉期、延迟期)的差异,P<0.05认为差异具有统计学意义。采用受试者工作特征(receiver operating characteristic,ROC)曲线分析计算曲线下面积(area under curve,AUC)。样本以病理学为金标准,计算MRI信号特征及支持向量机的灵敏度、特异度、阳性预测值和阴性预测值。
结 果
1. 一般资料结果
本组70例患者中,40例为<2 cm的小肝癌,30例为异型增生结节。一般资料包括性别、年龄、实验室指标AFP、PIVKA、Child‑Pugh分级以及肝炎情况。其中sHCC中男女比例5.7∶1,DNs的男女比例4∶1。年龄:sHCC组为 (55.4±1.5) 岁,DNs组为(8.7±1.7)岁。sHCC组AFP、PIVKA水平升高分别为18例、13例,DNs组分别为7例、5例。在Child‑Pugh分级中,sHCC组中A级38例、B级2例,DNs组中A级30例、B级0例。sHCC组中乙型肝炎患者38例,丙型肝炎患者1例,酒精性肝炎患者1例;DNs组中乙型肝炎患者27例,丙型肝炎患者3例。具体见表1。
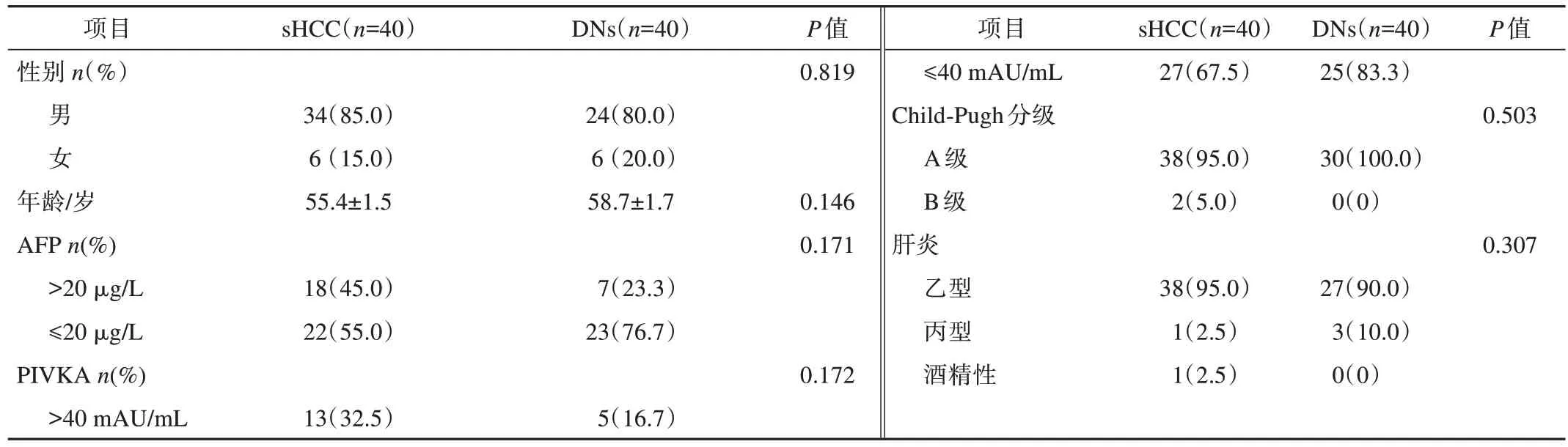
表1 一般资料
2.MRI信号特征
将MRI信号分成低信号(低于临近肝实质)、等信号(等于临近肝实质)、高信号(高于临近肝实质),分析sHCC与DNs两组间的DWI、动脉期、门脉期、延迟期的信号特征,结果显示两组间均具有统计学差异(P<0.05,表2)。在DWI中信号特征中,其中sHCC组有39例呈高信号(95.5%),1例呈等信号,DNs组18例呈等信号(60.0%),12例呈高信号(图2和图3)。

图3 典型病例2影像
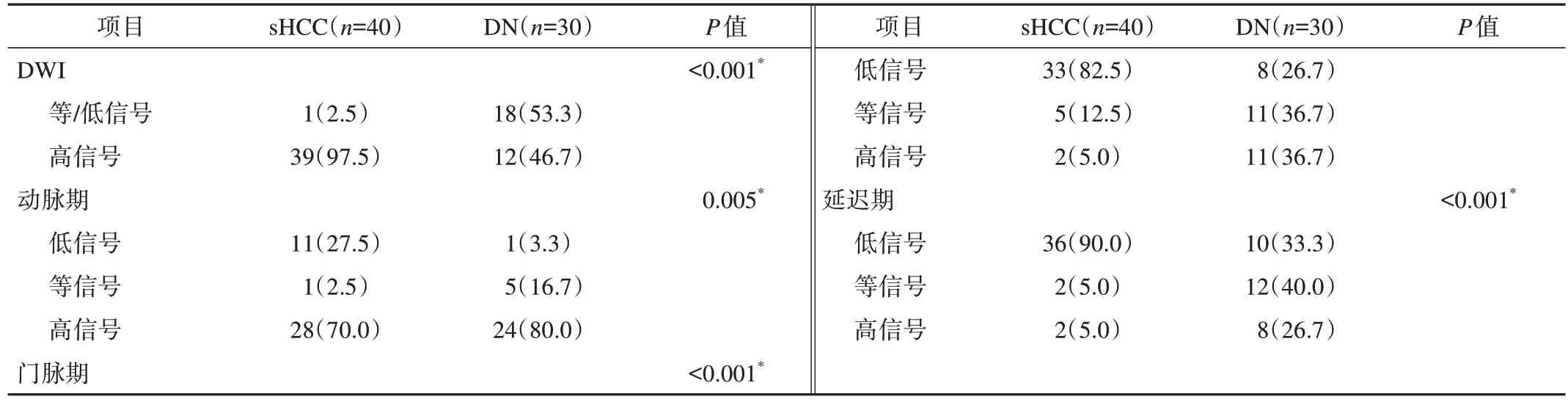
表2 MRI信号特征的比较结果 n(%)
图2 典型病例1影像
3.MRI信号特征与支持向量机算法的诊断效能比较
DWI和SVM用于区分SHCC和DNs的诊断性能如表3所示。图4显示了两种方法的ROC曲线。SVM的曲线下面积(AUC 0.945,95%CI 0.858~0.987)高于DWI(AUC 0.788,95%CI 0.673~0.876)。与DWI相比,基于MRI的SVM具有诊断更高的灵敏度(100.0%,95%CI 90.3%~100.0%)和特异度(92.6%,95%CI 75.7%~99.1%)。总的来说,基于MRI的SVM具有更高的诊断性能(AUC 0.945,灵敏度100.0%,特异度92.6%,阳性预测值94.7%,阴性预测值100.0%),尤其提高了诊断的特异度。表5中根据每个ROC曲线报告了DWI和SVM的性能结果,以区分sHCC和DNs。

表3 DWI和FSVM的诊断性能比较
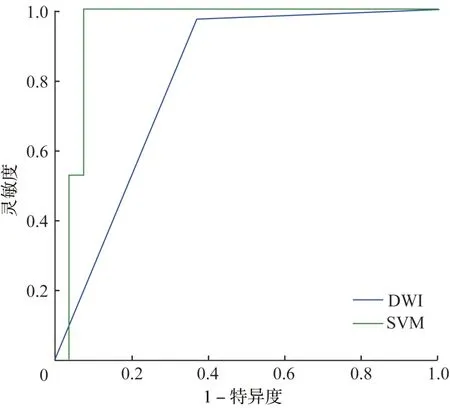
图4 DWI和F‑SVM诊断的ROC曲线
讨 论
在这项研究中,我们使用支持向量机算法方法用于术前对sHCC和DNs进行诊断效能评价。我们的分析显示,在鉴别sHCC和DNs方面,SVM算法具有令人满意的诊断价值;与DWI成像相比,SVM显著提高了诊断效能,且特异度和灵敏度均升高。
DWI高信号是MRI诊断HCC的特征性表现之一。在本研究DWI数据集中,我们发现识别sHCC和DNs的灵敏度几乎为97.5%,这与之前文献报道[10-11]相符。尽管如此,我们的研究显示,与先前报道[12-13]的特异度值为79.0%~94.4%的一些研究相比,本研究的特异度相对较低,为60.0%,这可能是因为有DNs病例支持HCC的一些影像学特征,如DWI呈高信号,增强后呈现“快进快出”的表现。Zhong等[11]报道,Gd‑EOB‑DPTA与DWI在用于区分sHCC和DNs的诊断性能相比,二者联合组的灵敏度(95.6%)高,但特异度(66.7%)仍然较低。
本研究是首次使用SVM分类器进行鉴别肝炎肝硬化背景下sHCC与DNs诊断的研究。SVM是机器学习中最常用的算法之一,它主要针对小样本问题的学习和分类,因为具有较强的非线性分类的能力被广泛应用。Li等[14]研究分析基于SVM的超声组学在预测局灶性结节性增生(focal nodular hyperplasia,FNH)和不典型HCC的鉴别诊断方面表现出满意的结果,灵敏度和特异度分别为76.6%、80.5%。Ren等[15]探讨超声在HCC术前病理分级的研究中发现,基于支持向量机构建的超声组学模型对肝癌的病理分级具有较好的预测能力和较强的泛化能力。本研究中,我们将SVM的诊断效能与DWI进行了比较,发现SVM的曲线下面积(0.945)优于使用DWI(0.788),且其灵敏度和特异度均高于DWI,尤其是在特异度方面。
本研究尚存在一些局限性。首先,我们的研究主要包括样本量相对较小的DNs,未将DNs具体分为低度DNs与高度DNs组。鉴于经病理证实DNs的少见发生,收集大量队列是一项挑战。其次,我们的研究是回顾性的,没有评估MRI未检测到的病变,因为这些病变很难进行影像学诊断和ROI分割,因此可能导致纳入时存在偏差。
综上所述,在区分肝硬化中的sHCC和DNs方面,SVM对sHCC与DNs的鉴别具有更高的诊断效能,尤其提高诊断的特异度。尽管这些结果让人兴奋,但这些结果是初步的,需要使用更多的样本量进行验证。我们相信,通过未来的验证,这些发现可以更好地为sHCC的早期及时诊断和有效及时治疗提供更多信息。基于MRI的支持向量机可作为鉴别诊断肝硬化背景下小肝癌和异型增生结节的一种有潜在价值的方法。

