体外存储过程中红细胞衰亡的研究
杨丽丽,丁慧荣,李 姝,李旭妍,孙明玥,苏 燕
(1.鄂尔多斯市蒙医医院,内蒙古鄂尔多斯 017000;2.北京大学肿瘤医院中心实验室;3.包头医学院生物化学与分子生物学教研室)
体外存储红细胞(Red blood cells, RBC)是临床输血的主要来源,随血液存储时间延长,RBC会发生一系列形态、功能、生物化学等方面的变化,即RBC存储损伤[1]。RBC存储损伤会引起RBC能量缺乏、氧化应激增强及细胞外K+浓度升高等[2],而体外存储是否会触发RBC启动衰亡程序尚不明确。本研究拟通过检测不同存储时间点RBC表面的磷脂酰丝氨酸(phosphatidylserine,PS)含量、RBC平均体积(mean corpuscular volume,MCV)以及细胞外离子、葡萄糖(glucose,Glu)、乳酸(lactic acid,Lac)、总胆红素(total bilirubin,TBil)浓度及高铁血红蛋白分数(fraction of methemoglobin,FMetHb)的改变,明确体外存储RBC的衰亡及其与红细胞平均体积、氧化应激、细胞内代谢和离子转运间的相关性,为血液保护及临床输血研究提供理论和实验基础。
1 材料与方法
1.1血液的来源与制备 本研究经包头医学院医学伦理委员会审核批准,招募乙肝病毒、丙肝病毒、人类免疫缺陷病毒阴性且无疾病家族遗传史的20~40岁健康男性志愿者6名。嘱3 d内清淡饮食、适量运动,于3 d后分别采集全血400 mL于山东威高的四联采血袋内,经白细胞滤器(四联袋自带)分离白细胞后,4 200 g离心17 min,分离血浆和RBC,RBC保存于100 mL MAP红细胞保护液中,4 ℃保存。
1.2试剂与仪器 APC Annexin V、FITC Mouse Anti-Human CD235a、10×Annexin V Binding Buffer均购自美国BD公司。一次性使用去白细胞塑料血袋(山东威高集团医用高分子制品股份有限公司);离心机(德国Eppendorf公司);血气分析仪(丹麦雷度公司);全自动血流变仪(中国普利生公司);流式细胞分析仪(美国BD公司);全血细胞分析仪(日本Sysmex800i)。
1.3检测方法 将储存期0、7、14、21、28和35 d红细胞血袋轻轻摇匀,从血袋小辫端无菌抽取RBC悬液6 mL进行以下检测。
1.3.1Annexin V Bingding RBC检测 取1 μL RBC与100 μL 1×Annexin V Binding Buffer、5 μL APC Annexin V和0.5 μL FITC Mouse充分混合,避光15 min后,加300 μL 1×Annexin V Binding Buffer,立即上机检测。
1.3.2MCV检测 取1 mL RBC利用全血细胞分析仪进行检测。
1.3.3细胞外离子、Glu、Lac和TBil浓度及FMetHb检测 取5 mL RBC,利用血气分析仪及配套试剂进行检测。

2 结果
2.1存储时间对结合Annexin V 的RBC比例的影响 研究结果表明,随着存储时间的延长,与Annexin V结合的RBC减少(r=-0.8356,图1)。

图1 不同存储时间对体外存储期间结合Annexin V的RBC比例的影响
2.2存储时间对RBC MCV及细胞外Cl-、Na+、Ca2+浓度的影响 随着存储时间的延长,MCV、细胞外Cl-浓度没有明显变化;细胞外Na+不断减少(r=-0.9274);细胞外Ca2+由于浓度低于仪器的检测限,一直未检测到(表1)。
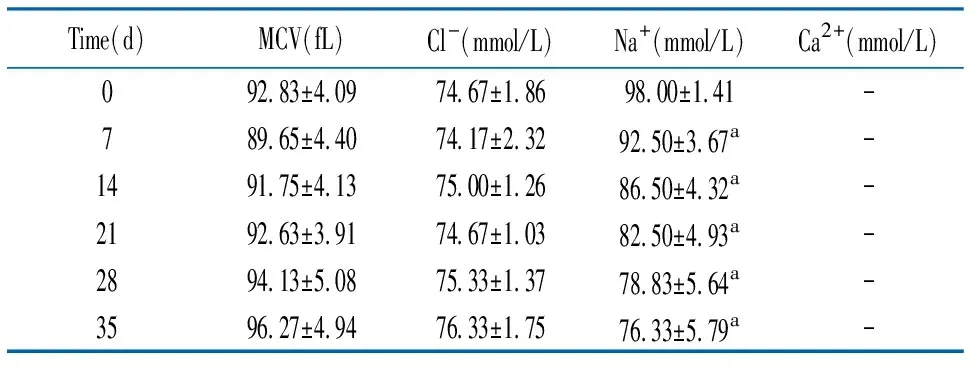
表1 存储时间对MCV、细胞外Cl-、Na+、Ca2+影响
2.3存储时间对RBC外Glu、Lac、TBil浓度及FMetHb的影响 随着存储时间的延长,细胞外Glu浓度不断降低(r=-0.9860,图2-C),而Lac(r=0.9377,图2-A)、TBil(r=0.8035,图2-B)浓度及FMetHb(r=0.9706,图2-D)不断增加。

图2 存储时间对RBC外Glu、Lac、TBil浓度及FMetHb的影响
2.4存储期间各指标与结合Annexin V的RBC比例的相关性 贮存期间K+、Lac、TBil浓度及FMetHb与结合Annexin V的RBC比例均呈高度负相关关系(r值分别为:-0.9569,-0.9790,-0.9060,-0.8302 图3-A,C-E),而Glu浓度与结合Annexin V的RBC比例呈高度正相关关系(r=0.9328,图3B)。

图3 部分指标与结合 Annexin V的 RBC比例间的线性关系
3 讨论
本研究结果显示,长期低温存储RBC表面PS的含量降低,与之前部分研究结果并不一致。Liu、Lu、Verhoeven 等[4-6]采用SAGM及CPDA-1等保护液,结果显示,随着存储时间的延长PS的含量增加,但其检测前采用了加入Ca2+温浴等方式。RBC衰亡是机体为了避免溶血引发的炎症反应而进行的自杀性程序性死亡[7]。此过程不破坏细胞膜的完整性,也不会将细胞内物质释放到组织液[8-9],其主要特征为磷脂酰丝氨酸外翻[10-12]。RBC衰亡的主要特征是细胞体积减小、细胞表面囊泡形成及膜弹性的改变[13]。衰亡的RBC被巨噬细胞识别、吞噬和降解,并从循环中清除[8]。RBC衰亡的主要机制是Ca2+可渗透的非选择性阳离子通道的激活引起细胞内Ca2+浓度增加[13-14],氧化应激、高渗及能量不足等均可通过该机制引发RBC衰亡[15]。细胞内Ca2+浓度增加会引发由于Ca2+敏感性K+通道的激活而引起的RBC内水分和KCl外流,最终导致RBC皱缩[7,12,16]。细胞膜的囊泡化是由细胞内Ca2+浓度增加激活钙蛋白酶引起细胞骨架降解而形成[17]。本研究结果显示,MCV的体积在存储后期增大,但差异无显著性,可能与样本例数较少有关。此外,细胞外Cl-浓度也没有明显的变化。存储过程中RBC利用细胞外Glu通过糖酵解和磷酸戊糖途径进行供能和维持细胞的氧化还原状态,然而低温存储使糖酵解生成ATP的效率并不高,生成的ATP不足可能导致ATP依赖性Na+-K+-ATP泵失活,进而使存储RBC外K+浓度增加、Na+浓度降低[15]。随着存储时间延长,葡萄糖酵解产生的Lac不断累积,因此,细胞内Lac浓度不断增高。然而存储RBC与体内RBC的衰亡机制并不完全相同[18-20],长期存储RBC的衰亡是能量消耗、氧化应激等与Ca2+内流共同作用的结果[20]。由于成熟RBC缺乏细胞内钙存储系统,因此,其细胞内浓度的升高主要源于Ca2+的内流。本研究中MAP红细胞保护液的主要成分为枸橼酸、枸橼酸钠和葡萄糖,其中枸橼酸钠的主要作用是与血浆中Ca2+结合防止血液凝固,所以血浆中Ca2+几乎全部与保护液中的枸橼酸钠结合,在血液成分分离的过程中随着血浆的去除而不再存在于RBC存储液中。红细胞存储上清中Ca2+浓度的检测结果也提示,由于Ca2+浓度过低而无法检测。相关分析显示,红细胞膜PS外翻与K+、Lac、TBil、FMetHb含量变化呈高度负相关,表明存储RBC表面PS外翻主要通过Ca2+内流介导,其他代谢和氧化应激产物并不能促进PS外翻。本研究结果提示,红细胞保存液中Ca2+缺失可以防止红细胞衰亡,红细胞衰亡的检测并不能直接反映红细胞存储损伤。但存储损伤的累积是否会加速输注后红细胞的衰亡尚需要进一步研究。

