灾难性抗磷脂抗体综合征合并大面积脑梗死1例报道
刘雅虹,江名芳
(内蒙古医科大学 1.研究生院,呼和浩特 010058;2.附属医院神经内科,呼和浩特 010059)
灾难性抗磷脂抗体综合征(catastrophic antiphospholipid syndrome,CAPS)也称为Asherson综合征,以广泛微血管血栓形成导致急性多器官功能障碍及坏死组织释放炎性细胞因子引起全身炎症反应为主要特点,是抗磷脂抗体综合征(antiphospholipid syndrome,APS)的一种最严重的特殊类型,有时代表后期综合征的首发表现[1]。CAPS占所有APS病例的不足1%,被认为是一种罕见但具有破坏性的变异(死亡率为30%~50%)[2]。CAPS的常见表现包括发热、疲乏、急性肾功能衰竭、肺水肿、急性呼吸窘迫综合征、卒中和短暂性脑缺血发作(transient ischemic attack,TIA)等。据报道,约62%的CAPS患者可见脑部受累,常见的表现包括TIA、缺血性卒中、癫痫发作、头痛、抑郁、精神病和多发性硬化症样疾病[3]。关于CAPS诊断初步标准的国际共识声明[4]为CAPS患者提供了统一的诊断方法。CAPS的早期诊断与及时治疗至关重要,它很容易与弥散性血管内凝血、肝素诱导的血小板减少症和其他血栓性微血管病混淆,因此,根据全面的病史、临床表现和实验室结果进行鉴别诊断非常重要[5]。我国CASP男女患病比例约为1 ∶9[6],男性患者极为罕见。2020年内蒙古医科大学附属医院收治了1例CAPS合并急性大面积脑梗死的男性青年患者,并治疗成功,现报道如下:
1 临床资料
患者,男,17岁,学生,体质量120 kg,因“间断性发热、腹痛7 d”于2020年6月8日收入我院。患者入院7 d前进食油腻食物后出现阵发性脐周绞痛,伴腹胀、发热,自测体温37.5 ℃,有恶心呕吐,共呕吐6次,呕吐呈非喷射状,呕吐物为咖啡色胃内容物,无腹泻,自觉全身无力,至当地医院就诊行腹部彩超显示肝大、脂肪肝。入院5 d前患者出现尿频、尿急、尿痛,疼痛以排尿终末时为重,并伴有全程肉眼血尿,无明显泡沫尿,伴双侧腰部酸胀、乏力及纳差。入院前2 d突发左侧肢体无力。血压200/140 mmHg;尿常规检测结果显示,尿蛋白(++++),尿潜血(+++);血常规结果显示,白细胞32.71×109/L,中性粒细胞84.9%,血小板80×109/L,血红蛋白102 g/L;生化检查结果显示,血肌酐371 μmol/L,尿酸(uric acid,UA)479 μmol/L;凝血检查结果显示,凝血酶原时间(prothrombin time,PT)14.60 s,国际标准化比值(international normalized ratio,INR)1.28,活化部分凝血酶原时间(activated partial thromboplastin time,APTT)39.90 s,D-二聚体(D-dimer,D-D)3.35 μg/mL;抗人球蛋白(++)。肺部CT显示双肺炎症(图1);头颅磁共振成像显示右侧额颞顶叶及右侧侧脑室旁多发急性脑梗死病灶(图2);全腹部CT提示左肾周炎、左下腹及盆腔脂肪间隙密度增高,膀胱壁厚、左腹壁软组织水肿(图3);床旁双下肢血管彩超提示右侧浅动脉中下段闭塞,右侧腘胫后动脉血流减少,右侧腘静脉陈旧性血栓。查体:神志清楚,精神萎靡,双耳红肿,可见血痂,双眼球结膜充血,左侧面部淤血斑,左侧中枢性面舌瘫,左侧肢体肌力0级,右侧肢体肌力5级,左侧肢体肌张力减低,腱反射减弱,左上肢掌颏反射阳性,左下肢病理征阳性,左上肢散在出血点,双肺呼吸音低,心脏听诊未闻及病理性杂音,右下肢周径明显增粗,呈凹陷性水肿。既往无风湿免疫疾病史、无手术外伤史及过敏史。初步诊断:急性肾损伤,急性肾盂肾炎;重症感染,腹膜炎不除外;急性大面积脑梗死;高血压3级(很高危);贫血,凝血功能异常;电解质紊乱;低蛋白血症。
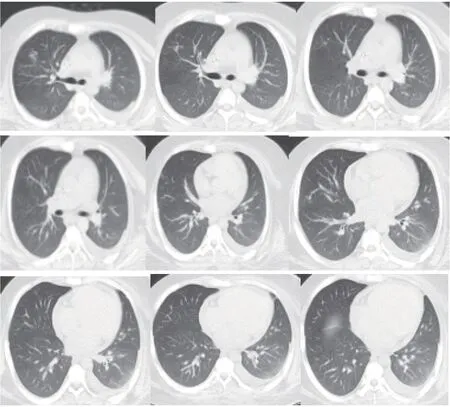
图1 胸部CT显示双肺炎症
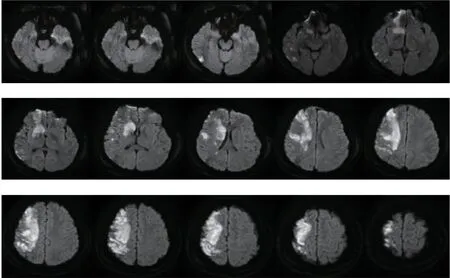
图2 头颅MRI显示右侧额、颞、顶叶及右侧室旁多发急性梗死灶

图3 全腹部CT显示左肾周炎,左肾增大
患者入院后给予抗凝、抗感染、降血压、保肾、改善循环及对症治疗,仍有持续波动性发热,体温最高达38.7 ℃,24 h排茶色尿700 mL,病情持续加重,多脏器受累。初步考虑肾病综合征-膜性肾病可能性大,给予地塞米松1 mg静脉注射1次,隔日甲泼尼龙40 mg静脉滴注治疗。6月13日患者突发呼吸困难,检测脑钠肽前体>35 000 pg/mL,诊断急性左心功能衰竭,给予纠正治疗;肌酐及尿素氮持续呈高水平,考虑急性肾功能衰竭CKD5期,凝血功能未见明显改善,不除外血栓性微血管病。患者当时无条件进行肾脏穿刺,行外周血破碎细胞涂片,偶见球形红细胞(图4)。行抗心磷脂抗体(anticardiolipin antibody,ACA)检测,结果显示,6月9日抗β2糖蛋白1(β2 glucoprotein,β2GP1)抗体IgAGM型72.97 RU/mL,ACA IgAGM型 380.11 RU/mL,ACA IgG型>400.00 RU/mL,6月14日 抗β2GP1抗 体IgG型312.94 RU/mL,ACA IgAGM型356.35 RU/mL。6月14日狼疮抗凝物(lupus anticoagulant,LAC)检测结果显示,LA1 92.80 s,LA2 40.20 s,处于超高水平。综合以上结果,考虑可能为CAPS。住院期间行颈动脉彩超显示,右侧颈内动脉终末段、大脑中动脉闭塞;肾动脉彩超显示,双肾主干及其肾内分支血流速度减低呈低速低搏动样改变—双肾动脉弥漫性狭窄;复查下肢动静脉彩超,提示右侧骨浅动脉中下段闭塞,右侧腘胫动脉血流减少,右侧腘静脉陈旧性血栓,左下肢动静脉未见异常;复查相关重要指标(表1)发现,经治疗各指标逐渐趋于正常。

图4 外周血涂片偶见球形红细胞

表1 治疗期间复查相关指标
本例患者的治疗过程如下:给予持续性低分子肝素抗凝,甲强龙1 g连续冲击治疗3 d,血浆置换2 d,甲强龙静脉滴注(60 mg,6 d),隔日1次血浆置换3轮,血液透析1次,甲强龙静脉滴注(40 mg,7 d),泼尼松片口服(60 mg,15 d),辅以抗感染、保肾、降血压、改善循环等对症治疗后,患者未再发热,血压控制平稳,各脏器功能逐渐恢复。患者于2020年7月17日出院。出院时查体:神清语利,双眼球结膜无出血,左侧中枢性面舌瘫,左侧肢体肌力3级,右侧肢体肌力5级,左侧肢体肌张力减弱,腱反射减低,左下肢病理征阳性,双肺呼吸音清,心脏未闻及病理性杂音,右下肢周径明显缩小。出院3个月后随访,患者可下地辅助行走,相关化验结果基本正常,再无血栓形成。
2 讨论
APS主要表现为静脉或动脉血栓、异常妊娠和血小板减少。其中,血栓是导致APS最重要的因素,大多为静脉血栓,以下肢深静脉血栓最常见,动脉血栓主要累及脑血管[2]。CAPS是一种罕见的APS严重类型,其特征为多器官系统中广泛的血栓形成[7]。增加血栓形成风险的已知因素,如肥胖、肾病综合征和遗传性凝血病(蛋白质C/S缺乏、抗凝血酶Ⅲ缺乏、凝血酶Ⅴ因子或凝血酶原突变),似乎与CAPS的发病机制有关[3]。本例患者体质量120 kg,身高180 cm,属于肥胖,且入院时有急性肾功能不全伴恶性高血压,容易发生CAPS。已有文献[8-11]报道过巨细胞病毒相关APS病例,以及巨细胞病毒相关的血栓形成伴或不伴APS。病毒的分子模拟被认为是导致APS免疫激活的主要机制,而血管内皮损伤被认为是血栓形成的原因。本例患者住院期间未检测到巨细胞病毒感染,但出院2周后复诊提示巨细胞病毒感染。
目前公认的CAPS诊断标准[12]为:(1)涉及3个或更多器官、系统或组织;(2)同时或在1周内出现动静脉血栓的不同临床表现;(3)组织病理学证实至少有1个器官或组织小血管闭塞;(4)实验室检查证实存在抗磷脂抗体[LAC和(或)ACA]。以上4项都存在即诊断为CAPS。可能的CAPS诊断标准为:(1)符合以上4项,但只涉及2个器官、系统或组织;(2)除了没有实验室证实的抗磷脂抗体外,所有以上4项均存在;(3)符合第1、2和4项标准;(4)符合第1、3和4项标准,尽管进行了抗凝治疗,但在发病后1周以上、1个月内发生了第3次血栓事件。
CAPS诊断标准涉及的主要器官包括肾脏(64%)、肺(64%)、脑(62%)、心脏(51%)和皮肤(50%)等。本例患者为17岁男性青年,起病初期症状不典型,最初累及肾脏,出现恶性高血压、双肺炎症,易被误诊为急性肾功能损伤及肺部感染。随后1周内,出现大面积脑梗死,急性左心功能衰竭,眼底、皮肤出血及自身免疫性溶血等,症状累及多个脏器。据文献[13]报道,在众多可滴定抗磷脂抗体中,ACA、LAC和抗β2GP1抗体检测对APS的诊断更具特异性。本病例ACA、LAC、抗β2GP1抗体持续1个月以上高滴度阳性,血小板明显减少,血红蛋白、红细胞水平降低,白细胞持续升高,均为全身炎症反应综合征的表现。患者住院期间因病情较重,未行组织病理学检查,但仍可充分考虑为CAPS。
CAPS是一种罕见的急症,死亡率很高,目前缺乏前瞻性的临床试验,对治疗的建议是经验性的。CAPS的治疗主要包括两方面内容,一是治疗性抗凝,这对治疗血栓性事件至关重要,二是其他疗法,如血浆透析、血浆置换、激素和(或)免疫调节剂[14]。根据第14届抗磷脂抗体国际会议的建议,CAPS的治疗首选“抗凝+激素+血浆置换和(或)静脉注射丙种球蛋白”三联疗法[15],并发系统性红斑狼疮或其他自身免疫性疾病的患者可应用四联疗法(即三联疗法联合环磷酰胺),难治性CAPS患者可考虑使用利妥昔单抗[16]或依库珠单抗[17]。有研究[18]发现,血浆置换优于丙种球蛋白治疗。本例患者即接受了经典的三联治疗,即抗凝+激素+血浆置换,1次血液透析。文献[19]报道,感染诱发CAPS预后极差,死亡率可高达57%,提示应早期更积极地进行抗感染治疗。本例患者严格按照正规三联、抗感染及其他对症治疗后,病情逐渐好转。
综上所述,CAPS起病隐匿,进展迅速,病情重,预后差,诊断较困难。对抗磷脂抗体持续阳性并有静脉及动脉血栓的患者,应高度警惕CAPS发生的可能性。一旦诊断该病,注意在早期积极给予正规三联或四联、抗感染及其他对症治疗,才能提高患者的生存率。

