非白血病性肥大细胞白血病1例报道并文献复习
王静,高峰,张丽君
(中国医科大学附属第一医院血液科,沈阳 110001)
肥大细胞增多症是肥大细胞在皮肤、内脏器官 (骨髓、淋巴结、脾、胃肠道等)中克隆性增生的一组疾病。根据2016年世界卫生组织最新分类标准,肥大细胞增多症包括皮肤型肥大细胞增多症、系统性肥大细胞增多症和肥大细胞肉瘤[1]。其中,肥大细胞白血病(mast cell leukemia,MCL)是系统性肥大细胞增多症的一个罕见亚型,在美国系统性肥大细胞增多症成人患者中占比不到1%,在法国肥大细胞增多症数据库中占比小于0.5%[2]。根据外周血涂片中肥大细胞占白细胞总数的比例是否≥10%,分为经典型MCL(≥10%)和非白血病性MCL(<10%)[3]。MCL自然病程短,预后差,目前尚无系统、有效的治疗方法。本文报道了我科收治的1例非白血病性MCL患者的临床特征、实验室检查和诊治经过,并进行相关文献复习,以提高临床对该病的认识。
1 临床资料
1.1 一般情况
患者,女,28岁,因“月经量增多、乏力伴发热”于2020年7月15日就诊于我院急诊,体温最高41 ℃,周身皮肤散在大片红斑。完善血常规:白细胞6.64×109/L,血红蛋白53 g/L,平均红细胞体积85 fl,平均红细胞血红蛋白浓度333 g/L,血小板139×109/L。肺增强CT考虑炎症,全腹增强CT提示脾大,建议患者进一步完善骨髓穿刺检查,患者及其家属拒绝。给予抗感染、输血等对症支持治疗,效果欠佳,患者仍间断、反复发热,未能明确病因。2020年10月患者出现腹痛、腹泻、双下肢疼痛。2020年11月3日再次发热,并出现左眼视物模糊,考虑左眼黄斑出血。2020年11月6日收入我科住院诊治。患者体质量近4个月下降8 kg。追问既往史:自幼无明显诱因出现心悸、皮肤红斑伴瘙痒,曾就诊于多家医院,考虑荨麻疹,间断口服氯雷他定、西替利嗪片治疗。否认血液病家族史。
1.2 临床检查和诊断
入院查体(图1):贫血貌,胸腹部、四肢可见片状红斑,部分融合成片伴瘙痒,双肺呼吸音粗,心律齐,未闻及病理性杂音,腹胀,肝脾大,肝肋下15 cm,脾肋下12 cm,双下肢无水肿。入院接受辅助检查。血常规:白细胞2.08×109/L,血红蛋白59 g/L,血小板105×109/L。肝胆脾超声:肝肋下斜径约15.05 cm,脾长径约20.76 cm,脾厚约5.85 cm,盆腔和腹腔可见积液。心电图:窦性心律,86次/min。心脏彩色多普勒超声检查:左心房、左心室大,二尖瓣轻度反流。
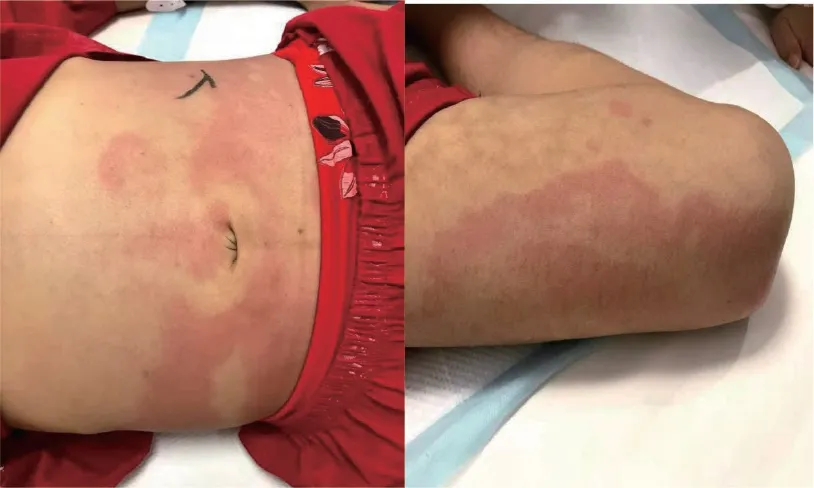
图1 患者皮肤多发大片红斑
完善骨髓细胞形态学(图2):镜下可见散在或成堆幼稚肥大细胞,占33.2%,胞体较大,胞核呈圆形、类圆形,居中,核染色质较粗糙,核仁可见1~2个,胞质丰富,含有大量粗大紫色颗粒,可见双核肥大细胞;组织嗜碱细胞(即不典型肥大细胞)占57.6%。血涂片:肥大细胞<1%。流式细胞学:主要表达CD117bri、CD33、CD2bri、CD13、CD9、CD64、CD25,部分表达CD4、CD123,但CD34、CD19、CD38、cKappa、cLambda、CD7、CD3、CD8、CD11b、CD16、HLA-DR、CD14、CD56、CD15、CD11c、髓过氧化物酶、cCD3、cCD79a均为阴性,为异常肥大细胞(占90.1%)。因肿瘤负荷高,细胞RNA破坏未成功提取,未行融合基因检测。行白血病二代基因测序检测:IKZF1阳性,突变频率19.82%,NF1阳性,突变频率62.61%,未检测出KIT D816V基因突变。行骨髓活检:HE和PAS染色示异常细胞弥漫增生(占90%),胞体大,胞质丰富,核椭圆形或不规则,染色质粗。免疫组化示肿瘤细胞:CD117+、类胰蛋白酶+、CD2+、CD25-、CD68+(弱)、CD20-、CD3-、CD56-、CD138-、髓过氧化物酶-,符合MCL(图3)。最终临床诊断:非白血病性MCL。
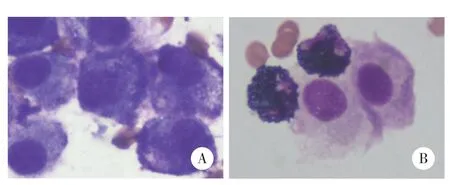
图2 油镜下观察骨髓细胞形态学 ×1 000
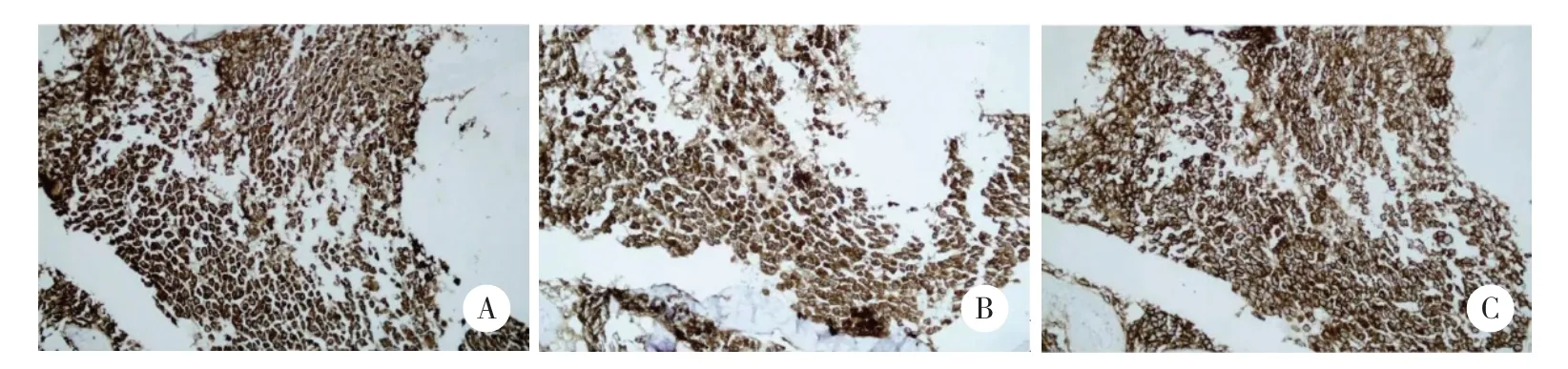
图3 骨髓活检免疫组化 ×200
1.3 治疗
建议应用伊马替尼联合克拉屈滨等药物化疗,患者及其家属因经济等原因拒绝化疗。遂给予干扰素(隔日1次)肌肉注射、泼尼松60 mg(1次/d)口服降低肥大细胞负荷,西替利嗪、氯雷他定抗组胺治疗。2020年11月30日复查血常规,白细胞4.7×109/L,血红蛋白83 g/L,血小板82×109/L。患者出院后继续药物治疗,泼尼松规律减量。2021年9月随访,目前口服泼尼松5 mg(1次/d)维持治疗,肌肉注射干扰素(2次/周),体温正常,腹胀减轻,血常规基本正常,未复查骨髓。
2 讨论
MCL是系统性肥大细胞增多症的罕见亚型,目前对该病的认识不足,容易漏诊和误诊。根据2016年版世界卫生组织分型标准[3],系统性肥大细胞增多症的诊断需满足1个主要标准和1个次要标准,或满足3个次要标准。主要标准:骨髓活检和(或)其他真皮外组织切片有多灶性密集的肥大细胞浸润(每个聚集点的肥大细胞≥ 15个)。次要标准:(1)骨髓涂片或组织切片中有>25%梭形或不典型肥大细胞浸润;(2)检测出KIT D816V基因突变;(3)肥大细胞表达CD25和(或)CD2;(4)血清类胰蛋白酶基线水平>20 ng/mL。MCL在满足系统性肥大细胞增多症的诊断标准上,需同时满足骨髓涂片肥大细胞≥20%。本例患者满足1个主要标准和2个次要标准。
MCL患者常见的肥大细胞活化症状主要包括面部潮红(60%)、发热(52%)、腹泻(28%)和心动过速(20%),而尿频(7%)、神经精神症状(6%)和严重的骨质疏松(6%)等症状罕见[2]。78%的患者自觉乏力,38%的患者体质量下降超过10%。体格检查中肝大、脾大最常见,分别占68%和63%,中位脾大小为21 cm(13~25 cm),皮肤受累占30%。本例患者因乏力、发热就诊,并出现腹泻、下肢骨痛症状,查体可见肝大、脾大、皮肤红斑,均与文献报道相符。回顾本例病例,患者幼时即存在相关症状和体征。临床中应及时行病理活检、血液等相关检查明确诊断,以免漏诊或误诊。
血清类胰蛋白酶是由肥大细胞分泌的一种炎症介质,检测其水平可为MCL的诊断提供重要依据。SAVINI等[4]报道了1例慢性MCL患者在疾病稳定期快速进展为急性MCL时,其他指标无明显变化,而血清类胰蛋白酶水平升高5.7倍,考虑胰蛋白酶水平可作为肿瘤负荷的标志。本例患者因受实验条件限制未能检测该指标,仅骨髓活检免疫组化结果提示类胰蛋白酶阳性。
骨髓涂片上的肥大细胞经迈格吉染色后可见4种不同形态的肥大细胞。MCL细胞的化学染色表现为甲苯胺蓝、糖原染色、酸性磷酸酶染色阳性,过氧化物酶和非特异性酯酶染色阴性。研究[5]报道,无论是肿瘤性肥大细胞或反应性肥大细胞均表达类胰蛋白酶、KIT(CD117),同时表达髓系抗原,包括CD13和CD33。类胰蛋白酶特异度较高,但灵敏度较低,CD117则相反。CD25和CD2仅在异常肥大细胞中表达,因此是识别异常肥大细胞的关键抗原。但有研究[2,6]表明,1/3的患者出现CD25、CD2双阴性的免疫表型,因此CD25和CD2表达不能作为诊断MCL的直接依据。本例患者行骨髓流式细胞学,提示异常细胞CD117bri、CD33、CD2bri、CD25表达均为阳性,患者同时行骨髓活检免疫组化,提示CD117+、类胰蛋白酶+、CD2+、CD25-,符合MCL的免疫表型。
研究[2,5,7]表明,KIT D816V是成人系统性肥大细胞增多症患者最常见的基因突变类型,约占80%~90%,而MCL患者中KIT D816V基因突变占30%~50%。在侵袭性系统性肥大细胞增多症和MCL中,会出现一些与其他髓系肿瘤相关的基因突变,如SRF2、ASXL1、RUNX1、TET2、CBL、K/N-RAS、EZH2,而且这些突变已证实与不良预后相关。研究[8]发现,28例MCL患者中25例(89%)出现KIT突变,其中D816V位点突变占68%,还有D816H、D816Y、F522C等多个位点突变。MCL患者应同时行F1P1L1/PDGFRα、BCR/ABL、ETV6/PDGFRβ检测,以除外其他克隆性血液病。因此,患者应尽可能进行全面基因检测,这对预后和治疗具有重要指导意义。本例患者未发现KIT突变,而IKZF1和NF1突变阳性。目前研究[9]认为,IKZF1基因在淋巴系统发育过程中起关键作用,可以协同引起白血病,在急性淋巴细胞白血病中属于预后不良基因。在系统性肥大细胞增多症患者中目前仅有2例IKZF1基因阳性报道,在MCL患者中未见报道[10]。而且目前研究[11]认为,NFI可在骨髓增生异常综合征和急性髓系白血病中出现,且提示预后不良,目前尚未见在MCL患者中报道。因此,IKZF1和NF1在MCL中的意义尚不明确,需进行进一步研究。
MCL的染色体多为正常核型,当合并其他髓系肿瘤时可能出现相关遗传学改变,如合并骨髓增生异常综合征时可出现染色体5q缺失。本例患者因细胞破坏,未能行遗传学检测。
针对MCL的治疗,目前尚无统一的治疗方案。MCL预后差,平均生存期小于6个月。所有系统性肥大细胞增多症患者均需要进行减低组胺负荷的姑息治疗,主要包括抗组胺治疗、糖皮质激素和干扰素等药物治疗。LAFORGIA等[12]的研究显示,MCL的治疗应基于患者遗传学改变类型。因此,酪氨酸激酶抑制剂作为MCL靶向治疗药物,包括米哚妥林、伊马替尼等,无论是单独还是联合化疗均应该应用。同时有研究报道[13-14],MCL的治疗选择有限,主要由于肿瘤性肥大细胞常对传统和靶向治疗(包括米哚妥林)有耐药性。急性MCL患者中,对于年轻和健康的患者,多药化疗后再进行同种异体干细胞移植通常是唯一的治疗选择。本例患者因经济等原因仅同意姑息治疗,截至目前共随访10个月,生存期已超过中位时间。因此,MCL是异质性很高的疾病,需对预后因素和个体化治疗进行更多研究。
综上所述,MCL是非常罕见的血液系统恶性肿瘤,临床表现异质性很强,结合骨髓细胞形态学、流式细胞学、基因突变、血清类胰蛋白酶可明确诊断。MCL治疗效果差,生存期短,无统一治疗方案,未来需进行MCL治疗相关的临床试验,为患者治疗提供更多的选择,改善患者预后。

