脂联素在免疫性血小板减少症患者外周血中的水平及其对巨核细胞系分化的作用
李昕雨,左 斌,王 文,钮晓音,翁 震,何 杨
1.苏州大学附属第一医院,江苏省血液研究所,苏州 215006;2.苏州大学唐仲英血液学研究中心,苏州 215123;3.上海交通大学医学院,上海市免疫学研究所,上海 200025
免疫性血小板减少症(immune thrombocytopenia,ITP)是一种以不明原因的血小板减少(外周血小板计数<100×109/L)为特征的自身免疫性疾病。ITP 患者的临床症状主要表现为出血趋势的增加,如皮肤、黏膜的自发性出血等,严重者可发生危及生命的内脏及颅内出血[1]。因此,有必要探索ITP的病理生理机制以改进ITP的临床治疗方法。
血小板生成减少是ITP主要的致病机制[2]。血小板生成是发生在骨髓微环境中的一系列连续、复杂的过程,主要包括巨核细胞的分化、成熟及血小板释放3 个阶段,该过程中任一阶段的异常均有可能导致血小板生成的异常[3]。骨髓脂肪细胞是骨髓微环境中最丰富的细胞。研究[4]发现,骨髓脂肪细胞能够通过分泌脂联素、瘦素、白介素-6等脂肪细胞因子调节造血干细胞(hematopoietic stem cell,HSC)的增殖和分化。
脂联素基因是脂肪组织中表达最丰富的基因,它主要参与糖、脂和骨代谢调控,近来发现其还具有抗糖尿病、动脉粥样硬化和炎症等多种作用。脂联素主要通过脂联素受体(ADIPOR1、ADIPOR2)发挥作用[5]。已有研究[6]表明小鼠HSC 表达ADIPOR1、ADIPOR2,2 种受体能够通过激活p38 丝裂原激活的蛋白激酶(p38 mitogen-activated protein kinase,p38 MAPK)促进HSC 的增殖并使细胞保持在不成熟的状态。但目前尚不清楚脂联素是否参与了血小板生成的调控。
因此,本研究拟通过检测ITP 患者血浆脂联素水平,从临床角度初步探讨脂联素与ITP 的相关性;并通过体外细胞实验研究脂联素及其受体在巨核细胞分化、成熟中的作用。
1 材料与方法
1.1 主要试剂与仪器
RPMI 1640 培养基、胎牛血清(fetal bovine serum,FBS)、青霉素-链霉素双抗混合液均购自美国Gibco 公司, TRIzol 购自美国Sigma 公司,HiScript ⅢAll-in-one RT SuperMix Perfect for qPCR 反转录试剂盒、SYBR qPCR Master Mix 试剂盒均购自南京Vazyme 公司,人脂联素酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA) 试剂盒购自美国Proteintech 公司,ADIPOR1 多克隆兔抗体购自英国Abcam 公司,ADIPOR2 多克隆兔抗体、脂联素受体激动剂AdipoRon 均购自上海爱必信生物科技有限公司,PE 小鼠抗人CD41a 抗体、FITC 小鼠抗人CD41a 抗体均购自美国BD Biosciences 公司,豆蔻酰佛波醇乙酯(phorbol 12-myristate 13-acetate,PMA)、Hoechst 33342 均购自上海碧云天生物技术有限公司,甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体、HRP 羊抗兔二抗均购自美国Proteintech公司。
StepOnePlus ™实时荧光定量PCR 仪购自美国Thermo Fisher 公司,多功能酶标仪购自美国BioTek公司,UVP ChemStudio SA2 多功能凝胶成像仪购自德国Analytikjena 公司,Gallios 流式细胞仪购自美国Beckman Coulter公司。
1.2 临床资料
2021 年1 月 至2022 年2 月,共 有46 例ITP 患 者及30 名健康对照者被纳入研究。ITP 患者来源于苏州大学附属第一医院血液科,健康对照(HC)组来源于苏州大学附属第一医院保健体检中心。ITP 患者纳入标准:临床确诊ITP,其诊断均基于美国血液学会2019 版ITP 指南[7]及《成人原发免疫性血小板减少症诊断与治疗中国指南(2020 年版)》[8];收集外周血标本前1 个月未接受任何ITP 相关治疗。ITP 患者排除标准:存在其他导致血小板减少的原因。HC 组纳入标准:均为健康志愿者,其年龄、性别及BMI 与ITP 患者相匹配,外周血小板计数正常。此外,根据ITP 患者临床病程的不同,将ITP 患者进一步分为新诊断ITP(诊断<3个月)、持续性ITP(3~12个月)和慢性ITP(>12个月)3个临床亚组。
1.3 标本制备
取ITP 患者以及HC 组外周血置于EDTA-K2抗凝管中,1 300×g离心10 min,即获得EDTA-K2抗凝血浆,并于-80 ℃冻存。
1.4 血浆脂联素水平的测定
ITP 患者及HC 组血浆脂联素水平使用人脂联素ELISA试剂盒检测,操作按说明书进行。
1.5 细胞培养
人髓系白血病细胞株K562、人巨核细胞白血病细胞株MEG-01 及Dami、人乳腺癌细胞株MCF-7 均由苏州大学唐仲英血液学研究中心保存。所有细胞相关操作均于超净台中进行。MCF-7 细胞培养基为含有10%FBS、1%青霉素-链霉素双抗混合液的高糖DMEM 培养基;K562、MEG-01 及Dami 细胞培养基为含有10%FBS、1%青霉素-链霉素双抗混合液的RPMI 1640 培养基。所有细胞于5%CO2、37 ℃饱和湿度的培养箱中培养。
1.6 Western blotting 检测脂联素受体在蛋白水平上的表达
取一定数量(一般不低于1×106个细胞)且正处于对数生长期的细胞,经洗涤后,使用细胞裂解液裂解细胞并提取总蛋白。然后行SDS-PAGE,并转至PVDF 膜,用5%脱脂奶粉室温封闭2 h。随后按照抗体说明书的推荐浓度进行ADIPOR1或ADIPOR2相应一抗的孵育,4 ℃孵育过夜。使用PBST 洗膜后,加入相应HRP 标记的二抗,室温孵育1 h 后进行洗膜、显影。
1.7 实时荧光定量PCR 检测脂联素受体在mRNA水平上的表达
实时荧光定量PCR(real time quantitative PCR,RT-qPCR)需要取一定数量(一般不低于1×106个细胞)且正处于对数生长期的细胞,经洗涤后,使用TRIzol 法提取细胞总RNA。按照反转录试剂盒说明书合成cDNA,然后以合成的cDNA为模板,GAPDH为内参,按照试剂盒说明书进行扩增,反应条件为:95 ℃预变性30 s;95 ℃变性10 s,60 ℃退火30 s,共40 个循环。熔解曲线阶段为95 ℃变性15 s,60 ℃退火60 s,95 ℃变性15 s。引物由苏州金唯智生物科技有限公司合成,引物序列见表1。

表1 RT-qPCR引物(5'→3')Tab 1 Primer sequences for RT-qPCR(5'→3')
1.8 细胞系分化、成熟模型的建立
1.8.1 K562 细胞分化模型 人髓系细胞株K562 在PMA 的刺激下,能够向巨核细胞系分化[9-11]。根据预实验结果,使用10 ng/mL 的PMA 刺激K562 细胞,于72 h后使用流式细胞术评估其分化情况。
1.8.2 MEG-01、Dami 细胞成熟模型 人巨核细胞系细胞株MEG-01、Dami 在PMA 的刺激下,能够进一步成熟[12-15]。根据预实验结果,使用10 ng/mL 的PMA 刺激MEG-01、Dami 细胞,于72 h 后使用流式细胞术评估其成熟情况。
1.9 流式细胞术检测巨核细胞系的分化
收集需要检测的各组细胞分别置于15 mL离心管中,300×g离心5 min,弃上清液。使用100 μL PBS重悬细胞,每管加入PE-CD41a 抗体5 μL,室温避光孵育30 min。孵育结束后,每管加入1 mL PBS 进行洗涤,于300×g离心5 min,弃上清液。随后,每孔加入300~400 μL PBS 重悬,上机检测,统计CD41+细胞百分比以评估细胞分化情况。
1.10 流式细胞术检测巨核细胞系的成熟
收集需要检测的各组细胞分别置于15 mL离心管中,300×g离心5 min,弃上清液。使用100 μL 含有DNA 染料Hoechst 33342(10 µg/mL)的PBS 重悬细胞,每管加入FITC-CD41a 流式抗体5 μL,室温避光孵育30 min。孵育结束后,每管加入1 mL PBS 进行洗涤,于300×g离心5 min,弃上清液。随后,每孔加入300~400 μL PBS 重悬,上机检测,统计CD41+细胞百分比、CD41 表达量即平均荧光强度(mean fluoresence intensity,MFI)、多倍体细胞(≥4N)百分比3个指标以评估细胞成熟情况。
1.11 统计学处理
使用GraphPad Prism 8 软件进行统计分析。使用D′Agostino-Pearson 正态性检验对ITP 患者、HC 组及各亚组的数据进行正态性分析,由于各组数据均不满足 正 态 分 布, 故 数 据 采 用M(Q1,Q3) 或M(Min~Max)表示,并使用Mann-Whitney 检验比较ITP 患者和HC 组之间、各亚组之间血浆脂联素水平的差异。Spearman 相关性分析用于确定血浆脂联素水平与ITP 患者体质量指数(body mass index,BMI)之间的相关性。细胞实验部分使用Student′st检验分析数据,数据均来自3 次及以上独立实验结果。双侧检验,P<0.05表示差异具有统计学意义。
2 结果
2.1 ITP患者和HC组的临床特征
参与本项研究的ITP 患者以及HC 组的临床特征如表2所示。共有46例ITP患者和30名年龄、性别与ITP 患者相匹配的健康对照者被纳入统计。ITP 患者与HC 组的血小板计数中位数分别为32.0×109/L 和220.5×109/L(P=0.000),其他一般特征差异均无统计学意义(均P>0.05)。

表2 ITP患者及HC组的临床资料Tab 2 Clinical information of ITP patients and healthy controls
2.2 ITP患者和HC组血浆脂联素水平
46 例ITP 患者及30 名健康对照者的血浆脂联素水平如图1所示。与HC组相比,ITP患者血浆中脂联素水平显著升高(P=0.000)。
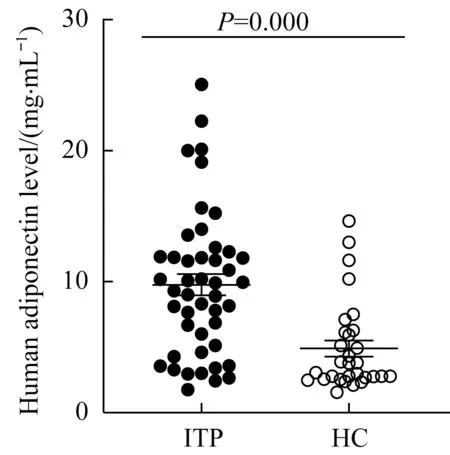
图1 ITP患者和HC组血浆脂联素水平Fig 1 Plasma adiponectin levels in the ITP patients and the healthy controls
既往研究[16]发现,血浆脂联素水平与被检者BMI呈负相关。为了确定ITP患者血浆脂联素水平的升高是否与患者BMI相关,我们对ITP患者的血浆脂联素水平与其BMI进行相关性分析,并根据中国BMI参考标准将ITP患者分为BMI<24 kg/m2(n=23)和BMI≥24 kg/m2(n=23)2个亚组比较血浆脂联素水平的差异。结果如图2所示:ITP患者的血浆脂联素水平与BMI之间无相关性(P=0.621),且2个BMI亚组的ITP患者的 血浆脂联素水平差异无统计学意义(P=0.295)。

图2 ITP患者血浆脂联素水平与BMI之间的关系Fig 2 Relationship between plasma adiponectin level and BMI in the patients with ITP
2.3 不同病程的ITP患者血浆脂联素水平
结果如图3 示:与HC 组相比,3 种不同病程的ITP 患者,即新诊断ITP 患者(P=0.001)、持续性ITP 患者(P=0.003) 及慢性ITP 患者(P=0.001),其血浆脂联素水平均呈现不同程度的升高。但不同病程的ITP 患者之间的血浆脂联素水平并无明显差异。

图3 不同病程的ITP患者血浆脂联素水平Fig 3 Plasma adiponectin levels in the ITP patients with different courses of disease
2.4 ADIPOR1、ADIPOR2 在K562、MEG-01、Dami细胞株中的表达
脂联素主要通过其受体ADIPOR1和ADIPOR2发挥作用。因此,为明确脂联素在巨核细胞分化、成熟中的作用,必须首先确定脂联素受体在相关细胞中的表达。
我们利用RT-qPCR、Western blotting 技术分别在mRNA水平和蛋白水平上研究脂联素受体在髓系细胞株K562,巨核细胞系细胞株MEG-01、Dami 中的表达,并选用乳腺癌细胞株MCF-7 作为ADIPOR1、ADIPOR2 表达的阳性对照[17]。结果如图4 所示:K562、MEG-01 及Dami 细胞在mRNA 水平及蛋白水平均表达ADIPOR1、ADIPOR2。

图4 脂联素受体在K562、MEG-01、Dami细胞株中的表达(n=4)Fig 4 Expression of adiponectin receptors in the cell lines K562,MEG-01 and Dami(n=4)
2.5 脂联素受体激动剂对髓系细胞株K562分化的影响
将不同浓度的AdipoRon(1、10 及20 µmol/L)与PMA 共同培养K562 细胞,对照组为PMA+DMSO组。培养72 h后使用流式细胞术检测CD41+细胞百分比。结果如图5所示:较PMA+DMSO 组,10µmol/L和20µmol/L AdipoRon 处理组的CD41+细胞百分比显著降低(均P=0.000)。

图5 流式细胞术检测脂联素受体激动剂对K562细胞株分化的影响(n=4)Fig 5 Effect of AdipoRon on the differentiation of the cell line K562 detected by flow cytometry(n=4)
2.6 脂联素受体激动剂对巨核细胞系细胞株MEG-01和Dami成熟的影响
将不同浓度的AdipoRon(1、10 及20 μmol/L)与PMA 共同培养MEG-01、Dami 细胞,对照组为PMA+DMSO 组。培养72 h 后使用流式细胞术检测细胞成熟相关指标,即CD41+细胞百分比、CD41 表达量(CD41-MFI)、 多 倍 体(≥4N) 细 胞 比 例。MEG-01 细胞株结果如图6 所示:与PMA 对照组相比,20 μmol/L AdipoRon 处理组的CD41 表达量(P=0.047)与多倍体细胞比例(P=0.003)均出现显著增加。在Dami细胞株上,各浓度AdipoRon处理组的细胞CD41 表达量以及多倍体细胞比例较对照组均未显著增加(图7)。

图6 流式细胞术检测脂联素受体激动剂对MEG-01细胞株成熟的影响(n=3)Fig 6 Effect of AdipoRon on maturation of the cell line MEG-01 detected by flow cytometry(n=3)

图7 流式细胞术检测脂联素受体激动剂对Dami细胞株成熟的影响(n=3)Fig 7 Effect of AdipoRon on maturation of the cell line Dami detected by flow cytometry(n=3)
3 讨论
ITP 是发病机制尚未完全明确的一种自身免疫性疾病,患者体内产生的包括抗血小板糖蛋白Ⅱb/Ⅲa(platelet glycoprotein Ⅱb/Ⅲa,GPⅡb/Ⅲa)和抗血小板膜糖蛋白Ⅰb/Ⅸ(platelet glycoprotein Ⅰb/Ⅸ,GPⅠb/Ⅸ)在内的病理性血小板自身抗体是发生血小板破坏的重要原因[2]。但值得注意的是,在ITP的实验诊断研究[18-20]中,血小板自身抗体(GPⅡb/Ⅲa和GPⅠb/Ⅸ)检出率仅为50%~70%。此外,研究[21-22]发现,TPO 并不是血小板生成这一过程中唯一的调控因子。因此,推测存在其他因素共同参与了ITP的发生。
近年来,有研究[4]报道:脂联素、瘦素等多种脂肪细胞因子与骨髓造血稳态的维持、某些血液疾病的发生等息息相关。在本研究中,我们通过检测ITP患者血浆脂联素水平,从临床角度初步探讨了脂联素与ITP 的相关性,为后续的体外实验提供了临床基础。结果发现:不同病程的ITP 患者血浆脂联素水平均显著高于HC 组。另外,既往研究对被检者的脂联素水平与其BMI 的相关性进行了报道。NIELSEN等[16]发现:被检者的血浆脂联素水平与其BMI呈负相关,这种相关性未针对特定人群。而KUO 等[23]发现:对健康成人进行的研究并不支持BMI 影响脂联素血浆水平的报道;研究人员考虑已报道的与肥胖相关的包括脂联素在内的血浆脂肪因子水平变化可能是肥胖相关代谢紊乱的结果。因此,为排除ITP 患者升高的血浆脂联素水平可能受其BMI 的影响,我们对两者进行了相关性分析,并对BMI<24 kg/m2和BMI≥24 kg/m22 个亚组的ITP 患者血浆脂联素水平进行比较。结果均表明ITP 患者血浆脂联素水平的升高与BMI变化无关。另一方面,本研究中选取的HC 组的BMI 与ITP 组相比无明显差异。据此,我们认为ITP患者血浆脂联素水平较HC组的升高是由ITP疾病本身引起的。
在细胞实验中,我们确定了人髓系细胞株K562、巨核细胞系细胞株MEG-01 及Dami 均表达脂联素受体ADIPOR1 和ADIPOR2;并发现脂联素受体激动剂能够抑制巨核细胞的分化。CHANG 等[24]研究发现:将ITP 患者的血浆加入巨核细胞体外分化体系后,体外培养得到的巨核细胞数量减少,且是由病理性的血小板自身抗GPⅠb、抗GPⅡb/Ⅲa抗体所致。在K562细胞株的分化模型中,高浓度脂联素激动剂(10、20 μmol/L AdipoRon)处理组的CD41+细胞比例显著下降,故推测脂联素能够抑制髓系细胞向巨核细胞系分化。虽然ITP 患者的血浆脂联素水平增高可能引起巨核细胞数量的减少,从而解释ITP 患者血小板生成的减少,但在临床上,仅有少部分ITP 患者会出现巨核细胞数量的减少,大多数患者的巨核细胞数量正常或呈增加趋势。
MCMILLAN等[25]发现ITP患者血浆不仅能使体外培养的巨核细胞数量减少,而且能够抑制巨核细胞成熟,即导致4N、8N 和16N 细胞减少。此外,YANG 等[26]观察到大多数ITP 患者的血浆能够增加巨核细胞的生成但使巨核细胞出现成熟障碍,即多倍体细胞显著减少。在巨核细胞MEG-01 成熟模型中,我们发现20 μmol/L AdipoRon 对巨核细胞株MEG-01多倍体化具有促进作用,但在Dami 细胞株中未发现上述现象。故尚不能确定脂联素对巨核细胞成熟的影响。
综上,本研究发现ITP 患者血浆脂联素水平升高,髓系、巨核细胞系细胞株上表达脂联素受体,且脂联素受体激动剂对巨核细胞分化具有抑制作用。值得注意的是,巨核细胞的多倍体化是巨核细胞成熟的重要表现;在临床上,多数ITP 患者的巨核细胞有成熟障碍的表现。但本研究反而在一个巨核细胞株上观察到脂联素受体激动剂对多倍体化的促进作用。后续,我们将建立人造血干细胞体外分化巨核细胞模型,系统研究脂联素对巨核细胞分化、成熟及血小板生成过程的影响。
利益冲突声明/Conflict of Interests
所有作者声明不存在利益冲突。
All authors disclose no relevant conflict of interests.
伦理批准和知情同意/Ethics Approval and Patient Consent
本研究涉及的所有实验均已通过苏州大学附属第一医院医学伦理委员会的审核批准[文件号2020伦审(申报)批第452号]。所有实验过程均遵照世界医学会的《赫尔辛基宣言》的条例进行。受试对象或其亲属均签署知情同意书。
All experimental protocols in this study were reviewed and approved by the Medical Ethics Committee of the First Affiliated Hospital of Soochow University (Approval Letter No. 2020-452),and all experimental protocols were carried out by following the guidelines ofHelsinki Declarationof the World Medical Association.Consent letters have been signed by the research participants or their relatives.
作者贡献/Authors'Contributions
李昕雨、左斌、何杨、钮晓音参与了实验设计;李昕雨、左斌、王文参与了实验操作;李昕雨、左斌、何杨、翁震、钮晓音参与了论文的写作和修改。所有作者均阅读并同意了最终稿件的提交。
The study was designed by LI Xinyu,ZUO Bin,HE Yang and NIU Xiaoyin.The study was operated by LI Xinyu,ZUO Bin and WANG Wen.The manuscript was drafted and revised by LI Xinyu,ZUO Bin,HE Yang,WENG Zhen and NIU Xiaoyin.All the authors have read the last version of paper and consented for submission.
·Received:2022-02-24
·Accepted:2022-07-12
·Published online:2022-07-28

