铜绿假单胞菌对环丙沙星异质性耐药的研究
李聪聪,姚玉峰,张传珍
上海交通大学基础医学院免疫学与微生物学系,上海 200025
铜 绿 假 单 胞 菌 (Pseudomonas aeruginosa,P.aeruginosa)属于革兰阴性杆菌,是一种重要的条件致病菌[1-2],可在免疫功能低下或有其他易感条件的患者中引起广泛的急性和慢性感染,除了常见的伤口感染、呼吸道感染与尿路感染外,还可进入血液引起菌血症和败血症[3]。治疗铜绿假单胞菌感染的常用抗生素有氟喹诺酮类、β-内酰胺类和氨基糖苷类等,其中环丙沙星是使用最广泛且最有效的氟喹诺酮类药物[4-5]。然而,随着抗生素的滥用,临床分离的铜绿假单胞菌对环丙沙星耐药的比例越来越高,使得该抗生素的有效性不断受到考验。
铜绿假单胞菌对环丙沙星的耐药机制主要有2种,即靶位基因突变和外排泵(efflux pump)过表达。环丙沙星靶向DNA 解旋酶(DNA gyrase)和拓扑异构酶Ⅳ(topoisomerase),编码这两者的基因分别为gyrAB和parCE,其突变会导致环丙沙星与靶蛋白亲和力降低[6]。除了靶位修饰,外排泵过表达也是铜绿假单胞菌对环丙沙星的主要耐药机制。其中MexEF-OprN 是一套临床上常见的过表达可导致环丙沙星耐药的外排系统,其过表达常由编码其特异性调节蛋白的基因mexS突变介导。该外排泵的底物除氟喹诺酮类抗生素外,还包括氯霉素。此外,与MexEF-OprN 呈负共调控关系的孔道蛋白OprD 是亚胺培南进入胞内的重要通道,因此MexEF-OprN 过表达通常还会引起对这些抗生素的交叉耐药[7]。
异质性耐药(heteroresistance)从广义上来说,指的是在细菌分离物中存在一个或几个亚群,与主要群体相比,它们对抗生素的敏感性显著降低[8],被认为是耐药性形成的重要中间阶段[9]。异质性耐药菌株中的耐药亚群很难通过常规的方法检测鉴定,这给临床对异质性耐药菌引起的感染的诊断和治疗带来极大的困难。近年来,已有许多研究报道临床抗生素治疗失败与异质性耐药有关[10]。
耐药亚群的发生频率与稳定性是定义异质性耐药的重要因素。ANDERSSON 等[11]建议,将在8 倍最低抑菌浓度(minimum inhibitory concentration,MIC)条件下耐药亚群发生频率大于10-7的菌株定义为异质性耐药菌株。耐药亚群的稳定性是指当抗生素压力消失时,部分被选择的耐药亚群保持稳定耐药性的能力。相比于不稳定的耐药性,稳定的耐药性带来的适应性代价(fitness cost)通常更低[11],因此探究其背后的遗传机制更具有临床意义。
近年来针对铜绿假单胞菌异质性耐药的报道逐渐增多,包括头孢菌素类[12]、碳青霉烯类[13-14]和多黏菌素[15]等多种抗生素,但对环丙沙星异质性耐药仍少有报道,其背后的遗传机制尚不清楚。阐明铜绿假单胞菌对环丙沙星异质性耐药机制对控制其耐药发展、优化抗生素治疗方案都具有非常重要的意义。在本研究中,我们以源自医院患者分离鉴定的227 株铜绿假单胞菌作为出发菌株,筛选并研究环丙沙星异质性耐药,以期为临床治疗该菌引起的感染提供依据。
1 材料与方法
1.1 实验材料
1.1.1 菌株来源 实验菌株为从上海交通大学医学院附属瑞金医院与附属仁济医院分离鉴定的227 株铜绿假单胞菌。标准菌株PAO1(P.aeruginosa)来自本实验室。
1.1.2 试剂与仪器 环丙沙星药敏纸片(货号2978568)购自Oxide Limited 公司;MH 培养基(货号28050)购自广州环凯生物科技有限公司;盐酸环丙沙星(货号A600310)、氯霉素(货号A600118)购自上海生工生物工程有限公司;莫西沙星(货号M843928)、美罗培南(货号M861173)、亚胺培南(货号R843845)购自上海麦克林生化科技有限公司;Easyspiral dilute 细菌涂布仪购自上海书俊仪器设备有限公司;Synergy 2 酶标仪购自美国伯腾仪器有限公司;细菌基因组抽提试剂盒(货号DP302-02)购自天根生化科技有限公司;生物安全柜1300 series A2购自美国赛默飞世尔科技公司。
1.2 实验方法
1.2.1 圆盘扩散法 挑取单克隆菌落接种于MH 液体培养基中,37 ℃培养20 h。用无菌棉签蘸取菌液均匀涂布于MH 固体培养基表面,用无菌镊子夹取环丙沙星药敏纸片置于培养基中心位置,37 ℃培养48 h。如果抑菌圈内存在明显菌落则判定为潜在异质性耐药菌株。
1.2.2 肉汤稀释法 用肉汤稀释法测定MIC。无菌96 孔板内加入100 μL MH 培养基,每组第一个孔不加。取100 μL 含有一定抗生素浓度的MH 培养基加入第一列与第二列中,并从第二列开始充分混匀后吸取100 μL 加入下一列,依次进行二倍梯度稀释至倒数第二列,每组最后一列为无抗生素的对照孔。用MH 培养基调节过夜菌液浓度至OD(600 nm)=1.0,并稀释1 000 倍。将稀释好的菌液加入含有梯度浓度抗生素的孔中,每孔100 μL,充分混匀后将96 孔板放入37 ℃培养箱内过夜培养。24 h 后取出读取MIC,其值为无细菌生长的最小抗生素浓度。
1.2.3 群体谱型分析(population analysis profiling,PAP) 挑取单克隆接种于MH 液体培养基中,37 ℃培养24 h,将菌液以10倍梯度稀释至10-7,选择适宜稀释梯度涂布于含有不同浓度环丙沙星的MH 固体培养基上,每种抗生素浓度涂布3 个连续稀释度的菌液,置于37 ℃培养48 h。根据平板上克隆数与稀释度计算耐药亚群频率,以抗生素浓度为横坐标,耐药亚群频率的对数为纵坐标绘制半对数图。
1.2.4 异质性耐药稳定性检测 通过将耐药亚群在无抗生素的培养基中连续传代,观察耐药性变化来判断异质性耐药的稳定性,一般需要连续传代10 次以上[11,16]。挑取耐药亚群单克隆,测定环丙沙星最低抑菌浓度记为MIC-1,同时挑取单克隆在无抗生素的MH 固体培养基上连续传代14 次。挑取第14 次传代的耐药亚群单克隆,测定最低抑菌浓度记为MIC-14。比较MIC-1 与MIC-14,若无明显差异,此耐药亚群亲本即为稳定异质性耐药菌株。
1.2.5 全基因组测序与分析 取过夜培养菌液,以1∶100 转接至新鲜5 mL LB 液体培养基中,37 ℃培养至OD(600 nm)=1 时离心收菌。使用细菌基因组抽提试剂盒抽提基因组DNA。使用Illumina 平台De novo测序,对测序获得的DNA小片段文库进行拼接,获得基因组图谱。比较分析异质性耐药亲本菌株与其耐药亚群的基因组序列。
2 结果
2.1 异质性耐药菌株的初筛
利用圆盘扩散法对铜绿假单胞菌环丙沙星异质性耐药进行初筛,若抑菌圈内存在明显克隆,则判断其为潜在环丙沙星异质性耐药菌株(图1)。对这些菌株再次进行圆盘扩散法验证,以增加初筛的可靠性。最终共有18 株被初步确定为潜在环丙沙星异质性耐药菌株(图2A)。
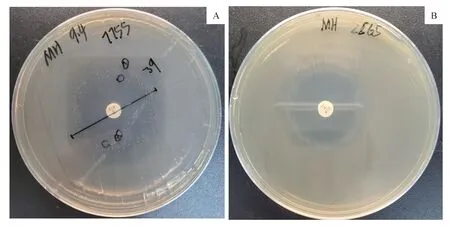
图1 圆盘扩散法筛选平板Fig 1 Plates of disk diffusion
圆盘扩散法筛选异质性耐药的同时,测量抑菌圈直径,并依据美国临床和实验室标准协会(Clinical and Laboratory Standards Institute, CLSI)制定的抗微生物药物敏感性实验操作方法和判断标准对其敏感性进行划分。227株菌中有142株(62.6%)表现为敏感,26 株(11.5%)表现为中介,59 株(26.0%)表现为耐药。
2.2 异质性耐药菌株的复筛
2.2.1 异质性耐药的稳定性检测 为了确定异质性耐药的稳定性,从每个异质性耐药菌株的抑菌圈内挑取2 个尽可能靠近药敏纸片的单克隆,测定其对环丙沙星的敏感性,并在无抗生素的MH 平板上连续传代后,再次测定其对环丙沙星的敏感性从而判断异质性耐药的稳定性。结果显示共有11 株异质性耐药菌株的耐药亚群表现出稳定的耐药性。这些菌株被标记为潜在的稳定异质性耐药菌株(图2B),从它们的耐药亚群中挑选表型稳定且耐药水平较高的一株用于进一步研究。
2.2.2 异质性耐药菌株的确认 圆盘扩散法虽然简易高效,但存在一定假阳性率与假阴性率。因此,对于初筛得到的潜在稳定异质性耐药菌株,通过PAP进一步验证。实验结果显示,这11 株铜绿假单胞菌均符合ANDERSSON 等[11]提出的对异质性耐药的普遍定义,无假阳性出现(图2C、3A)。
2.2.3 初筛效率的分析 为了确认初筛的有效性,从筛选结果中随机挑选18 株潜在的非异质性耐药菌株,同样用PAP 进行验证。其中有15 株(83.3%)仍表现为非异质性耐药,另3 株(16.7%)则符合异质性耐药标准(图2D、3B)。这一结果说明,圆盘扩散法在用于铜绿假单胞菌对环丙沙星的异质性耐药筛选时灵敏度较低,存在一定的假阴性率。
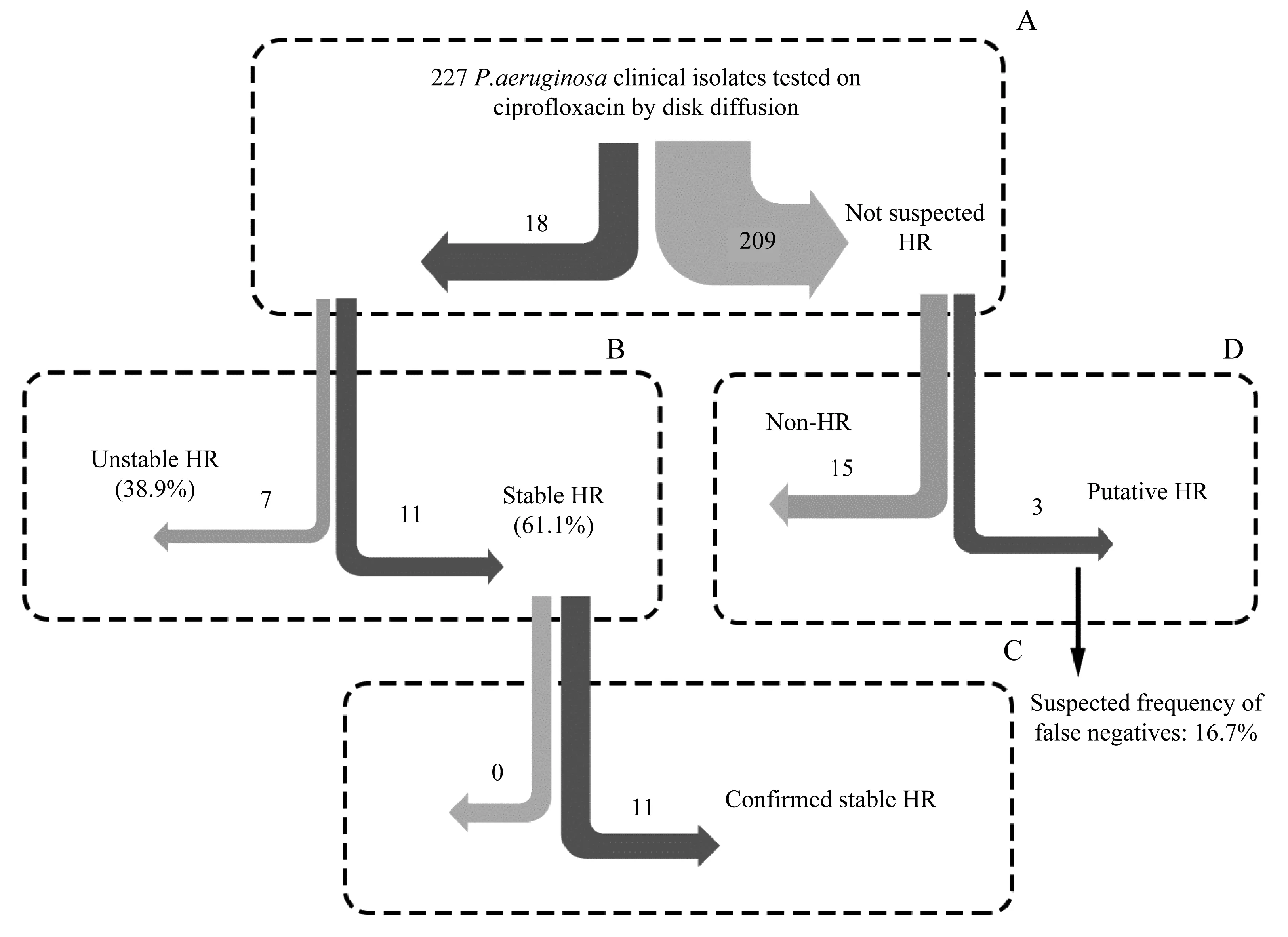
图2 检测流程与主要结果Fig 2 Summary of tests performed and main results
2.3 异质性耐药菌株及其耐药亚群的MIC测定
为探究耐药亚群的耐药性变化以及异质性耐药分布,通过肉汤稀释法检测了异质性耐药菌株及其耐药亚群的MICCIP,结果见表1。11 株异质性耐药菌株中有10 株为环丙沙星敏感菌株(MICCIP≤0.5 μg/mL),其耐药亚群的MICCIP相比亲本株均上升8~64倍,并且均为对环丙沙星中介(MICCIP=1 μg/mL) 或耐药(MICCIP≥2 μg/mL)菌株。值得注意的是,异质性耐药菌株亲本株1595为一株环丙沙星耐药菌,其耐药亚群的MICCIP相比亲本株升高了8倍,达到64 μg/mL,远高于耐药划分标准。
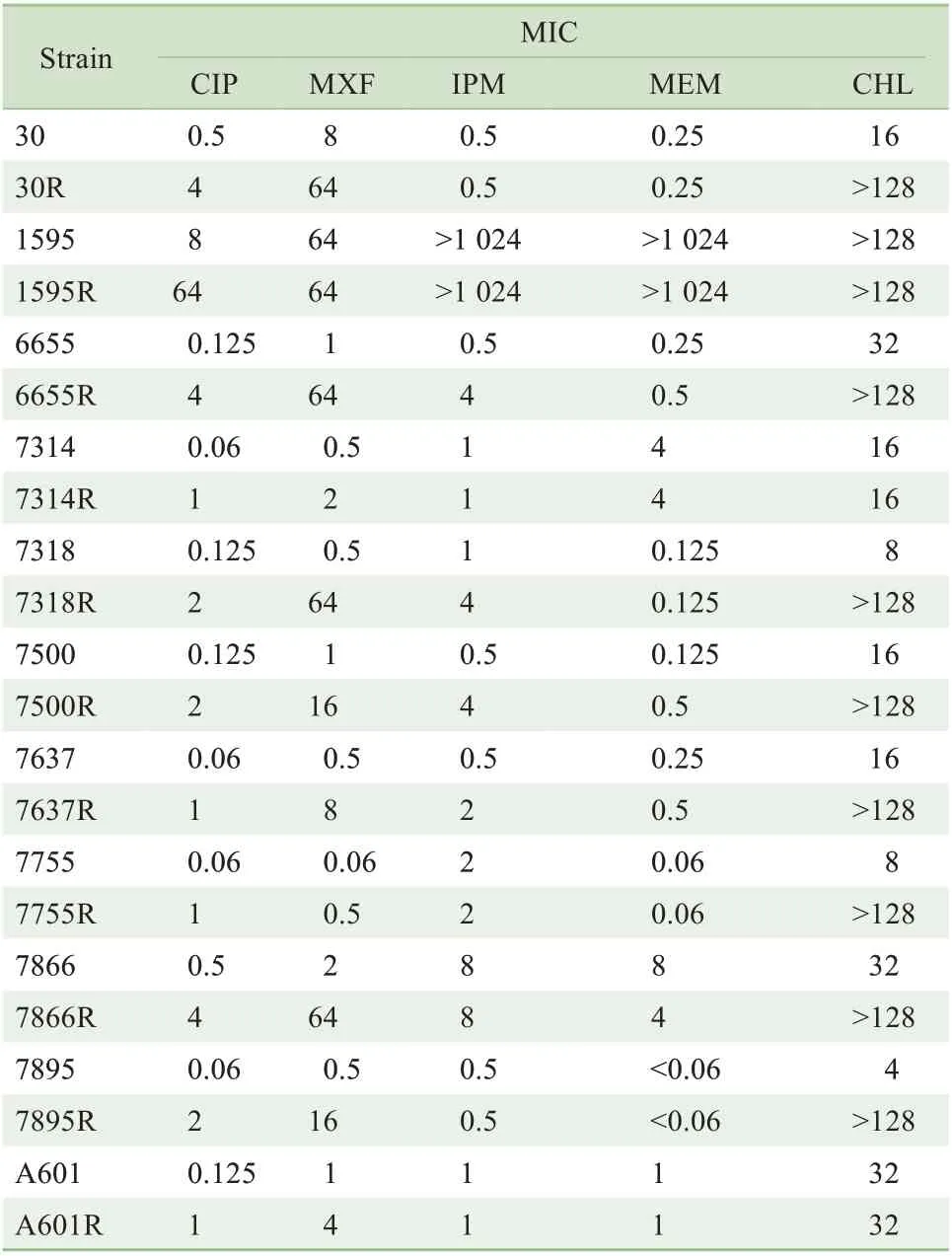
表1 异质性耐药菌株与其耐药亚群MIC(μg·mL-1)Tab 1 Susceptibilities of heteroresistant strain and its subpopulation(μg·mL-1)
2.4 异质性耐药亲本株与耐药亚群基因组差异分析
为了探究铜绿假单胞菌环丙沙星异质性耐药背后的遗传机制,通过二代全基因测序寻找异质性耐药菌株与其耐药亚群间的遗传差异,再通过Sanger测序验证,最终确定11株耐药亚群中共有13处非同义突变,结果见表2。
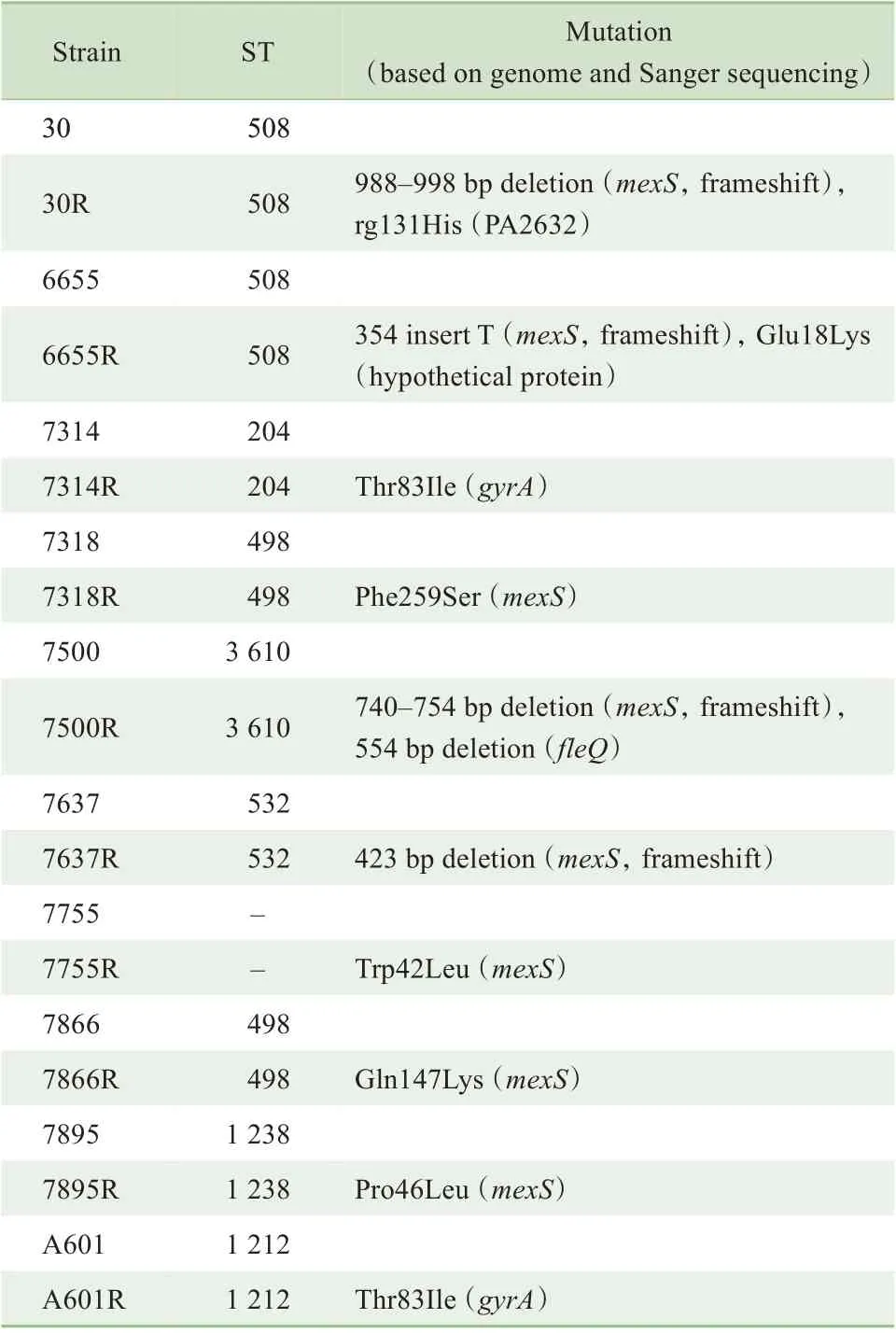
表2 耐药亚群突变基因与突变类型Tab 2 Mutant gene and mutant type of resistant subpopulation
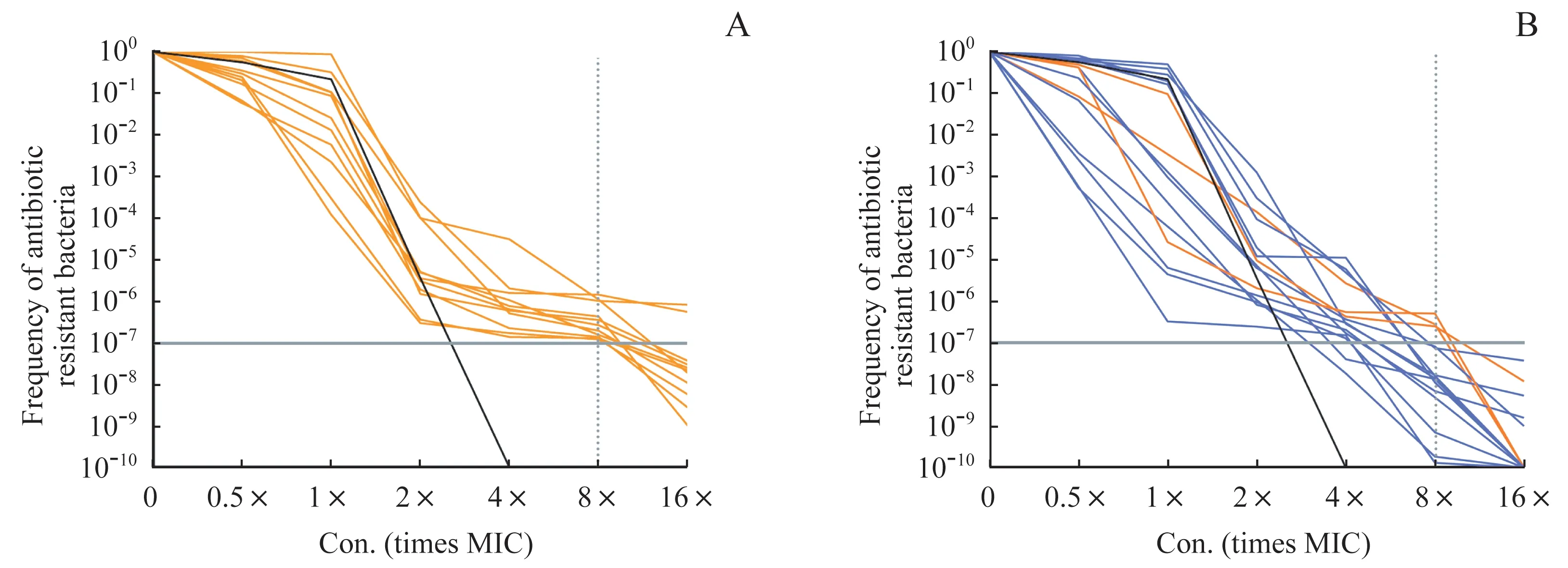
图3 PAP实验结果Fig 3 Results of PAP
除mexS与gyrA这2 个已知与环丙沙星耐药相关的基因外,PA2632、fleQ与PAKAK_02255 也各在1 株菌中发生了突变。NtrC 家族转录调控因子FleQ 是鞭毛生物合成过程中的主要调控因子,通过调控铜绿假单胞菌鞭毛和胞外多糖的生物合成,在其运动和生物被膜形成中发挥重要作用。PA2632 与PAKAK_02255 则 分 别 是PAO1 和PAK 中的潜在基因。目前尚无研究表明这3 个基因与铜绿假单胞菌环丙沙星耐药相关。我们通过构建fleQ或PA2632 的缺失株并测定其对环丙沙星的敏感性,表明这2 个基因缺失并不影响PAO1 对环丙沙星的敏感性。值得注意的是,兼具环丙沙星耐药与异质性耐药的菌株1595 中,没有检测到突变。
2.5 不同突变类型耐药亚群的药物敏感性差异
我们检测了亲本株及其耐药亚群对其他临床治疗铜绿假单胞菌感染的常用抗生素的敏感性,除另一种氟喹诺酮类抗生素莫西沙星外(moxifloxacin,MXF),还测定了对氯霉素(chloramphenicol,CHL)以及对碳青霉烯类抗生素亚胺培南(imipenem,IPM)和美罗培南(meropenem,MEM)的敏感性。
从表1 中可以看出,发生mexS突变的耐药亚群在产生环丙沙星耐药的同时对莫西沙星和氯霉素的敏感性降低,已知这三者皆为MexEF-OprN 的外排底物,表明mexS突变可能通过增强外排泵表达从而介导对该类抗生素的耐药。其中6655R、7318R、7500R、7637R 还会产生亚胺培南耐药性,这可能是MexEF-OprN 与OprD 负共调控的结果。美罗培南敏感性在各突变株中无明显变化,因为该抗生素虽然与亚胺培南同属碳青霉烯类抗生素,但并不通过OprD进入细胞。发生gyrA突变的耐药亚群7314R 与A601R仅对环丙沙星与莫西沙星耐药,对亚胺培南与氯霉素的敏感性无明显变化,这与靶位突变介导的氟喹诺酮类抗生素耐药机制相符。
3 讨论
铜绿假单胞菌因其高水平的固有与获得性耐药机制,导致治疗其引起的感染愈发棘手。异质性耐药作为耐药性发展的中间阶段,更是极大地增加了治疗难度。本研究筛选的菌株大部分来自重症患者,他们中的大多数在院内感染铜绿假单胞菌,这种高耐药水平的条件致病菌导致患者后续治疗与康复困难重重。还有一部分菌株来自慢性阻塞性肺炎、支气管扩张等慢性感染患者。这些患者往往经历过长期的抗生素治疗,异质性耐药可能是导致其治疗失败的一个重要原因。环丙沙星作为临床治疗铜绿假单胞菌感染的重要抗生素,目前少有关于铜绿假单胞菌对其异质性耐药的报道。因此,探究这些临床铜绿假单胞菌对环丙沙星的异质性耐药机制对于治疗其感染具有重要指导意义。
异质性耐药菌株的筛选是研究铜绿假单胞菌异质性耐药的基础。为了提高筛选效率,我们将圆盘扩散法作为初筛方法,PAP作为复筛方法,结合进行环丙沙星异质性耐药菌株的筛选鉴定。NICOLOFF 等[17]针对包括铜绿假单胞菌在内的多种致病菌的异质性耐药筛选结果表明,圆盘扩散法作为筛选手段存在一定假阳性率与假阴性率。但在我们的初筛结果中仅有假阴性而没有假阳性存在,这可能与圆盘扩散法在筛选异质性耐药时灵敏度较低有关。并且在初筛阶段,我们利用圆盘扩散法对潜在异质性耐药菌株进行重复验证,进一步降低了该方法的假阳性率。从筛选结果可以看出,将圆盘扩散法作为筛选异质性耐药的单一方法,虽然简单快速,但存在一定的假阴性率,且易受操作因素的干扰。而圆盘扩散法与PAP组合筛选的方法既保证了较高的筛选效率,同时又提高了筛选结果的准确性,为后续研究异质性耐药机制提供保障。
通过全基因组测序分析发现,mexS是耐药亚群中突变频率最高的基因。该基因的失活突变可能通过使外排泵MexEF-OprN 过表达导致药物敏感性变化,mexS突变株对其他抗生素的交叉耐药性也间接证明了这一点。这并非首次报道外排泵过表达参与铜绿假单胞菌异质性耐药。JIA 等[12]针对头孢吡肟异质性耐药的研究发现,部分耐药亚群的mexX表达量升高。MEI 等[16]的研究发现,铜绿假单胞菌对亚胺培南异质性耐药的主要机制与外排泵MexAB 高表达有关。XU 等[18]则发现,亚胺培南异质性耐药菌株的耐药亚群中mexE与mexY的表达量显著提高,oprD表达量则降低。由此可见,外排泵过表达是铜绿假单胞菌异质性耐药的主要机制之一,而不同抗生素对应的外排泵系统也不尽相同,这可能与外排泵的底物特异性有关。值得注意的是,铜绿假单胞菌中共有4 套外排泵可以泵出环丙沙星[19-20],其中MexCD-OprJ 与MexEF-OprN 是2 套临床上最常见的因过表达导致环丙沙星耐药的外排泵,前者的过表达通常由其特异性调节蛋白NfxB 的突变产生[7,21]。但在我们筛选到的耐药亚群中,没有发现除mexS外的与外排泵相关的基因发生突变。为什么异质性耐药菌株更偏向于通过过表达MexEF-OprN 来产生耐药亚群呢?推测可能是由于与其相比,过表达MexCD-OprJ 产生的适应度代价更高,因此在实验室条件下铜绿假单胞菌会尽量避免选择这一“低性价比”的耐药机制。考虑到不同外排系统的过表达带来的多重耐药性有很大差异,进一步探究铜绿假单胞菌在应对抗生素压力时对外排泵的选择偏好性对其临床治疗有重要参考意义。
本研究通过全基因组测序未发现异质性耐药菌株1595 的耐药亚群中存在遗传突变。目前尚无研究报道存在非遗传机制导致的异质性耐药。由于二代全基因组测序技术存在读长短且末端准确率低的缺点,我们将利用第三代全基因组测序平台对1595 及其耐药亚群的遗传差异进行测序,与二代测序结果整合分析基因组之间的差异,从而阐明该菌中异质性耐药的产生机制。
异质性耐药现象并不是一个新发现,其在多种致病菌中被广泛报道,真菌及部分肿瘤细胞中也存在此类现象。因为缺乏快捷高效的检测手段,异质性耐药在临床上往往难以引起注意。但如果对异质性耐药现象未能及时发现并给予有效治疗,它将向完全耐药转化,最终引起治疗失败。本研究报道了铜绿假单胞菌对环丙沙星异质性耐药的现象,并进一步探究了其背后的遗传机制,为临床感染治疗提供了理论指导。
利益冲突声明/Conflict of Interests
所有作者声明不存在利益冲突。
All authors disclose no relevant conflict of interests.
作者贡献/Authors'Contributions
李聪聪、姚玉峰、张传珍参与了实验设计、论文的写作和修改。所有作者均阅读并同意了最终稿件的提交。
The study was designed by LI Congcong,YAO Yufeng and ZHANG Chuanzhen. The manuscript was drafted and revised by LI Congcong,YAO Yufeng and ZHANG Chuanzhen. All the authors have read the last version of paper and consented for submission.
·Received:2022-04-02
·Accepted:2022-05-22
·Published online:2022-07-28

