ER-β对三阴性乳癌细胞生物学行为和IL-8表达影响
姚瑶,吕志栋,夏菁,崔茹婷,孔滨
(1 青岛大学附属医院乳腺病诊疗中心,山东 青岛 266100; 2 青岛大学医学部; 3 青岛市中心医院乳腺外一科)
三阴性乳癌(TNBC)是乳癌中最具侵袭力的一种亚型,具有较高的局部复发和远处转移率,给健康带来巨大威胁[1]。目前,对于TNBC病人内分泌治疗是需要探索的领域。雌激素在乳癌中通过雌激素受体α(ER-α)和雌激素受体β(ER-β)两个核受体发挥其作用[2]。ER-β首次发现至今已有30余年,在乳癌中的确切作用仍有争议[3]。白细胞介素8(IL-8)也称作CXCL8,是趋化因子的一种[4]。IL-8被证实可联合血管内皮生长因子建立肿瘤新的脉管系统,从而促进乳癌的发生发展[5]。有研究表明,ER-β可通过炎症通路来调控IL-8等相关炎性因子进而抑制前列腺癌的发生发展[6]。同时也有研究证实,在乳癌中ER-β可上调IL-8的启动子活性,从而促进乳癌的侵袭[7]。本研究以TNBC细胞MDA-MB-231为模型,探讨了ER-β对IL-8的调控作用并进一步验证其对乳癌细胞增殖、迁移和凋亡的影响。
1 材料和方法
1.1 实验材料
人乳癌细胞株MDA-MB-231由湖北普诺赛公司提供。ER-β过表达慢病毒(Ubi-MCS-3FLAG-CBh-gcGFP-IRES-puromycin,上海吉凯公司),高糖DMEM培养液(大连美仑公司),胎牛血清(进阶生物公司),人重组IL-8(苏州派普泰克公司),CCK-8细胞增殖检测试剂盒和结晶紫(北京索莱宝公司),Annexin V-7ADD/PE凋亡检测试剂盒(美国BD公司),抗ER-β、Bax、Bcl-2和Cleaved caspase-3单克隆一抗(美国CST公司),抗IL-8单克隆一抗(上海艾博抗公司),二抗及GAPDH一抗(武汉伊莱瑞特公司)。荧光显微镜、倒置相差显微镜(日本Olympus公司),酶标仪(瑞士Tecan公司),流式细胞仪(美国Apogee公司),显影仪(赛默飞世尔科技公司)。
1.2 实验方法
1.2.1细胞培养与分组 MDA-MB-231细胞接种在含有体积分数0.10胎牛血清的DMEM培养液中,置于37 ℃、体积分数0.05 CO2培养箱中,细胞汇合度90%左右传代。实验分组:未转染的人乳癌细胞为正常对照组(a组),转染ER-β过表达慢病毒为过表达组(b组),载体空载为阴性对照组(c组),在转染ER-β过表达慢病毒后再使用人重组IL-8(150 μg/L)为IL-8干预组(d组)。
1.2.2细胞转染 将对数生长期的乳癌细胞接种在6孔板中,当细胞汇合度达到60%~70%时,更换1 mL含有体积分数为0.10胎牛血清的高糖DMEM培养液,ER-β过表达组加入40 μL助转试剂A和2 μL的ER-β过表达慢病毒,空载组加入40 μL助转试剂A和2 μL阴性对照慢病毒,轻轻晃匀,根据细胞状态8~12 h后换液。72 h后荧光显微镜下观察,取稳定转染的细胞用于后续实验。
1.2.3细胞增殖实验 将各组按每孔5×103个细胞接种于96孔板中,设置5个复孔。24 h后每孔更换90 μL完全培养液,并加入10 μL 的CCK-8试剂,37 ℃、避光孵育2 h后使用酶标仪检测450 nm波长处的吸光度,连续测量5 d。细胞活力以OD值表示。
1.2.4流式细胞术检测细胞凋亡 分别收集各组细胞1×105个,以PBS洗涤2次后重悬于100 μL的1×Binding buffer中,分别在细胞悬液中加入Annexin V-7ADD和PE试剂各5 μL,在常温、避光条件下孵育20 min,使用流式细胞仪检测各组细胞的凋亡率。
1.2.5细胞迁移实验 将各组细胞用无血清的高糖DMEM接种于24孔Transwell板的小室中,每孔1×105个。每孔加入500 μL含体积分数0.20胎牛血清的高糖DMEM培养液,培养24 h后弃培养液,擦去小室内的细胞,以40 g/L的多聚甲醛固定30 min,用1 g/L的结晶紫染色30 min,随机选取5个视野拍照。
1.2.6蛋白印迹实验 收集细胞沉淀,加入160 μL预冷的RIPA裂解液和1 μL蛋白酶抑制剂,BCA法测定蛋白浓度。将上样缓冲液按1∶4的比例与总蛋白混匀,在95 ℃下加热5 min。选用150 g/L的SDS-PAGE胶分离电泳(每孔30 μg),然后转到PVDF膜上,再用50 g/L脱脂奶粉封闭2 h。TBST洗涤PVDF膜3次,一抗孵育过夜(4 ℃),二抗孵育1.5 h。 ECL发光成像,使用Image J软件分析目的条带灰度值,以GAPDH为内参照。
1.3 统计学方法

2 结 果
2.1 ER-β过表达慢病毒转染效率检测
ER-β过表达及空载慢病毒转染72 h后,在荧光显微镜下观察有90%以上的细胞内绿色荧光蛋白(GFP)表达阳性(图1)。Western blot半定量分析表明,3组ER-β蛋白表达量差异具有统计学意义(F=60.26,P<0.05),过表达组(0.52±0.10)高于正常对照组(0.06±0.01)和阴性对照组(0.06±0.01);3组IL-8的蛋白表达量差异具有统计学意义(F=31.17,P<0.05),过表达组(0.10±0.02)低于正常对照组(0.22±0.03)和阴性对照组(0.20±0.01)。见图2。提示慢病毒转染能够明显增加乳癌细胞中ER-β的表达,同时降低IL-8的表达。

A:荧光显微镜下ER-β过表达组慢病毒转染效率;B:同一视野白光下细胞。100倍。

A:各组细胞中ER-β、IL-8蛋白的表达;B:各组细胞蛋白表达量比较。a:正常对照组,b:过表达组,c:阴性对照组。与a组比较,*P<0.05,#P>0.05。
2.2 ER-β对人乳癌细胞增殖能力的影响
CCK-8检测结果显示,ER-β过表达抑制了细胞活力,不同时间、不同组别及其二者交互比较,差异均有统计学意义(F时间=1 351.00,F组别=215.20,F时间×组别=70.89,P<0.05)。转染第1、2天,4组间差异无统计学意义(P>0.05)。值得注意的是,第3~5天,正常对照组的细胞活力值分别为0.53±0.01、0.79±0.01和1.18±0.04,阴性对照组分别为0.53±0.01、0.77±0.01和1.14±0.06,这两组间差异无统计学意义(P>0.05);过表达组分别为0.41±0.01、0.54±0.03和0.68±0.04,这3组间差异均具有统计学意义(P<0.05)。IL-8干预组第1~5天的细胞活力值则分别为0.32±0.02、0.38±0.02、0.45±0.01、0.54±0.02和0.72±0.02,与过表达组比较差异均无统计学意义(P>0.05)。见图3。

A:各组细胞5 d内的增殖变化;B:各组细胞5 d内增殖能力比较。a:正常对照组,b:过表达组,c:阴性对照组,d:IL-8干预组。与a组比较,*P<0.05,#P>0.05。
2.3 ER-β对人乳癌细胞迁移能力的影响
细胞迁移实验的结果显示,正常对照组的迁移细胞数量为每高倍视野545.00±27.94,过表达组为291.30±11.59,阴性对照组为554.00±18.68,IL-8干预组为443.70±39.55,4组细胞的迁移能力比较差异有显著意义(F=84.84,P<0.05)。正常对照组与阴性对照组迁移细胞数比较,差异无统计学意义(P>0.05);而过表达组则明显少于正常对照组,差异具有统计学意义(P<0.05);IL-8干预组明显多于过表达组,差异具有统计学意义(P<0.05)。见图4。

A:Transwell实验检测细胞迁移能力,100倍;B:各组迁移细胞数比较。a:正常对照组,b:过表达组,c:阴性对照组,d:IL-8干预组。与a组比较,*P<0.05,#P>0.05。
2.4 ER-β对人乳癌细胞凋亡的影响
流式细胞术分析显示,正常对照组细胞凋亡率为(4.60±0.46)%,过表达组为(46.57±1.48)%,阴性对照组为(5.20±0.36)%,IL-8干预组为(25.00±3.15)%,4组细胞凋亡率比较差异具有显著性(F=459.50,P<0.05)。正常对照组细胞凋亡率和阴性对照组相比较,差异无统计学意义(P>0.05);而过表达组明显低于正常对照组,差异具有统计学意义(P<0.05);IL-8干预组明显高于过表达组,差异具有统计学意义(P<0.05)。见图5。

A:流式细胞术检测各组细胞凋亡率(早期凋亡率+晚期凋亡率);B:各组细胞凋亡率比较。a:正常对照组,b:过表达组,c:阴性对照组,d:IL-8干预组。与a组比较,*P<0.05,#P>0.05。
2.5 各组细胞Bax、Bcl-2和Cleaved caspase-3蛋白表达比较
蛋白印迹实验结果显示,4组细胞中Bax/Bcl-2、Cleaved caspase-3的表达水平比较,差异具有统计学意义(F=20.67、89.64,P<0.05)。过表达组Bax/Bcl-2、Cleaved caspase-3表达均明显高于正常对照组及阴性对照组,差异均具有统计学意义(P均<0.05);正常对照组和阴性对照组比较,差异均无统计学意义(P>0.05)。当转染组细胞加入IL-8培养后,Bax/Bcl-2、Cleaved caspase-3蛋白的表达较过表达组均明显降低,差异均具有统计学意义(P均<0.05)。见图6。
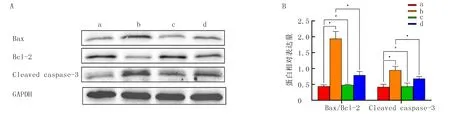
A:各组细胞蛋白表达的蛋白印迹检测;B各组细胞蛋白表达量比较。a:正常对照组,b:过表达组,c:阴性对照组,d:IL-8干预组。与a组比较,*P<0.05,#P>0.05。
3 讨 论
目前乳癌病理分类中将ER的状态完全取决于ER-α的表达[8],但与其结构有一定同源性的ER-β的作用尚不明确。现有研究已证实,大约有30%的TNBC细胞表达ER-β[9],ER-β能否像ER-α一样成为内分泌治疗靶点值得期待[10]。既往研究报道,ER-β在ER-α存在的情况下发挥抗乳癌细胞增殖的作用,而在ER-α缺失的情况下又发挥促增殖作用[11]。也有研究结果证实,ER-β的激活可在没有配体(雌激素)诱导的情况下,通过诱导胱抑素分泌蛋白家族在TNBC中引发有效的抗癌作用[9]。近期ALEXANDROVA等[12]也在3种TNBC细胞中证实,ER-β1过表达可降低细胞增殖能力,抑制了细胞克隆形成。本研究以TNBC细胞株MDA-MB-231为研究对象,通过上调细胞中ER-β表达来观察其对细胞学行为的影响,结果表明,过表达ER-β后癌细胞出现增殖的抑制、更高的凋亡率以及低迁移率等。这与ALEXANDROVA等[12]研究结果相一致。提示ER-β可能是调控TNBC生物学行为的重要因子,深入研究其下游分子机制具有重要意义。
IL-8是一种炎症趋化因子,在黑色素瘤、肺癌等多种癌症进展中发挥着关键作用[13-16]。已有研究证明,在乳癌中IL-8与其侵袭潜力之间存在正相关[17-19]。既往主要将其归因于IL-8对中性粒细胞的趋化作用所致[20],而近年研究结果显示,IL-8可通过上调基质金属蛋白酶2或基质金属蛋白酶9的表达和激活PI3K-Akt/MAPK信号通路来增加TNBC细胞的侵袭性[21-22]。在体内模型中,靶向阻断IL-8-CXCR1/2轴可有效阻止癌细胞生长和扩散[23]。有研究报道,化疗期间血浆IL-8浓度越低的病人可获得越高的长期存活率[24]。在一项针对前列腺癌研究中发现,过表达ER-β可抑制炎性因子的表达,进而抑制肿瘤的发展[7]。本研究结果显示,ER-β可通过影响IL-8的表达实现对乳癌细胞生物学行为的调控。ER-β过表达后,IL-8的表达明显降低,线粒体途径凋亡蛋白Bax/Bcl-2、Cleaved caspase-3的表达量增加,从分子水平解释了ER-β过表达后乳癌细胞凋亡率增加的机制。
综上所述,过表达ER-β可以抑制MDA-MB-231细胞中IL-8表达,抑制其迁移并促进其凋亡,这可能为TNBC病人的内分泌治疗提供依据。同时,本研究显示ER-β可抑制癌细胞的增殖,但并非通过调控IL-8通路,其具体分子机制还有待进一步探讨。今后,我们也将在更多的TNBC细胞系中进一步验证该结论的可靠性。