QuEChERS预处理技术在饲料安全多组分同步分析中的应用
■王金荣
(河南工业大学生物工程学院,河南郑州 450001)
近年来,随着科技的进步,饲料中单组分分析检测技术已经非常成熟,检测限和定量限均能满足饲料安全监督的要求。但是在实际饲料安全检测中,饲料基质复杂,污染物种类繁多,一方面同类物质之间在检测时可能存在相互干扰,另一方面对每种单一物质的检测与排除也增加了检测的工作量。传统的化学分析方法很难一次性精确定量检测出多种组分,因此多组分同步分析技术逐渐成为饲料安全检测的重要技术支撑。样品的预处理是实现饲料多组分同步分析的关键环节,目前也是整个分析过程的瓶颈,其结果的精准性直接决定分析结果的准确性。常规的样品预处理包括被分析物的提取、净化和浓缩等步骤,有些样品预处理过程中还需要同时进行衍生化处理。传统的样品预处理过程通常是分步进行的,过程冗长,甚至需要消耗大量的化学试剂等,不符合现代饲料安全快速、高通量检测分析的要求。因此,研究与建立新型的简单、便捷、快速的饲料样品预处理技术变得尤为重要。QuEChERS 是近年来发展迅速的一种多组分分析净化方法,其结合了液液萃取和分散固相萃取净化,为气相色谱、液相色谱分析及质谱确证分析提供了干净的样品,非常适合对复杂基质的样品进行分析。由于该方法在最初提出的时候被认为特别适用于提取极性和碱性化合物,因此,基于QuEChERS 开发的大多数方法主要涉及从各种基质中提取农药和污染物,特别是对水果、蔬菜和其他食品中农残及污染物分析中应用较为广泛。文章主要围绕QuEChERS技术进展及其在饲料中霉菌毒素、禁限用药物等饲料安全检测方面的应用进行综述,并对QuEChERS在饲料安全检测中的应用进行展望。
1 QuEChERS方法简介
QuEChERS 是快速(Quick)、简便(Easy)、廉价(Cheap)、高效(Effective)、稳定(Rugged)和安全(Safe)的简称,作为多残留分析方法首次于2002 年在罗马召开的欧洲农药残留研讨会上,由Anastassiades等[1]提出,并于2003 年公开发表详细的操作方法[2],2005 年Lehotay等[3]采用该方法测定了蔬菜和水果中的229种农药,验证了该方法的可行性。QuEChERS 方法的基本原理是分散固相萃取,采用乙腈对样品进行提取,经氯化钠、无水硫酸镁等进行盐析分层后采用吸附剂对提取液进行净化,去除杂质,净化后的样品再由色谱或质谱仪器进行定量分析,并形成了最初的3种标准方法(见表1)。

表1 基于QuEChERS方法分析的主要步骤
该方法的使用不仅减少了实验室玻璃器皿等耗材的使用,同时也减少了样品和有机溶剂的使用,减少了环境污染。大多数被测物质(尤其是杀虫剂)应用QuEChERS方法处理都能获得满意的回收率,对于提取效率低的(如极性大的、酸或碱性)分析物相对比较麻烦,通常需要对QuEChERS 方法进行改进[6]。QuEChERS 方法最初仅仅用于对含水量高或低脂肪含量的样品检测的预处理(如水分含量高的水果、蔬菜和果汁等),而其他类型的食品样品(如中、高脂肪含量和色素含量高或者叶绿素含量高的食品样品),则需要进一步地处理。而对于含水量低于80%的样品,通过加水使样品总质量达到10 g,可以减少分析物与基质间的相互作用,从而提高分析物的净化效率。此外,干燥食品、饲料和一些复杂基质的样品,通常共同提取物比较多,应用QuEChERS方法预处理相对较为困难。随着检测技术的不断发展,检测样品的种类及性质也不断发生变化,上述3种方法不能完全满足实际分析的要求,因此国内外研究学者对QuEChERS 前处理方法进行了改进,针对分析目标物的不同,优化有效的提取溶剂、盐析的质量和比例、样品质量以及样品/溶剂值、pH等条件,根据复杂基质分析的要求选择适宜的吸附剂类型,实现样品的高效提取与净化分离。
根据PubMed 统计,QuEChERS 方法自2002 年提出发展至2021 年12 月,采用QuEChERS 作为样品预处理方法已发表2 196 篇论文,测定蔬菜、食品、饲料等样品中农药残留、霉菌毒素、抗氧化剂等分析的样品净化方法。一些研究报告对QuEChERS 方案进行了不同的改进或修改,以确保更加有效地提取被测目标物,并最大程度地减少不稳定分析物的降解,提高分析效率。综合文献分析,采用QuEChERS进行预处理方法与传统的萃取技术相比具有很多优势,测定所需要的样品质量和溶剂使用量均减少,同时样品预处理的时间更短。此外,大多数已发表的研究成果表明,QuEChERS 方案提供了比传统程序更高的回收率和更好的分析性能。
2 QuEChERS方法与其他预处理方法比较
QuEChERS 方法的应用范围十分广泛,传统的样品前处理方法[如液-液萃取、液固萃取(包括索氏提取)方法]需要使用大量的有机溶剂,不仅对操作人员有潜在的健康影响,同时废液的处理困难,还可能造成环境污染;此外这两种方法操作步骤较为繁琐,耗时长,选择专属性差,无法满足复杂样品或痕量物质分析要求。近些年发展起来的样品预处理方法包括固相萃取(SPE)、液-液萃取(LLE)、加速溶剂萃取(ASE)、超声辅助萃取(UAE)和微波辅助提取萃取(MAE)等技术逐渐取代了传统的样品预处理方法,在分析效率上有了明显的提高。QuEChERS 方法与这些取代方法相比,减少了一些特殊设备的使用(如微波、超声波设备等),但是对于不同的分析物分析效果还是有显著的差别。Di等[7]分析土壤中的有机氯杀虫剂类化合物,与UAE 和ASE 方法相比,MAE 和QuEChERS 方法获得的结果偏高,但对于除草剂2,4-二氯苯氧乙酸(2,4-D)的提取效率却仅为57%。Orellana-Silla等[8]用MAE方法提取果汁中的氯苯脲,其净化效果优于QuEChERS 和C18 的固相萃取方法。但是QuEChERS 方法提取中草药植物根和茎中的农药残留比SPE 和LLE 方法效果好[9]。同样,在蜂蜜中农药残留的检测也是QuEChERS 方法效果优于SPE 和LLE方法[10]。Dong等[11]比较了SPE和QuEChERS方法对蔬菜和水果中真菌毒素净化分析效率,发现SPE在真菌毒素的测定中表现出更高的选择性、准确度和精密度。与ASE方法相比,QuEChERS 方法提取芹菜和莴苣中卡马西平、对乙酰氨基酚等11 种目标药物更有效,采用液相色谱-串联质谱测定11种药物的回收率为70.1%~118.6%,相对标准偏差(RSD)均低于20%,并且减少了样品制备的时间和成本,使用的有机溶剂更少[12]。Panasiuk 等[13]采用固液萃取(OASIS HLB 柱或免疫亲和柱)、QuEChERS 和Mycosep 225 Trich 柱的样品预处理,同时测定饲料中的脱氧雪腐镰刀菌烯醇(DON)、3-乙酰脱氧雪腐镰刀菌烯醇(3Ac-DON)、15-乙酰脱氧雪腐镰刀菌烯醇(15Ac-DON)、DON-3-葡萄糖苷(DON-3Glc)雪腐镰刀菌烯醇和镰刀菌烯酮-X,并使用液相色谱-串联质谱法进行检测,发现6种免疫亲和柱对所有霉菌毒素测定均没有交叉反应,但是免疫亲和柱如果与3Ac-DON 结合,则不能与15Ac-DON结合;其中Mycosep 225 Trich净化效果最好,能够净化所有上述6种毒素完全分离,包括3Ac-DON 和15Ac-DON 异构体形式,回收率为92%~97%,定量限(LOQ)为1.30~50.00 g/kg。
3 QuEChERS在饲料安全多组分分析检测中的应用
3.1 饲料中霉菌毒素的检测
霉菌毒素是由真菌产生的次生代谢产物,具有致畸、致癌、致突变特性。霉菌毒素的污染对粮食生产、饲料生产及养殖生产造成了巨大的经济损失,此外霉菌毒素在动物性食品中的残留还可通过食物链对人类健康构成潜在危害。因此,对饲料中霉菌毒素的准确检测是饲料安全的重要技术保障。黄曲霉毒素是黄曲霉和寄生曲霉等某些菌株产生的双呋喃环类毒素,其衍生物约有20 种,其中以B1 的毒性最大,致癌性最强,也是饲料及食品安全卫生中必检的指标之一。Choochuay 等[14]建立了碎米、花生、玉米和鱼粉4 种饲料中的黄曲霉毒素B1(AFB1)的方法,样品预处理基于QuEChERS 方法进行,用乙腈/甲醇(40/60,V/V)提取AFB1,用氯化钠和硫酸镁进行层析净化,采用柱前衍生化和荧光检测的高效液相色谱法进行检测,回收率为82.50%~109.85%,在20~100 ng/g范围内AFB1 的相对标准偏差低于11%,检测限(LOD)为0.2~1.2 ng/g,LOQ 为0.3~1.5 ng/g。用这种方法对120份饲料样品进行检测,AFB1 污染程度:碎米0.44~2.33 ng/g、花生3.97~106.26 ng/g、玉米0.88~50.29 ng/g和鱼粉1.06~10.35 ng/g。玉米赤霉烯酮(ZEA)是具有雌激素样作用的霉菌毒素,主要污染玉米、小麦、大米、大麦、小米和燕麦等谷物,能造成动物急性、慢性中毒,引起动物繁殖机能异常甚至死亡。Llorent-Martínez等[15]利用QuEChERS程序提取饲料原料中的玉米赤霉烯酮,回收率为93%~107%,用LC-MS进行定量分析,定量限满足欧洲共同体委员会规定的最大残留水平。藤毒素是由链格孢霉产生的一种霉菌毒素,广泛污染谷物和饲料。王瑞国等[16]应用QuEChERS-超高效液相色谱-质谱联用技术(UPLC-MS/MS)分析饲料中的腾毒素,以0.1%甲酸乙腈提取,用C18和PSA 做吸附剂进行净化后检测,腾毒素在1~500 μg/kg 浓度范围内线性关系良好,相关系数为0.997 6~0.999 2,在饲料中添加浓度为5、25、125 μg/kg 时回收率为89.1%~105.7%,定量限为2.0 μg/kg。
由于饲料中霉菌种类很多,产毒霉菌在外环境满足霉菌生长需求时则继续产生毒素,并且会存在多种霉菌毒素的积累叠加,饲料中具有多种霉菌毒素同时存在的风险。Jo 等[17]使用QuEChERS 结合LC-MS/MS方法测定了饲料中13 种霉菌毒素,并对方法的检出限、定量限、线性和回收率进行了分析方法验证,同时考虑了基质效应,均达到了可接受的验证水平范围。用该方法测定的39个饲料样品中,9个样品主要由伏马菌素B1(FB1)、脱氧雪腐镰刀菌烯醇、伏马菌素B2和玉米赤霉烯酮污染,其中FB1 的检测浓度最高为18.094 3 mg/kg。崔晓娜等[18]建立了饲料中17种霉菌毒素同时检测的方法,包括黄曲霉毒素(B1、B2、G1、G2)、赭曲霉毒素A、T-2毒素、HT-2毒素、橘青霉素、蛇形菌素、疣孢青霉原、新茄镰孢菌醇、O-甲基杂色曲霉素、杂色曲霉素、青霉酸、环匹阿尼酸、伏马菌素(B1、B2),采用QuEChERS 方法净化后用高效液相色谱-四级杆飞行时间质谱(HPLC-Q-TOF/MS)检测,外标法定量,在1.0~200.0 μg/L范围内呈线性,相关系数均大于0.990,检出限在0.5~3.0 μg/kg,定量限在1.0~10.0 μg/kg。同样,刘玲利[19]也利用改进的QuEChERS方法对饲料及其原料样品进行预处理,测定了19 种霉菌毒素,以0.3%甲酸的乙腈溶液为提取剂提取30 min,以0.5 g氯化钠和1.5 g无水硫酸镁为盐析剂,吸附剂由150 mg C18、20 mg 伯仲胺(primary secondary amine,PSA)和150 mg 无水硫酸镁组成。通过对色谱条件、质谱条件和前处理条件的优化,建立同时测定19种霉菌毒素的HPLC-MS/MS法。19种霉菌毒素的相关系数为0.992 1~0.999 6,线性范围为0.05~200.00 μg/L。饲料样品中19种霉菌毒素的方法检出限和定量限分别为0.12~3.85 μg/kg和0.40~10.80 μg/kg,加标回收率为80.6%~94.0%,相对标准偏差为7.15%~13.70%。原料样品中19种霉菌毒素的方法检出限和定量限分别为0.10~3.40 μg/kg 和0.25~10.00 μg/kg,加标回收率为83.6%~95.4%,相对标准偏差为6.20%~12.60%,所建立的方法线性良好、检出限低、准确度高、精密度好。由于饲料基质成分复杂,一些被测物质在样品提取后通常需要净化后才能进行仪器分析,否则提取液中复杂的成分不仅干扰测定结果,同时还可能会对分析柱或分析设备造成损坏,因此提高饲料样品的净化程度是提高分析效率的有效方法。优化QuEChERS 提取程序可以降低饲料基质影响,González-Jartín 等[20]通过优化QuEChERS 程序并结合超高液相色谱-串联质谱(UHPLC-MS/MS)对饲料中黄曲霉毒素B1、B2、G1、G2 等22 种霉菌毒素进行定性、定量分析,方法的回收率67%~94%,定量限0.22~32.64 μg/kg。用这种方法检测7 种原料和8 种饲料产品的回收率符合现行标准的要求。同时分析了附近饲料厂的75 个样品,发现玉米和基于玉米的饲料产品中霉菌毒素发生率最高,但均低于标准限量。恩尼克菌素(ENNs)和白僵菌素(BEA)是镰刀菌属产生的次生毒性代谢物,近年来在谷物和副产品中被广泛发现,对饲料安全构成了重大风险。采用乙腈萃取、QuEChERS 样品处理后用LC-MS/MS 对39份饲料原料和其生产的48份饲料进行检测,发现饲料原料和配合饲料的检出率分别为18%和92%[21]。Facorro等[22]采用分散萃取和QuEChERS 萃取方法对20 个奶牛场饲料中的26 种霉菌毒素进行提取分离,采用高分辨质谱进行确证分析,大多数毒素的回收率都大于80%,检出限达到ng/mL 水平,其中玉米赤霉烯酮、伏马菌素B1和β-玉米赤霉烯醇的检出率为60%~90%。范志辰等[23]采用QuEChERS 前处理技术,建立了超高效液相色谱-质谱联用技术(UHPLC-MS/MS)检测饲料样品中30 种不同的真菌毒素含量的分析方法。饲料样品用水和含1%(V/V)甲酸的乙腈溶液等比例混合后提取,上清液氮吹至近干,残渣经5 mmol/L乙酸铵水溶液-乙腈(80∶20,V/V)复溶后上机测定,30 种真菌毒素的平均加标回收率为72.0%~118.4%(n=5),在一定浓度范围内线性关系良好,相关系数大于0.99,检出限和定量限分别为0.7~20.0 μg/L 和2~50 μg/L。Amelin等[24]采用气-液色谱法电子捕获检测器同时测定谷物和饲料中单端孢霉烯类毒素T2、HT-2、脱氧缬氨醇和雪腐镰刀菌烯醇,用乙腈提取样品中的毒素,与三氟乙酸酐衍生后用QuEChERS方法净化和浓缩,4种毒素的回收率均大于90%,分析时间0.5~1.0 h,相对标准偏差RSD<5%。
综上,饲料中的霉菌毒素采用QuEChERS方法或改进后的QuEChERS方法进行样品预处理,均能提高霉菌毒素的分析性能,缩短检测时间,同时所用的提取溶剂少,并能够实现多种霉菌毒素的同步分析。
3.2 饲料中药物的检测
饲料中药物的使用是一定历史时期的产物,我国从2020 年1 月1 日起,在饲料中全面禁止添加抗生素,减少滥用抗生素造成的危害,以维护动物源性食品安全和公共卫生安全。一些激素类的违禁药物、用于治疗或促生长的抗生素类药物等的违规使用,可能会导致饲料及食品安全事件发生,因此对饲料中药物的监测显得更为重要。基于QuEChERS 及其改良的预处理技术对药物进行净化与浓缩,是近年来饲料中药物准确及快速检测的重要保证。罗辉泰等[25]用改进的QuEChERS 对饲料中17 种β-受体激动剂、18 种β-内酰胺类、6种抗球虫类、5种大环内酯类、2种林可胺类、15 种喹诺酮类、21 种磺胺类及3 种磺胺类增效剂等8类共计87种兽药进行测定,样品经Na2EDTA溶液分散后,以甲醇-乙腈(50∶50)超声提取,提取液用Bondesil—PSA 吸附剂以分散固相萃取方式快速净化,超高效液相色谱-质谱联用技术进行定性筛查和定量分析,87 种药物在相应的浓度范围内线性良好,相关系数均大于0.99,加标回收率为63.7%~108.8%,检出限和定量限分别为3~15 μg/kg 及10~50 μg/kg[25]。磺胺类药物因其广谱抗菌、高效、低毒及价格低廉,在动物养殖中广泛应用,曾经一个重要的给药途径是通过添加到饲料中使用。徐坚等[26]用乙腈提取饲料样品中5 种磺胺类药物,采用QuEChERS 进行预处理后用高效液相色谱进行检测,在10~500 μg/L 范围内,5 种磺胺类药物线性良好,相关系数大于0.999 0,检出限和定量限分别为0.05 mg/kg 和0.1 mg/kg,在0.1~10.0 mg/kg添加浓度范围内,猪、鸡配合饲料中磺胺类药物平均回收率为76.0%~101.0%[26]。刘新辉等[27]基于QuEChERS 方法对饲料样品进行净化,采用Cleanertlipo No 和Cleanert PSA 进行净化,比固相萃取净化基质效果好,并实现了饲料中20种β-受体激动剂类和3种喹噁啉类药物的同时检测,超高液相色谱串联质谱定量,在1~50 ng/mL 范围内线性关系良好(R2>0.99),β-受体激动剂类定量限为5 μg/kg、喹噁啉类定量限为50 μg/kg,添加回收率在88.2%~105.0%范围内,相对标准偏差均小于8.4%。表2是近10年来采用QuEChERS方法进行样品预处理并结合质谱对饲料中的药物进行检测的文献[28-34]。由表2可知,QuEChERS方法或改进的QuEChERS 方法对饲料中的药物分析均具有良好的净化效果,并且能够对多种药物实现同步分析,提高了分析方法性能,大部分文献的回收率均达到建立分析方法的标准,检出限和定量限也能满足现行分析方法的要求。
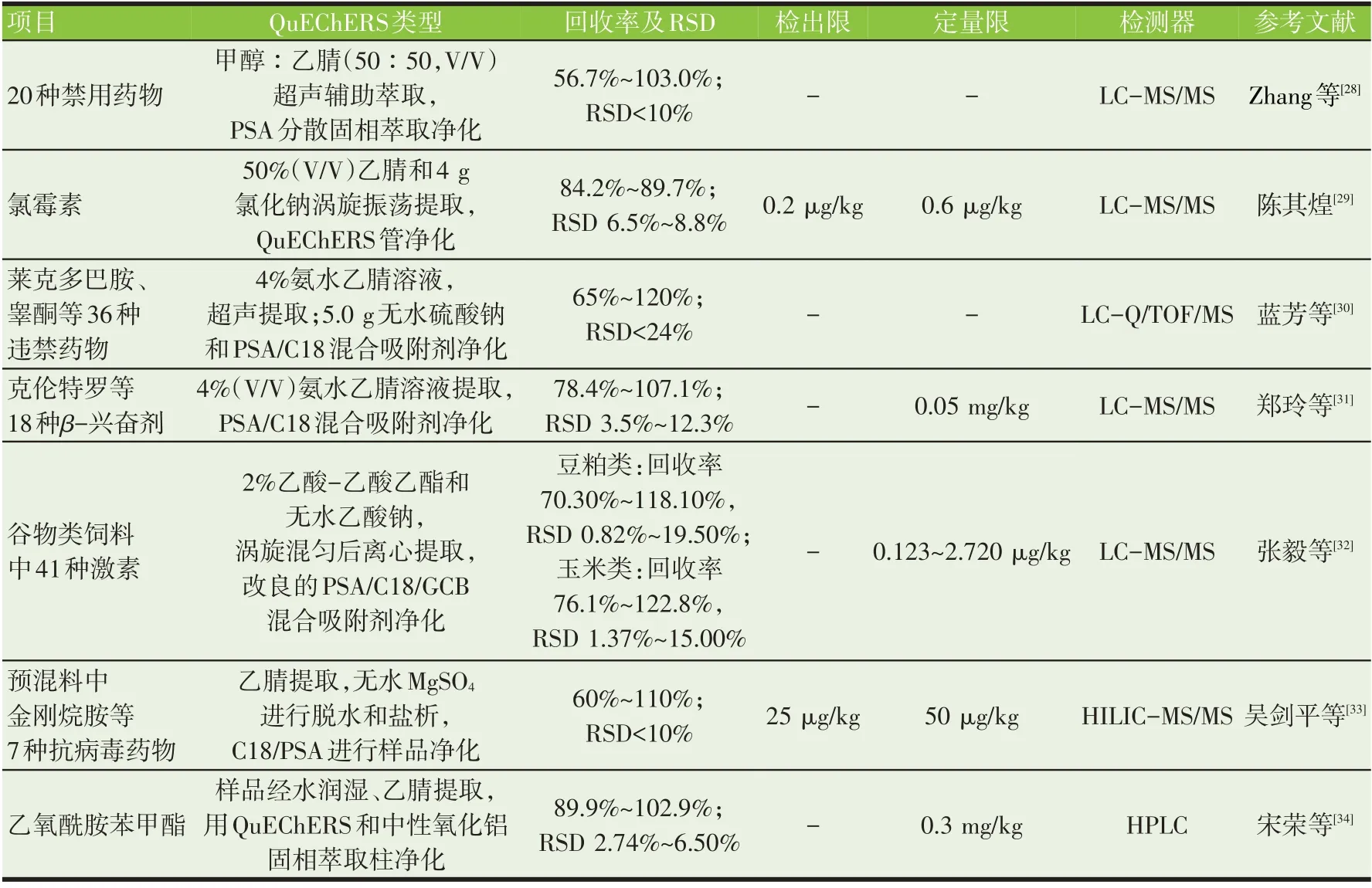
表2 饲料中药物检测
3.3 其他应用
QuEChERS 净化技术不仅仅用在饲料中霉菌毒素、抗生素、违禁药物等的检测,也可以用于饲料中抗氧化剂、着色剂、植物精油、农药残留等成分检测的样品预处理。乙氧基喹啉属于喹诺酮类药物,曾经在饲料中用作抗氧化添加剂和杀菌剂,欧盟(EU)2017/962规定禁止其作为所有动物物种和类别的饲料添加剂使用。使用改进的QuEChERS 方法从动物饲料中提取乙氧基喹啉,并加入抗坏血酸缓冲液防止降解,用气相色谱联用三重四极杆质谱(GC-QQQ)进行检测,回收率为70%~120%(RSD<20%)。采用QuEChERS方法在2018 年和2019 年期间,对来自西班牙加泰罗尼亚(Catalonian)地区农业生产生产的70 份饲料样品进行了分析,43%的样品检出乙氧基喹啉[35]。同样,用乙腈提取饲料样品中的8 种抗氧化剂,采用改进优化的QuEChERS 预处理方法结合UPLC-MS/MS进行检测,检出限为0.005~0.100 mg/kg,定量限0.01~0.20 mg/kg,在低、中、高3 个不同浓度梯度的平均加标回收率为76.2%~102.8%[36]。
饲料中使用着色剂可以增加畜禽(蛋禽、肉禽)和水产养殖动物产品色泽,如使牛奶中黄油、禽蛋的蛋黄等具有更鲜艳美观的色泽,水产养殖动物诸如鱼类和甲壳类、对虾等产品肉质比天然产品更鲜艳,提高了商品的价值。在饲料中添加适量的着色剂,可以实现对畜禽产品(特别是禽类蛋黄及皮肤)色泽的精准调控。为满足饲料样品中脂溶性着色剂监控的需要,对饲料中着色剂的定性定量分析显得尤为重要。付岩等[37]用基于QuEChERS 的分散固相萃取方法对苏丹红Ⅰ、苏丹红Ⅱ、苏丹红Ⅲ、苏丹红Ⅳ、对位红、苏丹红7B、苏丹红G 和苏丹黄进行提取及样品净化,结合LC-MS/MS 方法检测,8 种脂溶性着色剂在1.0~200.0 μg/L 范围内线性关系良好,相关系数均大于0.998。所建立的方法对饲料的检出限为5.0 μg/kg,定量限为10 μg/kg,在10、50 μg/kg 和500 μg/kg 加标浓度下8种脂溶性着色剂的回收率为102%~111%。
牛至香酚的主要成分为香芹酚和百里香酚,香芹酚和百里香酚属于同分异构体,香芹酚中的-OH基团在甲基邻位,而百里香酚的-OH 在甲基的间位,两者的化学性质相似。采用QuEChERS 结合高效液相色谱法测定饲料中牛至香酚中的主成分含量,不同样品中的加标回收率为香芹酚92.4%~101.5%,百里香酚92.9%~98.7%;精密度(n=6)为香芹酚1.4%~4.8%,百里香酚为1.7%~4.5%;两种物质检出限均为0.1 mg/kg,定量限均为0.3 mg/kg[38]。
近年来QuEChERS 方案在饲料中农药残留检测方面也取得一定的进展,如饲料中的有机磷农药[39]、除草剂[40]、杀虫剂[41]、敌敌畏[42]等采用QuEChERS 预处理方法,结合液相色谱串联质谱进行快速筛查确证及定量分析,不仅提高了饲料中农药残留快速筛查的可靠性,同时可以获得较高灵敏度的定量结果,为饲料安全监测的快速高通量筛查提供准确、可靠的方法。
4 建议和未来展望
饲料安全的分析趋势不仅在于开发快速的检测方法,同时对于样品快速净化的预处理技术非常重要,能够在一次净化过程后分析尽可能多的污染物及其化学组成是理想的分析模式。QuEChERS 方法应用于饲料分析中的样品预处理,不仅扩大了被测物质的分析范围,同时对于复杂基质的净化能力也得到了提高。QuEChERS 萃取法结合HPLC-MS/MS 或GCMS/MS 分析可以同时确证和定量分析复杂基质中多类别、多残留分析物的方法。Teledyne Tekmar[43]提出了QuEChERS提取程序的全自动化方法,系统自动执行以下样品制备功能,如液体分配/移液、旋涡混合、小瓶摇动、打开/关闭样品小瓶、添加固体试剂(盐、缓冲液)、识别液位、倾析、离心、基质加标和d-SPE 净化。因此,未来QuEChERS方法在饲料分析自动化研发,可用于实验室大量样品的快速分析,实现样品的振荡、提取及净化任务的自动化程序。净化程序的自动化有助于节约成本,同时提高分析效率、高通量和再现性。
5 小结
由于QuEChERS应用的灵活性和快速特点,该方法已经成为样品分析预处理通用的一种方法,根据被分析物及样品基质的不同,可以对不同溶剂、盐、缓冲液和吸附剂等的具体参数进行优化,从而使QuECh-ERS方法能够广泛用于食品、饲料等复杂基质样品分析。基于QuEChERS方法的整体分析具有成本效益,因此应用范围还在不断地扩大。由于GC-MS/MS、LC-MS/MS、UHPLC-MS/MS、TOF-MS/MS 等检测系统无需进行大量样品制备,QuEChERS 程序可提供足够干净的提取物,因此二者结合应用可以实现多种农药、违禁药物以及抗氧化剂、精油、着色剂等多组分的同步分析。

