肉桂精油及其主要组分对饲料中常见真菌的抑菌活性的研究
■闫红秀 刘香萍 任乃芃 轩一芙 李孟滕 梁文超 包雨微
(黑龙江八一农垦大学动物科技学院,黑龙江大庆 163319)
饲料富含多种营养成分,且结构疏松、吸湿性强,因此在一定温度、湿度条件下,微生物易繁殖而发生腐败或霉变,导致饲料感官发生改变,营养价值降低,缩短饲料贮存期,造成饲料资源的浪费。在饲料中加入防霉剂等饲料添加剂,是提高饲料稳定性和延长贮存期的重要手段[1]。如在饲料中添加丙酸[2]、双乙酸钠[3]、苯甲酸和苯甲酸钠[4]、富马酸二甲酯[5],能有效抑制霉菌等有害微生物的生长繁殖,延长饲料安全贮藏期。然而传统防霉剂存在着导致动物肠道菌群失衡、药物残留和抗药性等问题和风险。因此,寻找安全高效、绿色无残留、环保、多功能的饲料添加剂成为热点。
植物精油萃取自植物组织,有液体黄金的美誉,是现今发展较快的新型饲料添加剂,也是目前畜牧业、饲料工业研发的重点和热点之一[6]。肉桂精油在很多研究中表现出了很好的抗菌活性和抗氧化活性。陈毅然等[7]发现肉桂精油对黑曲霉(Aspergillus niger)和棕曲霉(Aspergillus ochraceus)具有最佳的抑制效果,优于山苍子精油和丁香精油;邱实等[8]研究表明肉桂精油能够有效抑制黄曲霉毒素(Aspergillus flavus),对莲子中黄曲霉毒素的污染起到保护作用;余炜等[9]探讨了肉桂精油抗油脂氧化的能力,当加入量为0.000 2%(质量浓度)时,抗氧化效果最好;El-Baroty等[10]通过DPPH自由基清除与β-胡萝卜素漂白法证实了肉桂精油具有明显的抗氧化活性,可作为抗氧化剂的来源。目前肉桂精油已广泛应用于食品工业、果蔬保鲜、化工和畜牧业等领域,在饲料工业中,肉桂精油拥有良好的应用前景[11]。但肉桂精油中各主要组分抑菌活性尚未明确,因此有必要进一步进行研究。
文章在明确饲料中主要致腐真菌种类基础上,进一步探究肉桂精油中各主要组分抑菌活性差异,为肉桂精油各组分进一步开发作为潜在饲料防霉剂提供新的思路。
1 材料与方法
1.1 试验材料
分离霉菌材料:豆粕。
肉桂精油,由黑龙江八一农垦大学草业科学实验室采用水蒸气法提取;邻甲氧基肉桂醛,购自上海毕得医药科技有限公司;肉桂醛、乙酸桂酯、苯甲醛,购自上海阿拉丁生化科技股份有限公司。
1.2 试验方法
1.2.1 肉桂精油组分分析
气相色谱-质谱(GC-MS)气质联用条件为:色谱柱为DB-17MS 型毛细管柱(30 m×0.25 mm×0.25 μm,日本岛津公司);起始温度100 ℃,5 ℃/min的速率升至230 ℃,保持5 min;进样量1 μL;分流比20∶1;以氦作为载体气体;载气流量1 mL/min;质谱(MS)条件:EI离子源温度:230 ℃;电子能量:70 eV;扫描质量范围15~500 aum。按上述条件对精油样品进行GC-MS测定,将样品峰质谱通过与NIST02 质谱库中对比记录得出结论,每种精油组分(以面积百分比表示)通过峰面积归一化法分析各组分面积百分比。
1.2.2 饲料中真菌的分离纯化
对饲料中真菌的分离培养,根据形态特征计算分离率,用接种针挑取分离率较高菌种的单个菌落,转接至新的马铃薯葡萄糖琼脂(PDA)培养基上继续培养,置于28 ℃恒温培养箱内,培养5 d,培养期间观察菌落生长情况,并用光学显微镜镜检产孢情况。产孢后进行单孢分离纯化,用斜面PDA培养基,在4 ℃下保存菌种。
1.2.3 饲料真菌的形态学鉴定
采用菌落特征观察和显微观察两部分,利用光学显微镜,从真菌的培养基、菌落、分生孢子、顶囊等方面对真菌进行初步鉴定。
1.2.4 饲料真菌的分子生物学鉴定
对纯化真菌利用Omega真菌DNA提取试剂盒提取DNA,并测定真菌DNA浓度。利用rDNA-ITS区通用引物ITS1(5'-GTGTTGGGTGTTTGTCTCGC-3')和ITS4(5'-GCAAAGCGCGA GATGTACTG-3')进行PCR 扩增,PCR反应体系及反应流程如表1、表2所示。将PCR产物送至生工生物工程(上海)股份有限公司测序,所得序列与NCBI上的GenBank数据库进行BLAST比对,并利用邻接(NJ)法构建发育树。

表1 真菌PCR反应体系

表2 真菌PCR反应条件
1.2.5 抑菌圈直径测定
采用滤纸片琼脂扩散法测定肉桂精油及其主要组分肉桂醛、乙酸桂酯、邻甲氧基肉桂醛、苯甲醛对分离得到真菌的抑菌圈直径[12]。取真菌孢子悬浮液(106~107CFU/mL)100 μL于PDA培养基上均匀涂布,待菌液稍干,在每个培养皿中央贴一片含药滤纸片(6 mm,4 μL),同时以饲料中常用的防霉剂双乙酸钠(250 mg/mL)和山梨酸钾(250 mg/mL)为阳性对照,无菌水和二甲基亚砜(DMSO)为阴性对照,每组3 个重复,置于28 ℃培养箱内培养48 h后,用十字交叉法测定抑菌圈直径。抑菌效果以抑菌圈直径的大小为衡量标准,精油抑菌试验结果的判定标准[13]为:抑菌圈直径>20 mm为极度敏感、15~20 mm为高度敏感、10~15 mm为中度敏感、7~9 mm为低度敏感、<7 mm为不敏感。
1.2.6 最小抑菌浓度(MIC)及最小杀菌浓度(MBC)测定
MIC 测定[14]:将不同浓度的肉桂精油、肉桂醛、乙酸桂酯、邻甲氧基肉桂醛、苯甲醛的DMSO溶液,分别加入到熔化后的PDA培养基中,充分混匀后制成不同浓度的含药培养基。取7种真菌的菌液各100 μL,在含药培养基上涂布均匀,同时以山梨酸钾为阳性对照,DMSO 为阴性对照,每个处理3 个平行,置于恒温培养箱中28 ℃培养48 h,观察并统计试验结果,无明显生长菌落的含药培养基浓度即为待测样品的MIC。
MBC测定:对MIC测定试验中的所有无明显菌落生长的平皿进行MBC的测定试验。用少量无菌水在平皿上冲洗后,取冲洗后的菌液在不含药的PDA培养基上涂布平板,在恒温培养箱中培养48 h 后,观察培养基表面有无菌落生长,无菌落生长则代表该培养基浓度为其MBC。
1.3 数据统计分析
用Microsoft Excel 进行简单的数据录入及处理,采用SPSS 22.0软件对数据进行单因素方差分析,试验数据用“平均值±标准差”表示,处理间采用LSD法进行多重比较,统计检验的显著水平以P<0.05为基准。
2 结果与分析
2.1 肉桂精油组分分析(见表3)
以面积归一化法测得肉桂精油的各组分的相对百分含量,结果如表3 所示,在已鉴定出的肉桂精油组分中,烯类化合物最多,有15 种,醛类化合物9 种,醇类化合物6 种,酮类化合物2 种。在肉桂精油的所有组分中肉桂醛的相对百分含量最多,其相对百分含量为62.72%,乙酸桂酯其次,相对百分含量为11.54%,其余组分相对百分含量大于0.5%的组分有邻甲氧基肉桂醛(7.33%)、苯甲醛(2.67%)、反油酸(1.76%)、苯丙醛(1.48%)、反式肉桂醛(1.18%)、立方烯(0.93%)、苯乙醇(0.92%)、间羟基苯甲醛(0.86%)、石竹烯(0.55%)、α-衣兰油烯(0.54%)。
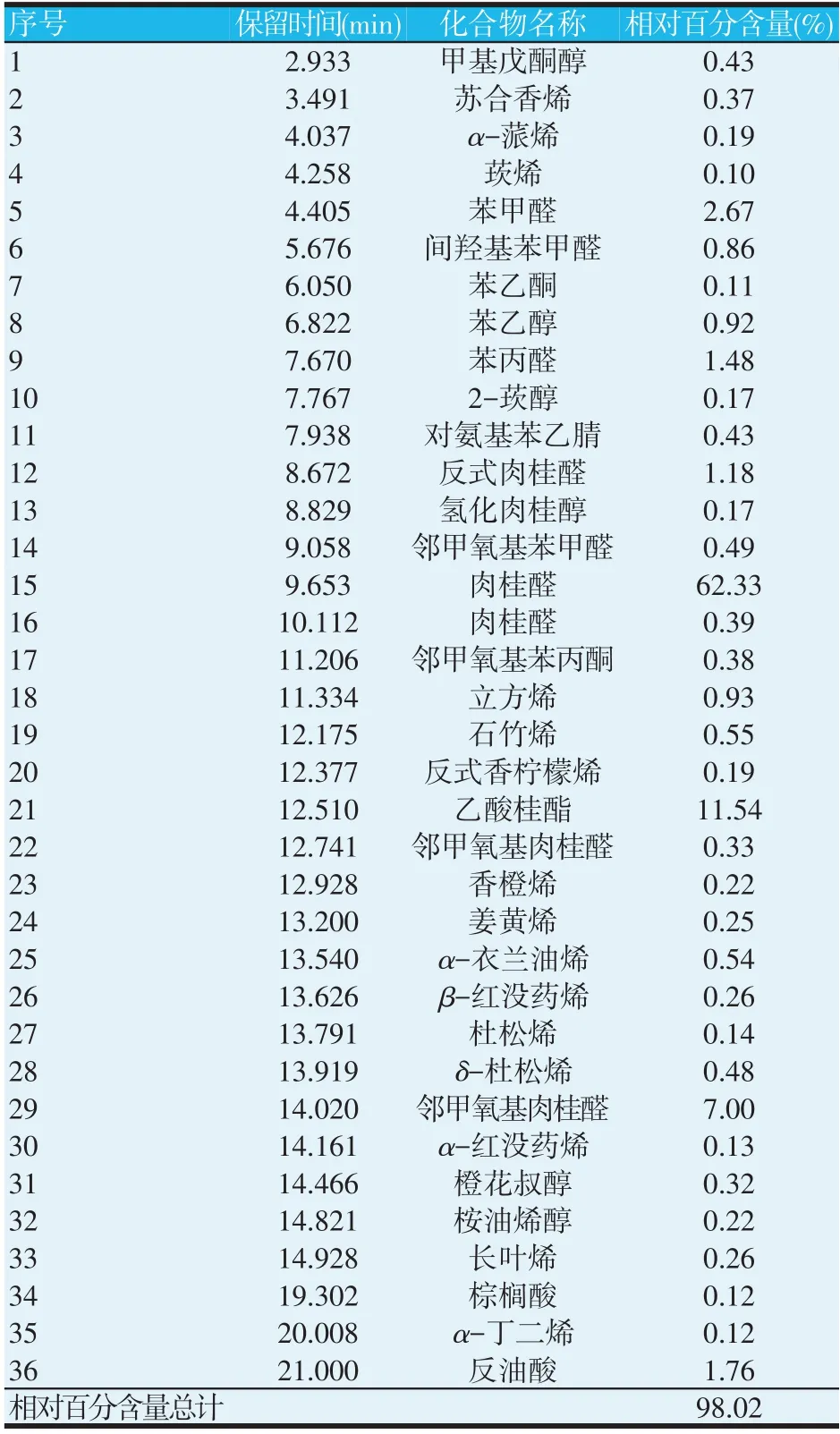
表3 肉桂精油化学组分
2.2 饲料真菌的分离率(见图1)
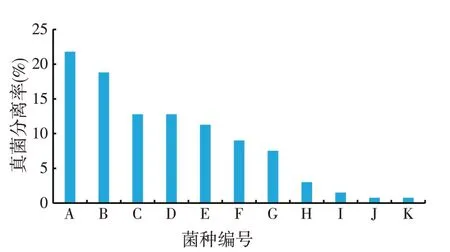
图1 饲料中真菌的分离率
从饲料中分离得到133株具有典型特征的菌株,据其形态特征划分为11类,按分离率(见图1)由高到低进行排序,用A~K表示,其中分离率较高的有7种,A 菌29 株分离率为21.80%,B 菌25 株为18.79%,C、D菌17株为12.78%,E菌15株11.28%,F菌12株9.02%,G 菌10 株7.51%,该7 种菌占总菌株数的93.96%。H~K菌分离率不足5%,不进行后续研究。
2.3 饲料真菌菌落形态学鉴定(见图2)
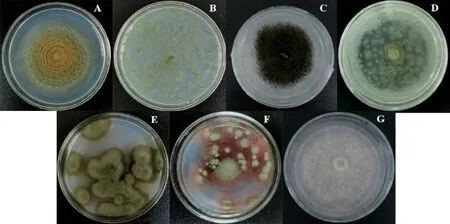
图2 A~G菌菌落形态特征
将饲料中分离率较高的7 种真菌(A、B、C、D、E、F、G)进行分离纯化,对其形态学特征进行初步鉴定。菌株A在PDA培养基上生长快速,呈赭黄色近于蜜黄色、质地丝绒状、中央部分隆起、具同心环纹,在培养基上着生根部伴有透明菌丝(图2A),根据形态学分类,可初步将该菌株鉴定为曲霉菌属菌种。B菌在PDA 培养基上为分散的灰黄色菌落、质地丝绒状,菌落在培养基上丛生、中间凸、边缘低(图2B),根据其菌落颜色及形态等特征,可初步鉴定为黄曲霉。C菌在PDA 培养基上生长迅速,菌体初为白色、后变成黑色、厚绒状,呈放射性生长(图2C),根据其形态特征,可以初步鉴定为黑曲霉(Aspergillus niger)。D 菌在PDA培养基上呈暗烟绿色,菌落生长迅速,3 d左右成熟,老后菌体颜色变得更深、菌落分散、质地绒状或絮状(图2D),根据其生长形态特征,初步鉴定为曲霉属菌。E菌在PDA培养基上呈深绿色厚毛绒状、菌落分散、菌落边缘在培养基上匍匐生长(图2E),边缘菌丝呈白色,菌体生长伴有色素产生,使培养基改变颜色,与枝孢菌形态相似。F菌在PDA培养基上呈绿色、表面粗糙、菌落质地丝绒状,中间凸起且菌落底部琼脂呈红色、边界呈规则圆状、菌落直径为1~2 cm,在PDA上着生密集(图2F),初步鉴定其为篮状菌。G菌在PDA培养基上为气生菌丝,最初为粉白色,后变为粉紫色,菌落绒毛状(图2G),初步鉴定为镰刀菌属。
2.4 饲料真菌的分子生物学鉴定(见图3、图4)
菌株A、B、C、D、E、F、G经提取其DNA,以通用引物ITS1和ITS4对rDNA进行PCR扩增,经琼脂糖凝胶电泳测得其片段大小范围在500~750 bp,如图3所示。
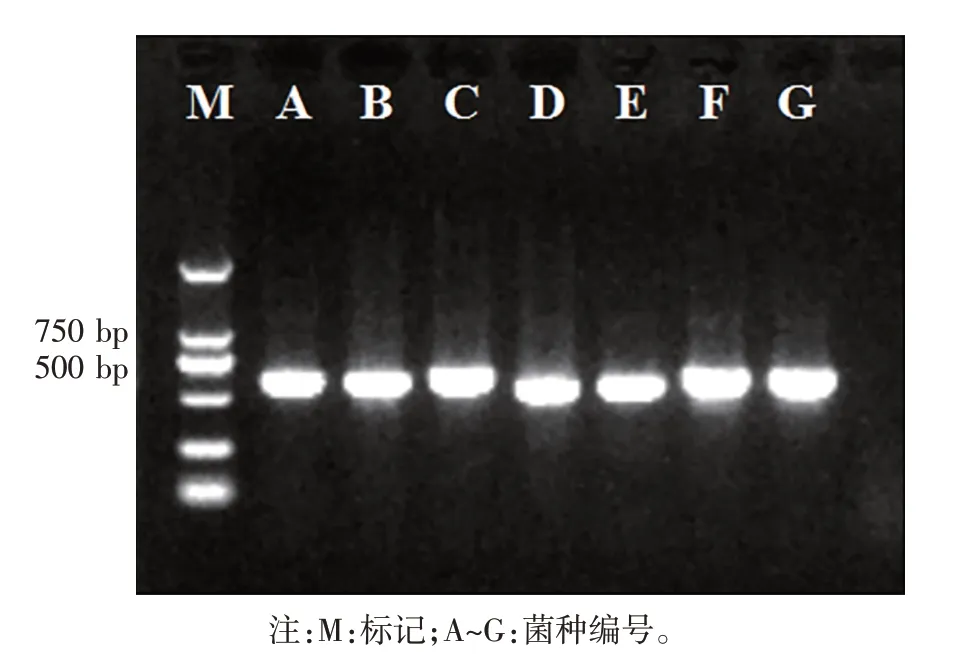
图3 A~G菌的rDNA-ITS片段PCR扩增图谱
将测得的A~G 菌的ITS 序列登录GenBank 进行BLAST 序列比对,并在MEGA 6.0 软件中基于rDNAITS区序列利用NJ法进行同源性分析,生成系统发育树(图4),结果显示:A菌与孔曲霉(A. Ostianus)的ITS序列同源性为100%,亲缘关系最近,结合形态学观察结果,确定菌种为孔曲霉;B菌与黄曲霉(A. Flavus)的ITS序列同源性为100%,亲缘关系最近,结合形态学观察结果,确定菌种为黄曲霉;C 菌与黑曲霉(A. Niger)ITS序列同源性为100%,亲缘关系最近,结合形态学观察结果,确定菌种为黑曲霉;D 菌与烟曲霉菌(A. Fumigatus)ITS序列同源性为100%,亲缘关系最近,结合形态学观察结果,确定菌种为烟曲霉。E菌与枝状枝孢菌(Cladosporium cladosporioides)ITS 序列同源性为100%,亲缘关系最近,结合E菌的形态学观察结果,确定菌种为枝状枝孢菌;F菌与艾米斯托克篮状菌(Talaromyces amestolkiae)ITS序列同源性为100%,亲缘关系最近,结合其形态学观察结果,确定菌种为艾米斯托克篮状菌;G菌与轮状镰刀菌(Fusarium verticillioides)ITS序列同源性为100%,亲缘关系最近,结合其形态学观察结果,确定菌种为轮状镰刀菌。
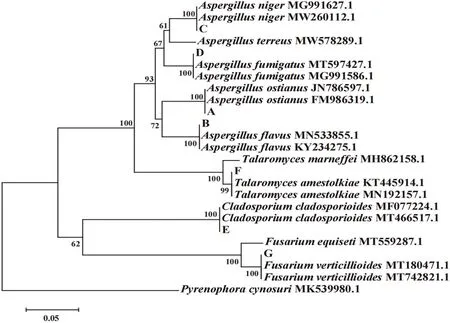
图4 基于rDNA-ITS区序列构建的NJ系统发育树
2.5 肉桂精油及其主要组分抑菌圈直径(见图5)
由图5可知,肉桂精油及其主要组分均对这7种真菌具有不同程度的抑制作用。真菌的两种阳性对照双乙酸钠和山梨酸钾是饲料中常见的防霉剂,双乙酸钠对部分真菌有抑制效果(黑曲霉、枝状枝孢菌、艾米斯托克篮状菌),山梨酸钾对所有菌种皆有抑制效果,但由于菌种的复杂多样,抑制效果也大有不同,山梨酸钾对孔曲霉、黄曲霉、黑曲霉的抑菌圈直径范围较小(7~9 mm),属于低度敏感等级,对枝状枝孢菌极度敏感,其抑菌圈直径为(21.50±2.92)mm,对烟曲霉和艾米斯托克篮状菌中度敏感。肉桂精油及其组分的抑菌圈直径全部显著优于山梨酸钾(P<0.05),抑菌效果强于防霉剂。
在所有参试样品中,肉桂精油、肉桂醛和邻甲氧基肉桂醛的抑菌效果较好,对所有供试菌种的抑菌圈直径都在20 mm以上,属极度敏感,肉桂醛抑制效果最好,抑菌圈直径均在50 mm以上,且强于肉桂精油。肉桂精油、肉桂醛和邻甲氧基肉桂醛对孔曲霉、黄曲霉、黑曲霉、烟曲霉、枝状枝孢菌的抑菌效果均有显著差异(P<0.05),而肉桂精油与肉桂醛对艾米斯托克篮状菌和轮状镰刀菌的抑菌直径差异不显著(P>0.05)。
乙酸桂酯对烟曲霉和艾米斯托克蓝状菌的抑制效果较好,为极度敏感,对黑曲霉和枝状枝孢菌为高度敏感,对孔曲霉、黄曲霉和轮状镰刀菌为中度敏感。苯甲醛对孔曲霉和烟曲霉抑制效果较好,为极度敏感,对其余菌种皆为高度敏感。除黄曲霉和烟曲霉外,苯甲醛与乙酸桂酯的抑菌效果均不显著(P>0.05),可见,苯甲醛与乙酸桂酯的抑菌活性并无太大差异。肉桂精油及其组分的抑菌活性均显著优于对照饲料防霉剂,其组分抑菌活性总趋势为:肉桂醛>肉桂精油>邻甲氧基肉桂醛>乙酸桂酯>苯甲醛。
2.6 肉桂精油及其主要组分MIC、MBC(见图6)
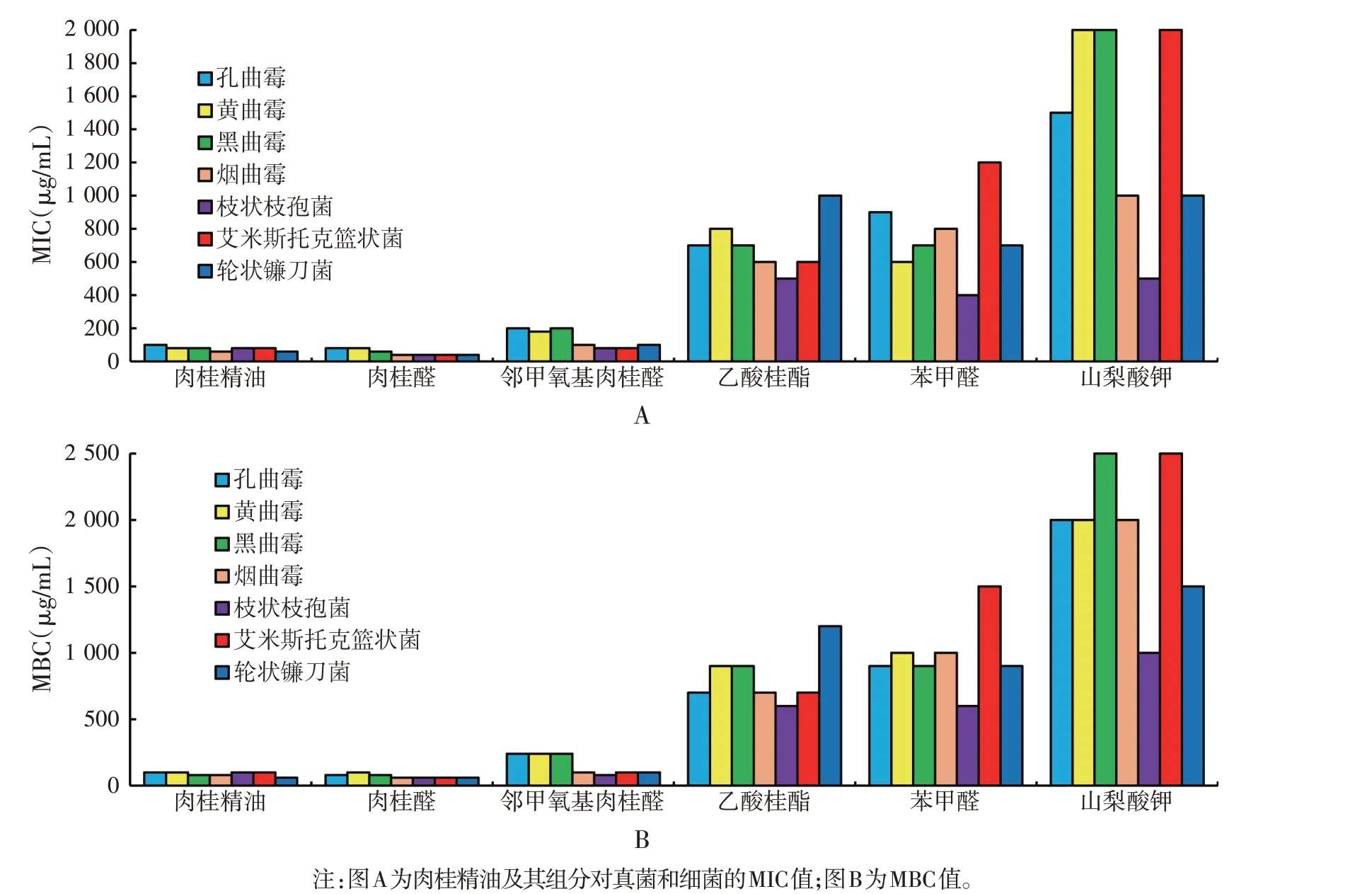
图6 肉桂精油及其组分对真菌和细菌的MIC及MBC
由图6 可知,肉桂精油及其组分对这7 种真菌均有不同程度的杀菌效果,其中肉桂醛拥有最强抑菌效果,其MIC范围是40~80 μg/mL,MBC范围为60~100 μg/mL,肉桂精油的MIC、MBC 范围均为60~100 μg/mL,当肉桂精油和肉桂醛浓度在100 μg/mL时,真菌不再生长。邻甲氧基肉桂醛的MIC 范围为80~200 μg/mL,MBC范围为80~240 μg/mL,对烟曲霉、枝状枝孢菌、艾米斯托克篮状菌、轮状镰刀菌表现出了强抑菌效果。乙酸桂酯对所有参试真菌的MIC值在500~1 000 μg/mL之间,MBC范围为600~1 200 μg/mL,苯甲醛对除艾米斯托克篮状菌外的参试真菌MBC都小于1 000 μg/mL。
3 讨论
饲料常常受真菌的影响而腐败变质,在饲料储藏过程中的霉菌污染以青霉属、曲霉属、根霉属和镰刀霉属为主[15],如饲料中多种霉菌毒素,如黄曲霉毒素、呕吐毒素、玉米赤霉烯酮、烟曲霉毒素、赭曲霉毒素、念珠镰孢霉和增生镰孢霉毒素等[16-19]。本试验通过对饲料中的霉菌进行分离纯化,结合形态学鉴定和PCR分子检测技术,对其中7种分离率较高的真菌进行鉴定,其中有4种曲霉属菌,枝孢菌、篮状菌、镰刀菌各1种。为了使肉桂精油及其组分能更有效应用于饲料中,本试验选择肉桂精油、肉桂醛、邻甲氧基肉桂醛、乙酸桂酯和苯甲醛为研究对象,对饲料分离得到的7种真菌(孔曲霉、黄曲霉、黑曲霉、烟曲霉、枝状枝孢菌、艾米斯托克篮状菌、轮状镰刀菌)进行抑菌活性测定。
肉桂醛是肉桂精油中含量最多的组分,在许多研究中都表现了良好的抑菌活性。邬本成等[20]研究表明肉桂精油中的肉桂醛可有效抑制饲料中青霉和黑曲霉菌的生长;魏娟[21]研究表明肉桂醛可显著抑制接骨木镰刀菌(Fusarium sambucinum)的孢子萌发及菌落生长(P<0.05),MIC 为3 mmol/L;Yin 等[22]研究表明肉桂醛可通过破坏细胞膜与影响蛋白质代谢的方式来抑制嗜水气单胞菌(Aeromonas hydrophila)的生长;谢小梅等[23]研究表明,肉桂醛具有良好的抗曲霉菌活性,对黄曲霉、烟曲霉的MIC分别为0.10、0.05 μg/mL。但是目前国内外学者对肉桂精油的其他组分研究较少,认为精油的抑菌活性不是单一组分所能达到的,而可能是多种组分相互作用的结果[24]。李秀竹等[25]探究了反式肉桂酸、反式邻甲氧基肉桂醛、反式肉桂醛对胶孢炭疽菌的抑菌活性,结果表明这3种物质均可在一定程度上延缓病菌孢子的萌发;牛彪等[26]发现肉桂精油对5种常见致病菌均表现出很强的抑制效果,主要的抗菌组分为肉桂醛、2'-甲氧基肉桂醛、香豆素、乙酸桂酯、苯丙醛、苯甲醛。在本试验中,肉桂精油及其组分对各种真菌均有较强的抑菌活性,被抑制的真菌中既有曲霉属菌,也有镰刀菌、篮状菌和枝孢菌,可以推断肉桂精油及其组分对饲料真菌均具有广谱抑菌活性。其中,肉桂醛表现出了强于肉桂精油的抑菌效果,其真菌抑菌圈直径均在50 mm 以上,等级划分属极度敏感,可见肉桂醛确为肉桂精油的主要抑菌活性组分。除肉桂醛外,其他组分也表现出了一定的抑菌活性,邻甲氧基肉桂醛对烟曲霉、枝状枝孢菌、艾米斯托克篮状菌、轮状镰刀菌表现出了强抑菌效果,与肉桂精油、肉桂醛的抑菌效果差异不显著,且由于邻甲氧基肉桂醛为固体形态,因此在参试过程中其浓度与对照山梨酸钾、双乙酸钠一致(250 mg/mL),由此可以认为邻甲氧基肉桂醛亦为肉桂精油的主要活性组分,而苯甲醛与乙酸桂酯对真菌的抑菌活性均较弱。
肉桂精油及其组分的抑菌活性均显著优于对照饲料防霉剂双乙酸钠和山梨酸钾,可见肉桂精油及其组分均可进一步开发为饲料防霉剂使用,其抑菌活性总趋势为:肉桂醛>肉桂精油>邻甲氧基肉桂醛>乙酸桂酯>苯甲醛。从本试验的抑菌结果可以看出:肉桂精油中抑菌活性组分不仅只有肉桂醛,邻甲氧基肉桂醛、乙酸桂酯、苯甲醛均表现出了一定程度的抑菌活性,可见,肉桂精油的抑菌活性是肉桂醛与多种抑菌活性组分共同作用的结果。
4 结论
从饲料中分离鉴定分离率较高的7 种常见真菌(A~G)分别为:孔曲霉、黄曲霉、黑曲霉、烟曲霉、枝状枝孢菌、艾米斯托克篮状菌、轮状镰刀菌。
肉桂精油及其组分对饲料中常见真菌均具有广谱抑菌活性,其抑菌活性:肉桂醛>肉桂精油>邻甲氧基肉桂醛>乙酸桂酯>苯甲醛,其中肉桂醛、邻甲氧基肉桂醛的抑菌效果最好。

