MAP3K3基因过表达通过多条信号通路激活CREB促进人肺腺癌细胞增殖及上皮-间质转化*
郭振辉, 茆文莉, 陈文雅, 梁娇, 侯聪艳, 张韧, 何彦丽
广州中医药大学基础医学院(广东广州 510006)
有丝分裂原活化蛋白激酶激酶激酶3(MAP3K3)又称MEKK3,其编码的丝裂原活化蛋白激酶激酶激酶3属于蛋白激酶超家族、MAP3K亚家族,在不同物种间相似性较高。近年来MAP3K3与肿瘤的关系越来越被人们所关注,有文献报道称MAP3K3 参与调节多个信号通路,与肿瘤的增殖、分化、细胞存活和耐药相关[1-3]。前期研究中,通过生物信息学分析及101例肺腺癌临床样本的免疫组织化学检测,我们发现体内MAP3K3表达与肺腺癌患者预后密切相关[4],体内实验中MAP3K3基因与肺癌预后发展关系正负相关均有报道,预后的差异是否仅由于MAP3K3表达变化所引起尚有争议。体外实验可以控制单一因素从而研究基因的功能,为此,我们在前期研究基础上,于2019年6月至2020年12月期间,通过对人源肺腺癌H1299、A549细胞株干预MAP3K3基因表达,检测了其对细胞增殖、迁移、侵袭及EMT表型分子的影响,同时初步探讨了其调控的下游信号通路网络,期待此研究能为开发肺腺癌靶向治疗药物提供部分实验依据。
1 材料与方法
1.1 细胞株 A549、H1299细胞购自中国科学院上海细胞库。本研究经广州中医药大学动物实验伦理审查通过。
1.2 主要试剂 MAP3K3过表达慢病毒购自上海吉凯生物技术有限公司;shRNA GLPZ MAP3K3 慢病毒包装颗粒(Lentiviral shRNA Viral Particle Starter Kit, viral particle set)购自Thermo Scientific Dharmacon公司; RPMI1640培养基(批号:8118107)、0.25%Trypsin-EDTA(批号:1939066)、FBS胎牛血清(批号:1795588)购自美国Gibco公司;Western blot单克隆抗体:钙黏蛋白E(E-cadherin)、钙黏蛋白N(N-cadherin)、波形蛋白(Vimentin)、MAP3K3、AKT、mTOR、ERK1/2、JNK1/2、CREB及相关的磷酸化抗体,均购自美国Cell Signaling Technology 公司;HRP羊抗兔IgG二抗(AS014)购自中国ABclonal公司;BCA法蛋白定量试剂盒(FD2001)和RIPA蛋白裂解液(FD008)购自杭州弗德生物科技有限公司。
1.3 方法
1.3.1 MAP3K3过表达及shRNA敲低稳转株构建 在病毒感染前1 d对处于对数生长期的细胞进行计数,按每孔3 000个细胞接种至96孔板,按1、5、10、50、100 MOI梯度加入病毒,感染6 h后去除含病毒培养基,换用含10%FBS培养基,培养72 h并观察荧光,选取荧光强度最大且细胞存活较多的MOI梯度作为最佳转染浓度;于12孔板中接种每孔1×104个细胞,培养至细胞贴壁后换用无血清培养基,加入病毒溶液至最佳浓度,感染6 h后去除含病毒培养基,换用含10%FBS培养基继续培养72 h;感染过程定时观察细胞形态,观察到荧光时开始用嘌呤霉素对转染细胞进行筛选,每2 d换液,持续14 d,细胞生长稳定后通过Western blot实验检测过表达是否成功,设置分组为未转染组(Ctrl组)、过表达MAP3K3转染组(OE组);在shRNA转染前1 d对处于对数生长期的细胞进行计数,在12孔板中接种每孔3×104个细胞,待细胞贴壁后换用无血清培养基,加入配制好的含shRNA转染体系,37℃培养24 h后换用含10%FBS培养基继续培养24 h得到MAP3K3基因敲低细胞株。
1.3.2 克隆形成实验 在六孔板中接种每孔1 000个对数生长期细胞,加入含10%FBS培养基,每2 d换液,持续10 d,肉眼观察见细胞集落形成后吸去培养基,用PBS洗涤后每孔加入1 mL的4%多聚甲醛溶液固定20 min后吸去,加入1%结晶紫染色20 min后吸去结晶紫,晾干后拍照并统计细胞集落数量。
1.3.3 划痕实验 在6孔板中接种每孔3×105个对数生长期细胞,待细胞贴壁且长满6孔板时,用200 μL吸头划直线痕,每孔横竖各划3条,用PBS轻洗3次去除漂浮细胞,加入无血清培养基,每孔随机选取5个视野并标记,分别在0 h和24 h用显微镜拍照记录。
1.3.4 Transwell实验 细胞培养至对数生长期,换用无血清培养基饥饿培养24 h,用0.25% Trypsin-EDTA消化并收集细胞,用无血清培养基重悬细胞,调整细胞悬液浓度为1×106个/mL,将含基质胶的transwell小室置于24孔板中,下室加入600 μL含15%FBS培养基,上室加入200 μL细胞悬液,37℃培养24 h;取出transwell小室吸去孔板中的培养基,用棉签小心擦去上室上部的细胞,使用PBS轻洗3次,在下室加入600 μL的4%多聚甲醛溶液后将transwell小室放回浸泡固定20 min;吸去4%多聚甲醛溶液后加入1%结晶紫染色液染色20 min,置通风处晾干;在倒置显微镜下随机选取5个视野拍照记录,并使用ImageJ V1.8.0软件进行细胞计数。
1.3.5 Western blot实验 根据文献报道,EMT与AKT/mTOR信号通路密切相关[5]。环磷腺苷效应元件结合蛋白(cAMP-response element binding protein, CREB)与细胞的增殖、分化、凋亡等密切相关,而且能被AKT、ERK激活[6-9]。使用Western blot实验检测MAP3K3对AKT/mTOR信号通路的影响。将经过处理的细胞用胰酶消化并制成细胞悬液,离心吸去上清液后加入含磷酸酶抑制剂和蛋白酶抑制剂的RIPA裂解液,4℃裂解30 min后收集于1.5 mL离心管,4℃ 12 000转离心10 min后取上清液,使用BCA蛋白定量试剂盒进行定量。每个泳道上样20 μg蛋白,10% SDS-PAGE凝胶电泳(120 V,90 min)分离,转印(300 mA,90 min)到 PVDF膜上,5% BSA溶液室温封闭2 h,分别加入对应第一抗体,4℃孵育过夜,TBST洗涤3次,每次5 min;HRP标记的二抗孵育2 h,TBST洗涤3次,每次5 min;ECL化学发光法显影,全自动化学发光图像分析系统采集拍照。以GAPDH为内参对照,每组实验独立重复3次。
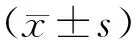
2 结果
2.1 慢病毒转染构建MAP3K3过表达人肺腺癌细胞株 使用Western blot实验检测过表达转染MAP3K3基因的人肺腺癌细胞,结果见图1,过表达MAP3K3基因后,MAP3K3蛋白表达量显著上升,说明成功过表达转染。

图1 Western blot检测过表达MAP3K3基因结果
2.2 过表达MAP3K3对人肺腺癌细胞增殖能力的影响 使用平板克隆实验检测过表达MAP3K3基因后人肺腺癌细胞的增殖能力变化,见图2。与Ctrl组相比,过表达转染MAP3K3基因后,肺腺癌细胞形成克隆面积显著增大,细胞集落数量显著增多,表明细胞增殖活性更强,过表达MAP3K3基因可促进人肺腺癌细胞的增殖。

图2 过表达MAP3K3基因对人肺腺癌细胞增殖的影响(1%结晶紫染色)
2.3 过表达MAP3K3对人肺腺癌细胞迁移及侵袭能力的影响 划痕实验结果表明,与Ctrl组相比,过表达MAP3K3基因细胞的划痕愈合率显著上升且组间差异有统计学意义(P<0.05)。Transwell实验结果表明,与Ctrl组相比,过表达MAP3K3基因后细胞穿膜数量增多且组间差异有统计学意义(P<0.05)。见图3、表1~2。
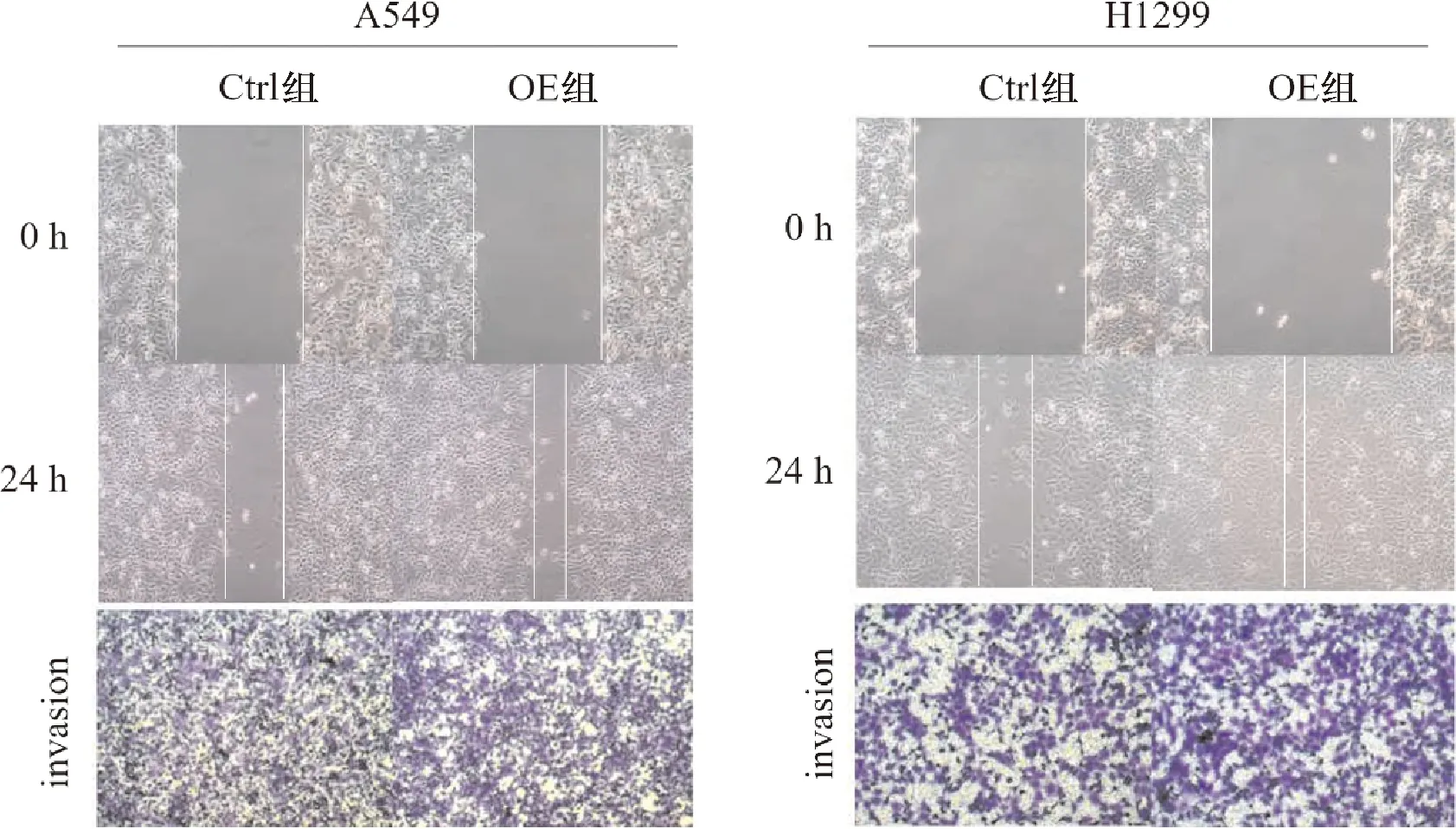
图3 过表达MAP3K3基因对人肺腺癌细胞迁移及侵袭能力的影响(×100,1%结晶紫染色)

表1 两组划痕愈合面积百分比的比较

表2 两组侵袭细胞数量百分比的比较
2.4 过表达MAP3K3对肿瘤细胞转移侵袭相关蛋白的影响 Western blot实验结果显示,与Ctrl组相比,过表达MAP3K3基因的A549和H1299细胞上皮表型标志物E-Cadherin蛋白表达显著下调,间质表型标志物N-Cadherin和Vimentin蛋白表达上调(图4、表3),说明过表达MAP3K3基因能促进人肺腺癌细胞的EMT。
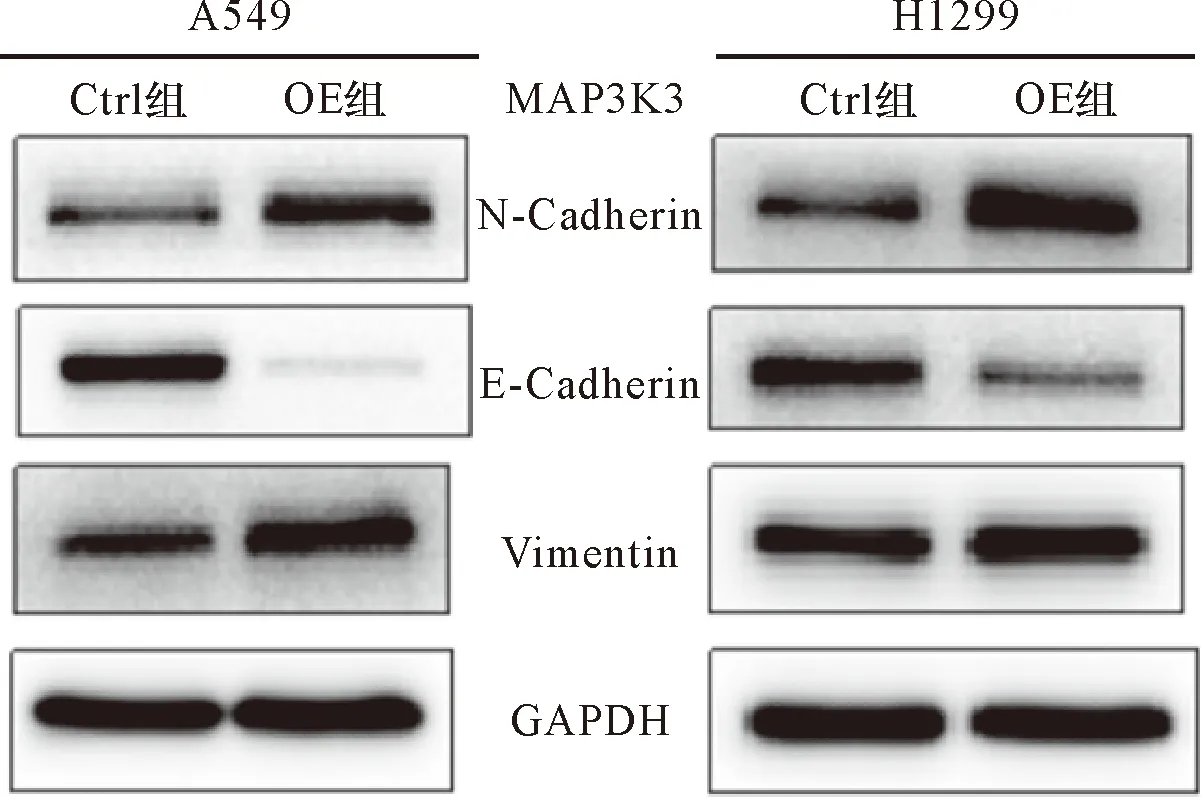
图4 Western blot检测过表达MAP3K3基因后对人肺腺癌细胞EMT相关蛋白影响

表3 用Ctrl校正的EMT相关蛋白相对定量结果
2.5 过表达MAP3K3对多个信号通路的影响 过表达MAP3K3基因后人肺腺癌细胞的磷酸化AKT和磷酸化mTOR表达上调,未磷酸化蛋白表达无显著差异。对ERK(p-ERK)和JNK(p-JNK)蛋白表达水平进行检测,结果显示了与AKT(p-AKT)和mTOR(p-mTOR)相同的变化趋势(图5、表4)。

图5 Western blot检测过表达MAP3K3基因对相关信号通路蛋白的影响

表4 用Ctrl校正的相关信号通路蛋白相对定量结果
2.6 过表达与敲低MAP3K3对CREB的影响 对H1299细胞敲低MAP3K3基因,Western blot实验结果显示3组shRNA中shRNA-1699敲低成功,同时p-CREB的蛋白水平显著下调(图6-A);对H1299细胞过表达MAP3K3基因,Western blot实验结果显示p-CREB的蛋白表达水平上调(图6-B);结果灰度分析见表5。

注:A:敲低MAP3K3基因;B:过表达MAP3K3基因

表5 用NTC或Ctrl校正的p-CREB蛋白相对定量结果
3 讨论
肺腺癌患者约占所有肺癌患者数量的40%~50%,由于肿瘤细胞的转移形成继发性肿瘤,患者病情短时间内恶化,是治疗肺腺癌需要面临的主要问题[10]。EMT是上皮细胞失去紧密连接,脱离基底膜向流动性强的间充质细胞转变的过程,与肿瘤远端转移密切相关,因此靶向EMT过程是治疗肿瘤的一个重要方法[11]。
MAP3K3作为MAPK家族重要的一个蛋白激酶,是蛋白激酶信号转导级联的组成部分,涉及细胞各种功能,近年来MAP3K3信号通路与肿瘤的关系日益受到关注。MAP3K3处于信号级联反应的上游端,对许多磷酸化相关蛋白及其信号通路具有调控作用,影响肿瘤细胞增殖、分化和存活,其中ERK信号通路最为典型。MAP3K3可将ERK1/2信号通路中的MEK磷酸化,磷酸化的MEK将ERK磷酸化而激活其核转录因子活性[12]。MAP3K3亦可以通过与MEK5结合形成活化的二聚体激活ERK5,从而调控细胞生长发育过程[13]。近来文献报道MAP3K3与肿瘤药物耐受、患者预后间也存有一定关系,Samanta 等[14]发现约63%卵巢癌细胞过表达MAP3K3,且伴有较高的IκB激酶β(IKKβ激酶)和核转录因子-κB(NF-kB)活性,采用siRNA使该基因表达沉默后,可增加肿瘤细胞对化疗药物(紫杉醇)的敏感度。Hasan等[15]报道MAP3K3(MEKK3)基因过表达是食管癌发生的早期事件,与患者不良预后有关。Fan等[3]研究报道,8%~20%的乳腺癌检测有MAP3K3基因扩增,将存有MAP3K3基因扩增的乳腺癌MCF-7和MDA-MB-361细胞株 MAP3K3基因沉默后,可增加乳腺癌细胞对TNF和TRAIL因子以及阿霉素、VP-16等化疗药物诱导的凋亡敏感度, 且可有效抑制乳腺癌细胞增生和克隆形成。
CREB是调节细胞增殖和存活非常重要的转录因子之一,在人类的多种肿瘤中过度表达,如脑胶质瘤[16]和非小细胞肺癌[17]。它可以被许多激酶(包括 AKT和ERK)磷酸化而激活[6-9],CREB除了可影响癌细胞的增殖外,还参与调节EMT相关蛋白E-cadherin、N-cadherin和Fibronectin[18]的表达,有研究发现电离辐射可通过激活EGFR-p38/ERK-CREB-1/STAT3-EMT 途径诱导癌细胞迁移侵袭[7]。
MAP3K3基因与肺腺癌侵袭、转移的关系尚不明确,是否参与肺腺癌细胞EMT转化亦鲜见报道。我们通过前期研究发现临床肺腺癌组织中MAP3K3表达水平与间质淋巴细胞浸润程度相关,故猜测可影响机体免疫功能,而在体外敲除MAP3K3可降低肿瘤细胞的增殖能力[4]。本研究使用慢病毒感染人肺腺癌细胞H1299和A549,在体外构建MAP3K3稳定过表达细胞株。通过克隆形成实验、划痕实验、Transwell实验以及EMT相关蛋白的检测,我们发现过表达MAP3K3基因可增强人肺腺癌细胞增殖能力,并促进迁移、侵袭及EMT。为进一步探明其作用机制,我们检测了过表达MAP3K3基因的人肺腺癌细胞中多个具有功能活性的磷酸化信号分子:p-AKT、p-mTOR、p-ERK1/2和p-JNK1/2,发现表达均有上调,已有文献报道AKT/mTOR[5]、ERK1/2[19]以及JNK[20]信号通路激活与EMT关系密切,因此,我们推测MAP3K3可通过调节这些关键分子,参与人肺腺癌细胞的增殖、迁移及EMT过程;我们在实验中进一步发现过表达MAP3K3基因的人肺腺癌细胞中,具有功能活性的p-CREB蛋白表达水平表达上调,而敲低MAP3K3基因使得p-CREB蛋白表达水平显著下调,说明MAP3K3基因可能通过调控多个信号通路分子的磷酸化水平,调控核转录因子CREB的磷酸化水平,从而调节其功能。
综上所述,我们推测MAP3K3通过AKT/mTOR-ERK1/2-JNK/CREB信号通路网络,参与肺腺癌细胞增殖、迁移及EMT过程。该实验结果希望为基于MAP3K3信号通路开发新型靶向治疗肺腺癌的药物提供实验参考。
利益相关声明:所有作者声明没有利益冲突。
作者贡献说明:何彦丽和张韧设计了实验研究,茆文莉和郭振辉完成了实验操作,陈文雅收集并整理了数据,梁娇和侯聪艳作数据分析,郭振辉和茆文莉共同完成了论文写作,所有作者阅读审核了论文并同意投稿。

