NGF、IGF1在烧伤后增生性瘢痕组织中的表达及意义*
梁赞姜, 徐洋, 金洪娟, 黄溶溶, 向成
1温州和平整形医院整形美容外科(浙江温州 325000); 2厦门大学附属第一医院思明院区医疗美容科(福建厦门 361000); 3吉林大学第一医院整形外科(吉林长春 137000)
烧伤患者创面愈合后会形成增生性瘢痕,是一种皮肤纤维化疾病,主要表现为表面隆起呈红色、缺乏弹性、局部增厚或痒痛等[1]。增生性瘢痕患者细胞外基质如胶原纤维等过度生成、沉积,胶原排列紊乱,最终导致真皮纤维化,不仅影响美观,还可能引起肢体、器官功能受限,危害患者身心健康,导致患者生活质量下降[2-3]。临床上如何有效预防及治疗瘢痕,已成为目前国内外学者的研究热点之一。胰岛素样生长因子1(insulin-like growth factor 1,IGF1)能够促进瘢痕形成,其在创面愈合过程中参与调节成纤维细胞的生长、代谢,可诱导成纤维细胞增殖、刺激结缔组织再生,可能在伤口愈合最后阶段发挥作用[4]。神经生长因子(nerve growth factor,NGF)被认为是一种多效性分子,在不同病理生理条件下发挥多种生物学作用,研究发现,其在伤口愈合过程中可诱导血管内皮细胞、成纤维细胞及趋化免疫细胞向伤口移动,促进创面修复[5]。本研究通过实时荧光定量PCR(real-time quantitative PCR,qRT-PCR)及放射免疫法检测瘢痕组织中NGF、IGF1 mRNA及蛋白水平,探究NGF及IGF1在烧伤后增生性瘢痕组织中的表达情况及临床意义,旨在为寻找新的临床治疗靶点提供帮助。
1 资料与方法
1.1 一般资料 选取温州和平整形医院、厦门大学附属第一医院思明院区及吉林大学第一医院2017年3月至2021年5月期间收治的增生性瘢痕患者114例为研究对象,所有患者均行手术治疗。其中男59例,女55例,年龄15~53岁,平均(36.40±10.60)岁,颈面部29例,上肢34例,下肢9例,躯干42例。
纳入标准:(1)表现为瘢痕隆起,红色,伴有瘙痒、疼痛;(2)药物治疗或物理疗法12个月无效者;(3)术前未经药物、放射、激光等治疗;(4)患者均知情同意。
排除标准:(1)合并恶变者;(2)合并瘢痕疙瘩;(3)合并其他皮损者;(4)妊娠或哺乳期女性。本研究经医院伦理委员会审批通过(批准号:2017007)。
1.2 方法
1.2.1 样本采集 术中留取患者增生性瘢痕组织作为瘢痕组,留取邻近正常皮肤组织作为对照组,新鲜的组织标本经DEPC水处理后,置于无菌EP管中,液氮中速冻,并于-80℃保存。
1.2.2 qRT-PCR法检测组织中NGF、IGF1 mRNA及相关炎性因子水平 取组织样本,研磨为组织匀浆,采用TRIzol试剂提取组织总RNA,逆转录试剂盒(货号:4897030001,瑞士罗氏公司)将所得RNA逆转录为cDNA,并以cDNA为模板配置qRT-PCR反应体系(20 μL)。在Quant Studio5荧光定量PCR仪(货号:V514732,美国赛默飞世尔科技公司)上进行反应,NGF、IGF1 mRNA及炎性因子单核细胞趋化蛋白-1(monocyte chemoattractant protein-1,MCP-1)、白细胞介素(interleukin,IL)-1β、IL-6及IL-8 mRNA相对表达量采用2-△△Ct法计算。NGF、IGF1、上述炎性因子及内参β-actin引物序列详见表1。
1.2.3 放射免疫法检测组织中NGF、IGF1蛋白水平 组织样本制备成为匀浆,调整pH值至3.0~4.0,加入重蒸馏乙酸乙酯提取上清,负压抽干。采用放射免疫法检测NGF、IGF1蛋白水平,试剂药盒均由中国医学科学院基础医学研究所药理室提供。将NGF、IGF1标准品分别制备成不同浓度梯度的标准液,采用顺序饱和加样法测定NGF、IGF1标准曲线。计算结合率(B/B0)×100%,并以结合率为纵坐标,不同浓度的对数值为横坐标,绘制标准曲线。在标准曲线上查找相应浓度,换算为NGF、IGF1在组织内的含量。
1.2.4 增生性瘢痕组织评价及瘢痕形成时间统计 采用温哥华瘢痕量表(Vancouver Scar Scale,VSS)分别从色泽、厚度、柔软度、血管分布等方面对患者瘢痕组织进行评价,总分15分,分数越高表示瘢痕越严重。
采用跨皮水分丢失(transepidermal water loss,TEWL)[6]评估增生性瘢痕的表皮屏障功能。在患者清醒安静状态下,于无阳光直射、不通风、24~26℃环境下测量TEWL值。测量瘢痕TEWL值,以瘢痕邻近正常皮肤为对照,计算增生性瘢痕TEWL净丧失量(瘢痕TEWL值与对照皮肤TEWL的差值)。增生性瘢痕表皮功能障碍程度以TEWL净丧失量来衡量。另统计患者瘢痕形成时间。
1.2.5 随访 对114例术后患者进行随访,共随访6个月,结束时间为2021年11月30日,统计患者复发情况,根据患者是否复发分为复发组(36例)和未复发组(78例)。

2 结果
2.1 增生性瘢痕组织与正常皮肤组织HE染色比较 HE染色结果显示,增生性瘢痕组织胶原纤维排列紊乱,存在大量成纤维细胞;正常皮肤组织胶原纤维排列疏松,存在少量成纤维细胞。见图1。
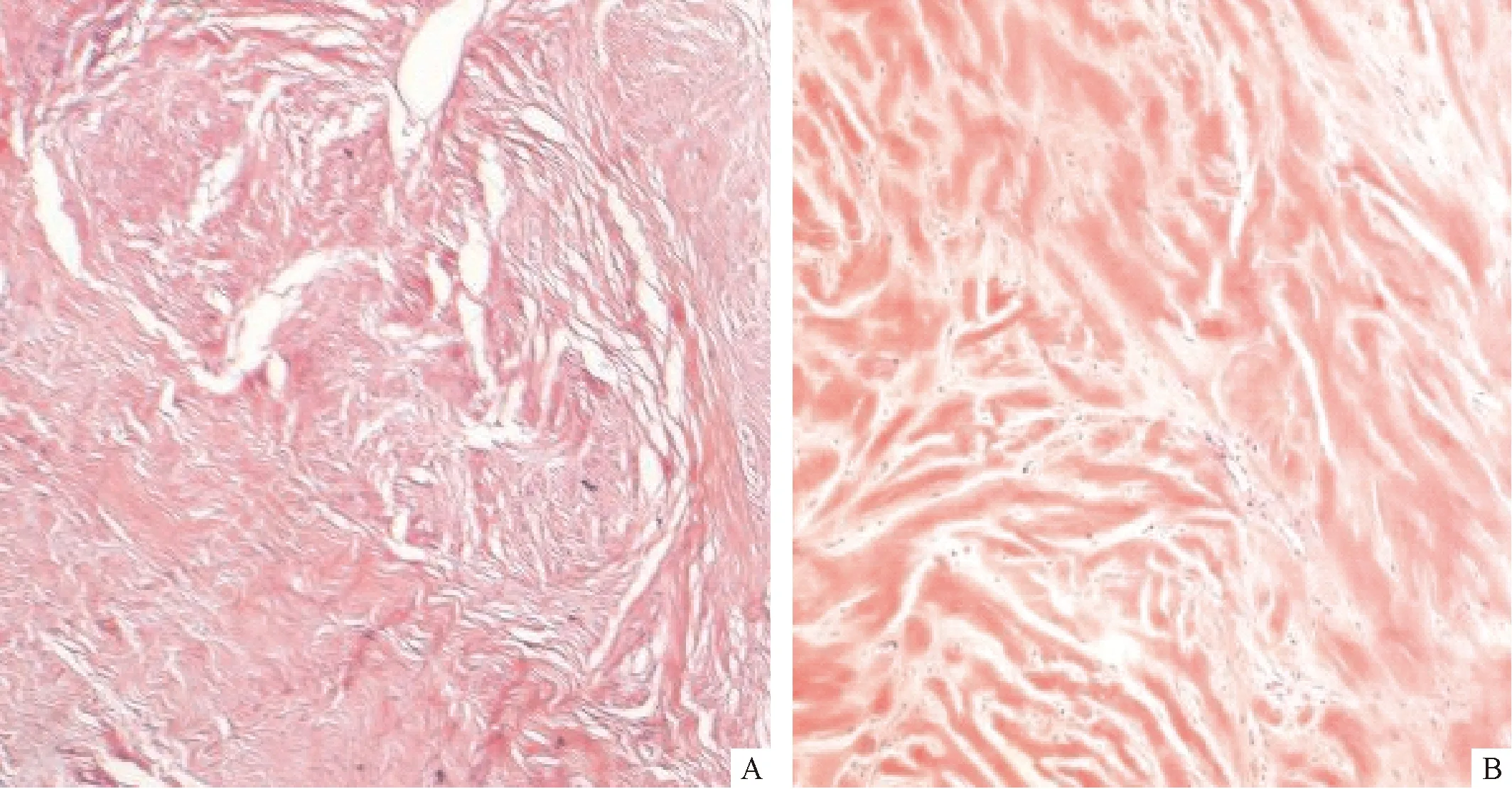
注:A:增生性瘢痕组织;B:正常皮肤组织
2.2 两组NGF、IGF1 mRNA及炎性因子水平比较 瘢痕组NGF、IGF1 mRNA水平及炎性因子MCP-1、IL-1β、IL-6、IL-8 mRNA水平均高于对照组(P<0.05),见表2。
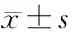
表2 两组NGF、IGF1 mRNA及炎性因子水平比较
2.3 两组NGF、IGF1蛋白水平比较 瘢痕组中NGF、IGF1蛋白水平均高于对照组(P<0.05),见表3。
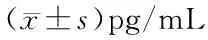
表3 两组NGF、IGF1蛋白水平比较
2.4 未复发组和复发组NGF、IGF1蛋白水平比较 复发组中NGF、IGF1蛋白水平均高于未复发组(P<0.05),见表4。
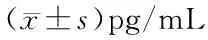
表4 未复发组和复发组NGF、IGF1蛋白水平比较
2.5 增生性瘢痕组织评价及瘢痕形成时间分析 患者增生性瘢痕组织VSS量表评分为(11.47±2.35)分,瘢痕形成时间为(57.32±18.64)d;增生性瘢痕组织TEWL值为(13.74±3.11)g/(m2·h),正常皮肤组织TEWL值为(6.32±2.28)g/(m2·h),增生性瘢痕组织TEWL值明显高于正常皮肤组织(t=20.544,P=0.000),TEWL净丧失量为(7.42±2.03)g/(m2·h)。
2.6 NGF、IGF1水平与炎性因子的相关性 瘢痕组织中NGF mRNA、IGF1mRNA表达均分别与MCP-1、IL-1β、IL-6、IL-8 mRNA呈正相关(P<0.05)。见表5。

表5 NGF、IGF1水平与炎性因子的相关性分析
2.7 NGF、IGF1水平与VSS量表评分、TEWL净丧失量、瘢痕形成时间的相关性 瘢痕组织中NGF蛋白水平与VSS量表评分、TEWL净丧失量、瘢痕形成时间均呈正相关(r=0.406、0.320,P=0.000、0.001),见图2~4;瘢痕组织中IGF1蛋白水平与VSS量表评分、TEWL净丧失量、瘢痕形成时间均呈正相关(r=0.352、0.439,P=0.000、0.000),见图5~7。此外,瘢痕组织中NGF蛋白水平与IGF1蛋白水平也呈正相关(r=0.382,P=0.000),见图8。

图2 NGF水平与VSS量表评分相关性图

图3 NGF水平与TEWL净丧失量相关性图

图4 NGF水平与瘢痕形成时间相关性图

图5 IGF1水平与VSS量表评分相关性图

图6 IGF1水平与TEWL净丧失量相关性图

图7 IGF1水平与瘢痕形成时间相关性图

图8 瘢痕组织IGF1水平与NGF水平的相关性图
3 讨论
烧伤后,皮肤创面愈合会经历炎性反应、组织增生及组织改建3个阶段,任一阶段异常均可能造成增生性瘢痕,研究发现,烧伤患者增生性瘢痕发病率高达70%,患者常伴有瘢痕、瘙痒、挛缩和疼痛等症状,大面积烧伤还可能会导致患者运动受限,严重影响患者正常生活[7]。近年来,手术、类固醇注射、放射治疗等方式已成为治疗增生性瘢痕的主要手段,但治疗效果仍不够理想。因此,深入探讨增生性瘢痕发生机制,对寻找更佳的治疗手段意义重大[8]。
增生性瘢痕形成过程中,炎性细胞和成纤维细胞异常增殖,并大量分泌细胞因子和胶原纤维,导致肉芽组织增生,与此同时,部分细胞因子抑制细胞修复,引起瘢痕的增生性变化[9]。IGF1在伤口愈合早期表达量明显增加,在伤口愈合过程中发挥重要作用,可介导生长激素合成与分泌,并直接作用于真皮成纤维细胞,促进内皮细胞、成纤维细胞进行有丝分裂以及成骨细胞产生胶原蛋白[10]。目前普遍认为,长期炎症状态及胶原蛋白过度积聚可促进增生性瘢痕的形成。Hazarika等[11]研究发现,在体外,IGF1可刺激皮肤成纤维细胞产生胶原蛋白,且呈剂量、时间依赖方式。上皮细胞中的IGF1可在伤口愈合过程中促进真皮成纤维细胞的有丝分裂和纤维化,从而导致增生性瘢痕形成[12]。本研究结果显示,增生性瘢痕组织中IGF1 mRNA及蛋白水平均高于正常皮肤组织,且与MCP-1、IL-1β、IL-6、IL-8等炎性因子呈正相关,结合上述研究推测,IGF1可能通过抑制成纤维细胞凋亡、促进胶原合成、影响皮肤炎症状态等方式,参与增生性瘢痕形成过程[13]。
NGF是重要的神经系统生物活性分子,不仅可加速创面神经纤维再生,还可调节造血、免疫等过程,并通过调节炎性细胞的活性及功能加速创面愈合,且在创伤后局部疼痛中起重要作用[14]。NGF可由多种细胞如修复细胞、炎性细胞等分泌合成,与创伤修复关系密切。机体软组织受创发生局部炎症反应后,胶原蛋白、血管母细胞、纤维母细胞、肌纤维母细胞等出现增生,局部血运增加,NGF可在上述过程中发挥调节和促进作用[15]。本研究结果显示,增生性瘢痕组织中NGF mRNA及蛋白表达均上升,且与炎性因子MCP-1、IL-1β、IL-6、IL-8均呈正相关,推测其可能通过趋化、活化炎性细胞启动创伤部位的胶原代谢,引发胶原过度积累,在加速创面愈合的同时,导致增生性瘢痕发生[16]。
VSS是临床常用的瘢痕评价方法,本研究的相关性结果显示,增生性瘢痕组织IGF1、NGF蛋白水平与VSS评分均呈正相关,提示IGF1、NGF可通过刺激胶原蛋白、胶原纤维过度增生,引起细胞外机制稳定性下降,从而导致瘢痕形成[17]。表皮屏障功能与维持皮肤稳态密切相关,一旦损伤发生,表皮可非常敏感地感应到损伤,并快速恢复屏障功能,启动保护性免疫反应,调节表皮炎症状态,恢复屏障功能,控制真皮瘢痕的形成。因此,在瘢痕的演变过程中,新生上皮屏障功能发挥重要作用,临床上可通过改善皮肤屏障功能预防增生性瘢痕[18]。本研究中,增生性瘢痕组织中TEWL值高于正常皮肤组织,提示增生性瘢痕组织皮肤干躁、水分蒸发较多,存在皮肤屏障功能障碍[19]。且增生性瘢痕组织IGF1、NGF蛋白水平与TEWL净丧失量均呈正相关,表明IGF1、NGF水平与皮肤屏障功能障碍有关,两者有望成为评价瘢痕预后的指标以及治疗增生性瘢痕的新靶点。本研究还发现,增生性瘢痕组织IGF1、NGF蛋白水平与瘢痕形成时间均呈正相关,提示IGF1、NGF水平与伤口愈合时间有关,检测两者水平可能有利于早期评估瘢痕形成及预后情况。此外,增生性瘢痕组织中IGF1与NGF水平呈正相关,猜测两者可能通过影响创伤部位的炎症反应以及胶原代谢,共同影响增生性瘢痕的发生。此外,本研究发现复发组中NGF、IGF1蛋白水平均高于未复发组,提示NGF、IGF1水平升高可能与增生性瘢痕术后复发有一定关系。
综上所述,增生性瘢痕组织中NGF、IGF1 mRNA及蛋白水平均升高,且两者与炎性因子、瘢痕状态、表皮屏障功能、瘢痕形成时间及患者术后复发有关,有望成为临床干预瘢痕的新治疗靶点。但本研究仅随访6个月,NGF、IGF1水平与增生性瘢痕患者术后复发的关系需增加样本进行验证,另NGF、IGF1是否能够应用于增生性瘢痕的临床治疗,仍需进行大量的动物研究及临床试验来验证。
利益相关声明:所有作者均声明无利益冲突。
作者贡献说明:梁赞姜、金洪娟和徐洋负责研究设计、实施、采集分析数据和论文撰写以及研究经费的获取,行政、技术或材料支持等,黄溶溶、向成负责资料收集、数据分析及其他工作支持。

