线粒体功能障碍在脓毒性心肌病中的研究进展
张共鹏,程志鹏,魏艳龙,尚志文,董孝彧,汪 锐,叶红伟,高 琴
脓毒症是目前临床急危重症医学面临的重要问题,是住院病人死亡的重要原因之一。2016年,脓毒症和感染性休克的第三版国际共识提出脓毒症3.0的新定义为机体对感染的反应失调进而导致多器官功能障碍[1]。脓毒症如不能及早被发现并及时处理,可导致脓毒症休克、多脏器衰竭和死亡。最新报道显示,2017年全球脓毒症病人人数达4 890万,其中1 100万例病人死亡,占全球死亡人数的20%[2]。在美国,每年有170万住院病人出现脓毒症,并导致27万人死亡[3]。预防其诱因,减轻其并发症或器官功能障碍成为全球亟待解决的问题之一。
心脏功能障碍是脓毒症所导致的最常见的器官功能障碍,也称为脓毒性心肌病(sepsis-induced cardiomyopathy,SIC),SIC病人心脏出现结构和功能上的改变,最早的临床表现为左、右心室收缩和舒张功能障碍,心功能不全,主要有3个特征:左心室扩张、射血分数下降以及7~10 d内射血分数恢复[4]。
线粒体不仅是负责营养代谢和能量产生的高度动态的细胞器,而且线粒体融合分裂、生物合成、介导不同细胞死亡等过程还共同参与疾病的发生发展,线粒体稳态对维护机体重要脏器的生理功能发挥关键作用。脓毒症诱导的心肌线粒体损伤或功能障碍是心肌细胞代谢障碍、能量产生不足、氧化应激、免疫失调的重要原因,严重时导致心脏等多器官衰竭,甚至死亡。因此,减轻线粒体功能障碍对于维持心肌正常功能活动至关重要,并且可能是为SIC提供更好预后的一种重要的可行措施[5]。
SIC时,线粒体功能障碍主要表现为线粒体抗氧化系统功能失衡、钙超载、线粒体生物发生、促进一氧化氮生成、线粒体解偶联、线粒体能量代谢紊乱、参与不同类别细胞死亡方式等机制。
1 线粒体抗氧化系统功能失衡
线粒体抗氧化系统功能失效增加机体诱导炎症、免疫、激素代谢和生物能反应的激活等,导致不可逆的氧化应激状态和线粒体功能障碍或失效,参与脓毒症的发病机制[6]。脓毒症时,机体产生的内毒素在心肌细胞中通过黄嘌呤氧化酶、烟酰胺腺嘌呤二核苷酸/烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NADPH)氧化酶诱导线粒体产生超氧化物、过氧化氢和羟基自由基,进一步刺激内皮细胞产生更多的活性氧(reactive oxygen species,ROS),引发恶性循环[7]。
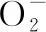
2 线粒体钙超载
线粒体正常功能的维持需要一定的质子梯度,而线粒体通透性转换孔(mitochondrial permeability transition pore,mitoPTP)在维持质子梯度中发挥重要作用。在生理条件下,机体内正常浓度的Ca2+转移到线粒体对维持线粒体功能是必要的,Ca2+在线粒体膜间隙和基质中发挥作用,调节底物载体的活性,刺激TCA循环、烟酰胺腺嘌呤二核苷酸的形成,从而刺激呼吸链的活性,增加ATP的产生[12]。但Ca2+超载是mitoPTP开放的主要诱发因素[13],且这一过程连同细胞色素c的释放和凋亡级联反应激活一起发生。正常情况下,线粒体可以吸收内质网释放的Ca2+,缓冲Ca2+的毒性作用[11],线粒体Ca2+内流由线粒体钙转运蛋白控制,而Ca2+排出则由线粒体Na+/Ca2+交换器和线粒体H+/Ca2+交换器控制,两者协同作用维持线粒体Ca2+稳定[14]。但在脓毒症期间,内质网释放大量Ca2+,超过了线粒体的吸收能力,使得线粒体中的Ca2+超载,导致mitoPTP开放,线粒体膜电位丢失,线粒体逐渐肿胀直至外膜破裂,引起一系列病理变化。脓毒症诱导的心肌细胞损伤中,Ca2+的异常转运导致mitoPTP的开放可引起半胱天冬酶蛋白的激活,并最终导致心肌细胞收缩功能障碍。研究发现,抑制NOX2可保持细胞内Ca2+浓度和线粒体功能,减轻脓毒症心肌损伤[11,15]。在脓毒症动物模型中,线粒体Ca2+转运蛋白功能障碍,线粒体Na+/Ca2+交换器功能障碍会导致SIC;包括抑制L型钙通道、肌浆网钙泵、兰尼碱受体Ca2+泄漏增加、Ca2+敏感性降低[16]。
3 线粒体生物发生
生理情况下,线粒体需要不断更新,因此需要新的健康线粒体来满足机体细胞代谢对能量的需求,即生物发生。线粒体生物发生是维持线粒体持续更新的必需过程,当线粒体生物发生出现失衡,直接影响线粒体正常功能。在脓毒症期间,过量的ROS和自由基生成损伤线粒体,导致线粒体合成受损。LPS使过氧化物酶增殖体激活受体γ辅激活因子1-α(peroxisome proliferator-activated receptorγcoactivator-1α,PGC-1α)、雌激素相关受体α以及过氧化物酶体增殖体被激活。线粒体生物发生在脓毒症早期减少,晚期增加。据报道,线粒体生物发生可能部分抵消线粒体蛋白质损耗,有助于维持危重病人的线粒体功能和能量状态[17]。促进线粒体生物发生可以改善脓毒症的预后。LI等[18]证实松戈林通过Nrf2与PGC-1α共激活促进线粒体生物发生,从而减轻了脓毒症诱导的心肌损伤。YU等[19]证明褪黑素通过AMPK-PGC-1α-Sirtuin-3信号通路增强线粒体生物发生来保护线粒体功能,另外XIN等[20]发现,Sirtuin-3/AMPK轴控制了PGC-1α的转录和活性,从而促进线粒体生物发生,防止LPS诱导的线粒体损伤和心肌细胞死亡。然而过度的生物发生可以加重线粒体功能障碍。研究[15]表明,PGC-1α的过表达引起过量的线粒体生物发生,可导致心力衰竭。吡格列酮和罗格列酮等过氧化物酶体增殖物激活受体γ激动剂都能诱导动物和人类的线粒体生物发生,还可以防止细胞线粒体因受到损伤刺激而发生的心肌功能障碍[21]。以上结果提示适量的线粒体生物发生在脓毒症心肌损伤中起到保护作用。
4 一氧化氮生成增多
5 线粒体解偶联
线粒体ATP和ROS的产生受解偶联蛋白(uncoupling proteins,UCPs)家族的调节,该蛋白位于线粒体内膜,可以催化调节质子从膜间传输到线粒体基质中[27]。米切尔的能量转导化学分子理论指出,氧化磷酸化链将电子传输并最终转移到O2上,此过程产生的自由能可用于建立穿过线粒体内膜的电化学H+梯度。质子通过F0F1-ATPase的F0亚单位返回基质,从而从ADP中再生ATP。在生理条件下,一些H+无需F0F1-ATPase即可返回到线粒体基质中,可通过UCPs实现合成ATP的“线粒体解偶联”[13]。目前,已经发现了3种UCPs(UCP1、UCP2、UCP3),它们分别位于不同的组织中。其中UCP2在生理或病理状态下可以调节线粒体ROS的产生和能量传导,UCP2表达与ROS、线粒体肿胀度呈正相关,而与线粒体膜电位则呈负相关,抑制UCP2表达可抑制ROS产生,改变脂肪酸代谢,从而保护线粒体功能,这说明脓毒症模型心肌损伤时UCP2表达与线粒体损伤密切相关[28]。向小鼠腹腔内注射LPS,发现小鼠心功能明显下降,存活率降低,心肌UCP2表达上调;而敲除UCP2基因后,心肌损伤减轻,这表明UCP2是脓毒性心脏功能障碍的效应物[29]。但也有研究表明,大鼠H9C2心肌细胞在LPS和肽聚糖G条件下培养以模拟脓毒症条件,结果显示ATP水平降低,心肌细胞受到损伤,但当使用抗UCP2的小干扰RNA抑制UCP2的表达后,心肌损伤加重[30]。这与黄锦达等[28]研究结果相矛盾,但也提示UCP2在SIC中可能发挥不同作用。
6 线粒体能量代谢紊乱
线粒体能量代谢紊乱在疾病中的作用日趋引起重视。细胞的生命活动离不开能量,尤其像心肌、骨骼肌和神经细胞,其能量主要来自于线粒体产生的ATP。在正常情况下,心脏中的线粒体通过氧化磷酸化获得95%的ATP,ATP的产生是通过许多底物的分解代谢进行的,包括脂肪酸(fatty acids,FAs)、葡萄糖、酮体和氨基酸[31]。SIC的特征之一是FAs代谢改变。在临床脓毒症研究中,SIC被证明伴随着心脏FAs摄取的减少以及心肌细胞中脂质和糖原的积累。FAs在能源生产中所占份额有所下降[32]。对死于脓毒症的病人的心脏进行了评估,发现心肌细胞内脂质积聚,这可能是FAs氧化紊乱造成的[33]。ZHENG等[34]在CLP诱导的实验性脓毒症模型的研究中发现,脓毒症显著增强了糖酵解,血清乳酸水平升高,糖酵解代谢在SIC中起作用;他们还观察到2-脱氧-D-葡萄糖通过调节糖酵解代谢,可改善脓毒症小鼠模型的心功能和生存结果。
7 线粒体参与不同细胞死亡方式
脓毒症心肌损伤过程中,线粒体参与多种细胞死亡方式,包括凋亡、自噬、焦亡、铁死亡等。
7.1 凋亡和自噬 凋亡通过死亡受体途径或线粒体途径被激活,这两种途径的激活最终均可能导致肌动蛋白收缩装置的破坏和心肌细胞完整性的丧失。在LPS和CLP诱导的脓毒症发展过程中,机体通过激活外源性和内源性凋亡途径诱导心肌细胞凋亡[35]。线粒体凋亡主要由Bcl-2家族成员控制,主要位于线粒体外膜。具体而言,凋亡由Bcl-2蛋白Bax和Bak所控制。在细胞凋亡中激活后,它们渗透线粒体外膜,并使凋亡因子(包括细胞色素C)从内膜释放到细胞质中,进而激发级联激活,最终导致细胞死亡[36]。Qiang-Xin 1治疗有效阻止了心肌细胞中caspase家族成员(如caspase-3、caspase-9和caspase-12)的激活,通过促进抗凋亡蛋白和预防促凋亡介质的激活,防止脓毒症诱导的线粒体依赖性凋亡,改善脓毒症小鼠的预后[37]。
自噬包括自噬体的形成以及对特定物质的识别、自噬体的成熟和与溶酶体的融合几个阶段,参与多种疾病的发生。腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)对线粒体自噬等线粒体生物学和体内平衡的各个方面都有特定的调控作用[38]。AMPK直接磷酸化线粒体分裂因子MFF,通过动力蛋白样蛋白DRP1调节线粒体分裂,并磷酸化自噬启动因子ULK1,使其激活VPS34、VPS15、ATG14L和Beclin1组成的第三类PI3K复合物I,这种复合物在新生的自噬体膜上产生磷脂酰肌醇-3-磷酸,以帮助形成自噬体膜[39]。调节AMPK可以减少线粒体裂变,促进线粒体融合[40]。
有研究[41]表明,木犀草素通过AMPK/ULK1信号增加自噬来减轻LPS诱导的心肌损伤,同时减弱了脓毒症小鼠心肌中裂解的caspase-3和caspase-9的表达,发挥抗凋亡作用。此外,有研究[42]证实了在LPS诱导的脓毒症模型中,人参皂甙Rg3可上调人原代肝细胞中的自噬相关蛋白,激活AMPK信号通路,促进线粒体自噬,抑制人原代肝细胞凋亡,从而保护脓毒症引起的细胞和器官损伤。研究人员分析,在脓毒症起始阶段,自噬是适应性的,以促进细胞存活和维持器官的正常功能。然而,随着脓毒症病程发展到严重阶段,自噬反应不充分,超过其控制范围,导致不适应的结果,出现细胞成分降解或是有毒物质积累,严重时会出现细胞不可逆死亡[43]。
7.2 NOD样受体蛋白3炎症小体介导的细胞焦亡 NOD样受体蛋白3(NOD-like receptor protein 3,NLRP3)炎症小体是先天免疫系统的重要介质通路,在脓毒症诱导的心肌损伤中具有重要作用。NLRP3炎症小体复合物主要包括3个成员,即凋亡相关斑点样蛋白、NLRP3和caspase-1的前体(pro-caspase-1)。NLRP3作为复合物的核心蛋白,在细胞质中充当信号受体,一旦被激活,NLRP3招募ASC和pro-caspase-1,形成炎症小体复合物激活caspase-1,切割IL-1β和IL-18前体,成熟的IL-1β和IL-18分泌到细胞外,参与炎症反应[44]。焦亡是最近发现的一种程序性细胞死亡。其中,caspase-1依赖性细胞焦亡最早是在感染了革兰阴性菌福氏志贺氏菌的小鼠巨噬细胞中被发现的[45]。NLRP3炎症小体可以识别包括PAMP和DAMP在内的多种刺激,以激活pro-caspase-1裂解形成活性caspase-1,促使IL-1β和IL-18的成熟和分泌,进而介导细胞焦亡[46]。LPS等外源性刺激和尿酸和ATP等内源性损伤信号可能会诱导共同途径激活NLRP3炎症小体,然后引发caspase-1依赖性细胞焦亡。QIU等[47]发现,LPS在高糖条件下的H9C2心肌细胞中激活NLRP3炎症小体,通过上述级联反应过程介导细胞焦亡,同时,随着ROS的增加,这一反应过程加重。使用caspase-1抑制剂Ac-YVAD-CMK和炎症小体抑制剂BAY11-7082抑制caspase-1和NLRP3炎症小体时,H9C2细胞中LPS诱导的细胞焦亡损伤显著降低。硫氧还蛋白相互作用蛋白(Thioredoxin-interacting protein,TXNIP)是一种内源性ROS清除蛋白硫氧还蛋白的抑制剂,当细胞受到各种因素诱导的ROS攻击时,它将从TXNIP-硫氧还蛋白复合物中解离并结合NLRP3。线粒体活性氧(mitochondrial ROS,mtROS)的过度产生是NLRP3炎症小体激活的一个关键因素。感染和内源性刺激使NLRP3向线粒体募集,线粒体复合物Ⅰ抑制剂通过NLRP3激活增加mtROS的产生并诱导IL-1β分泌,而这种激活可以被ROS清除剂阻断[48]。在糖尿病肾病中,高水平的mtROS伴随硫氧还蛋白表达的抑制中断了硫氧还蛋白和TXNIP之间的相互作用,从而促进TXNIP与NLRP3的结合,导致NLRP3/IL-1β信号通路的激活,即通过线粒体ROS-TXNIP/NLRP3/IL-1β轴的激活损伤肾小管[49]。siTXNIP抑制了NLRP3的活化和ROS的产生,同时降低了IL-1β和IL-18的水平,提高了过氧化氢酶和锰超氧化物歧化酶的水平,减轻了脓毒症的心肌损伤[50]。LI等[51]揭示了STING-IRF3可以通过激活NLRP3触发LPS诱导的小鼠心脏功能障碍和细胞焦亡,而STING敲除可抑制IRF3的磷酸化和核转位,进而抑制NLRP3介导的心肌细胞焦亡,起到保护心肌的作用。
7.3 铁死亡 铁死亡由DIXON等[52]在2012年提出,铁死亡是由于细胞内ROS的积累超过了谷胱甘肽和以谷胱甘肽为底物的磷脂氢过氧化物酶维持的氧化还原含量所致。合成的小分子化合物Erastin可通过抑制半胱氨酸谷氨酸转运体以及谷胱甘肽过氧化物酶4活性触发铁死亡[53]。线粒体促进脂质ROS的生成,这是铁死亡的先决条件,此外,前列腺素内过氧化物合酶2是公认的铁死亡标志物[54]。在脓毒症小鼠心脏中也观察到其表达水平增加[55]。在LPS诱导的大鼠肺部炎症模型中,铁作为免疫调节因子影响肿瘤坏死因子-α的合成,最终加重肺损伤[56]。LI等[57]证明了LPS刺激增强了核受体共激活因子4的表达,核受体共激活因子4随后与铁蛋白相互作用并促进其自噬降解。铁蛋白的降解进一步释放大量游离铁,并进一步激活位于线粒体膜上的线粒体铁离子转运蛋白。细胞质游离铁通过线粒体铁离子转运蛋白转运到线粒体,引起线粒体铁超载和过量ROS,最终触发心肌细胞脂质过氧化和心肌细胞铁死亡。
目前对SIC线粒体功能障碍的机制研究大部分都还是基于动物实验,对于临床治疗SIC是否有具体可行的针对线粒体靶向治疗的措施,仍有许多挑战。线粒体功能障碍是SIC的一个重要病理变化,因此靶向脓毒症中的线粒体功能障碍可能是潜在的治疗策略[58]。我们相信,随着研究的不断深入,采用有效手段干预线粒体各关键环节,可以显著降低脓毒症的发病率及SIC的死亡率。

