STAT3蛋白在三阴性乳腺癌中的作用和临床病理意义
朱 清,张光辉,赵 艳
三阴性乳腺癌(triple-negative breast cancer,TNBC)是一种缺乏人类表皮生长因子受体2和雌激素、孕激素表达的乳腺癌亚型[1]。TNBC组织学上分化低、增殖快、转移早、临床上抗激素和HER2治疗无效,目前TNBC的治疗主要行常规化疗,循证医学[2]表明TNBC病人复发率高、预后差、生存时间短。因此,发现靶基因免疫治疗对TNBC的临床诊断、治疗和预后有重要意义[3]。有研究[4]表明组成型激活信号转导激活剂3(STAT3)可参与 TNBC的血管生成、发生发展、侵袭和迁移。短发夹RNA(short hairpin RNA,shRNA)是一种DNA分子,可以克隆到表达载体中,表达小干扰RNA(small interfering RNA,siRNA,RNA双链19~21个核苷酸)[5]。基于STAT3设计shRNA序列并将其克隆成特定的载体,本文旨在探讨STAT3在TNBC中的调控机制及其作为治疗靶点的应用前景。
1 材料与方法
1.1 研究对象 选取2017年在本院接受乳腺肿瘤切除的130例病人作为研究对象。病人术前均未接受任何治疗,术后病理诊断为TNBC。肿瘤组织为实验组,肿瘤邻近(距肿瘤病灶边缘3 cm以上)的正常乳腺组织为对照组。本研究经医院医学伦理委员会批准。
1.2 细胞系和主要试剂 实验细胞:人乳腺癌细胞株(MDA-MB-231)由上海弘顺科技有限公司提供。实验试剂及材料:STAT3-shRNA表达载体由Santa Cruz Biotechnology,Inc.提供。逆转录试剂盒由Pro-mega Bio提供,SYBR Real-Time PCR试剂盒由大连Takara提供。DMEM(高)培养基、胎牛血清、PBS平衡液由GIBCO提供。兔抗人单克隆一抗STAT3和兔抗β-肌动蛋白由美国Bioword提供。LipofectamineTM2000,Trizol试剂由Invitrogen提供。CCK-8试剂、Transwell小室由Beyotime Biotechnology(中国上海)提供;结合基质胶(Matrigel,BD) 由 Merck 提供。
1.3 免疫组织化学 分离石蜡切片并水合,置于0.01 mol/L枸橼酸钠缓冲液中,微波加热抗原修复。在3% H2O2去离子水中浸泡10 min,封闭15 min,加入STAT3一抗(工作浓度1∶200)4 ℃孵育过夜。PBS洗涤后,加入HRP标记的抗兔二抗室温孵育15 min。PBS洗涤后加入DAB溶液显色,水洗,苏木精复染,脱水,固定,显微镜下观察。阴性对照使用PBS代替一抗。
1.4 细胞培养 将混有10%胎牛血清、50 U/mL青霉素和50 U/mL链霉素的 DMEM培养基的培养瓶置于37°C 和5% CO2饱和度的培养箱中孵育MDA-MB-231,隔天换液,每2 d传代。
1.5 设计与合成 STAT3-shRNA表达载体 根据人类基因序列[Genbank,NM_008210,STAT3]转录siRNA的作用原理设计、合成和选择目标:763-1278,TTG TAG ACG GAT CTA GCC GAT;GC含量52.63%,在目标位点合成的寡核苷酸:5′-CTA GGG ATC GTC TTA GAG TTG AAG TCT AAG TTG TCT AGA CTT CAA CTC TAA GAC GAT TGA AAC CTA-3′,3′-GAT CCC TAG CAGAAT CTC AAC TTC AGA TTC AAG AGA TCT GAA GTT GAG ATT CTG CTA TTT TTG GAT-5′。
1.6 细胞转染和分组 将MDA-MB-231以3×105个细胞/孔接种于6孔板中,根据lipofectamineTM2000试剂说明书转染STAT3-shRNA(50 nmol /L)至 MDA-MB-231 细胞后孵育48 h,更换培养基后继续孵育24 h。荧光显微镜下计算细胞转染效率:每个高倍视野绿色荧光的细胞数/细胞总数,取5个高倍视野平均值。实验分组:实验组(转染STAT3-shRNA)、阴性对照组(转染无序RNA)、空白对照组(未转染)。
1.7 Western blotting检测 如上所述的蛋白质和细胞分组。细胞转染24 h后,胰蛋白酶消化、提取并测定蛋白浓度。根据Western blotting试剂盒说明书,每孔加入50 μg电泳分离的跨膜蛋白溶液,5%脱脂奶粉封闭,STAT3一抗(工作浓度1 ∶400)孵育过夜。TBST洗涤后,加入二抗孵育2 h成像。以β-actin为内参,用Bandscan 5.0凝胶分析软件分析蛋白表达量。
1.8 RT-PCR检测 根据RT-PCR试剂盒说明书检测STAT3 mRNA的相对表达量。引物合成:STAT3上游引物5′-GTC ACT GTT CCG TCT TCT-3′,STAT3下游引物:5′-TGA GCT AGG GAC TGT TTT-3′;内参GAPDH上游引物:5′-ATC GTG TCA GTC GGC GTA GAA GAA-3′,GAPDH下游引物:5′-TGG TTT AGG CAA CTG AGG CTG GAA-3′。实时荧光定量PCR仪热循环反应体系:分别加入0.4 μL上下游引物、2 μL cDNA、10 μL SYBR和去离子水至20 μL。PCR反应条件:90 ℃预变性35 min,90 ℃10 s,70 ℃20 s,PCR循环35次。绘制溶解曲线:90 ℃ 10 s、70 ℃ 20 s、90 ℃ 10 s。验证STAT3基因和GAPDH基因的扩增效率,使用2-ΔΔCt法计算表达量的比值。每组设置 3 个重复孔,实验重复3 次。
1.9 CCK-8 测定 于96孔板中消化、重悬和计数 MDA-MB-231细胞100 μL( 5×103个细胞/孔)。待分组后的MDA-MB-231转染24 h,每孔加入10 μL CCK-8溶液反应4 h。酶标仪(TECAN safire 2)测定450 nm波长处的吸光度值,计算各组细胞增殖活性。实验重复3次。
1.10 细胞侵袭和迁移实验 侵袭实验:于Transwell小室中均匀铺上25 μL Matrigel结合基质胶,消化、重悬和计数100 mL MDA-MB-231悬液(5×104细胞/孔),加200 μL的无血清培养基至小室中,放置在24孔板中孵育48 h。弃去每孔中的培养基后加入PBS冲洗5 min,加入0.1%结晶紫染色1 h后擦去腔室中的细胞后放置显微镜下观察,随机计数5个高倍视野中穿透膜的细胞数。在迁移实验中,Transwell小室的细胞膜不覆盖Matrigel结合基质胶,其余步骤同侵袭实验。每组设置3个重复孔。实验重复3次。
1.11 统计学方法 采用配对t检验、配对χ2检验、非参数秩和检验、方差分析和q检验。
2 结果
2.1 STAT3在不同乳腺组织中的表达 STAT3蛋白主要在细胞核中表达。结果表明,正常乳腺组织核染色表达减弱甚至缺失,而乳腺癌组织核染色表达呈阳性,组间差异有统计学意义(χ2=8.53,P<0.01)(见图1、表1)。
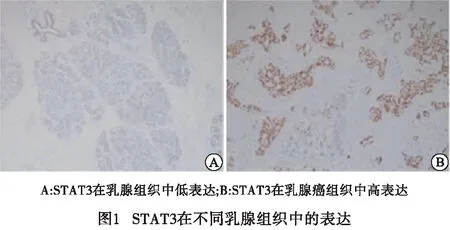

表1 STAT3在不同乳腺组织中的表达
2.2 STAT3表达与乳腺癌临床病理因素的关系 TNBC中STAT3蛋白的高表达与肿瘤大小、组织学分级、TNM分期和淋巴结转移呈正相关(P<0.05~P<0.01)。即肿瘤体积越大,组织学分级越高,TNM分期越晚,伴有淋巴结转移的乳腺癌中STAT3阳性表达率越高(见表2)。
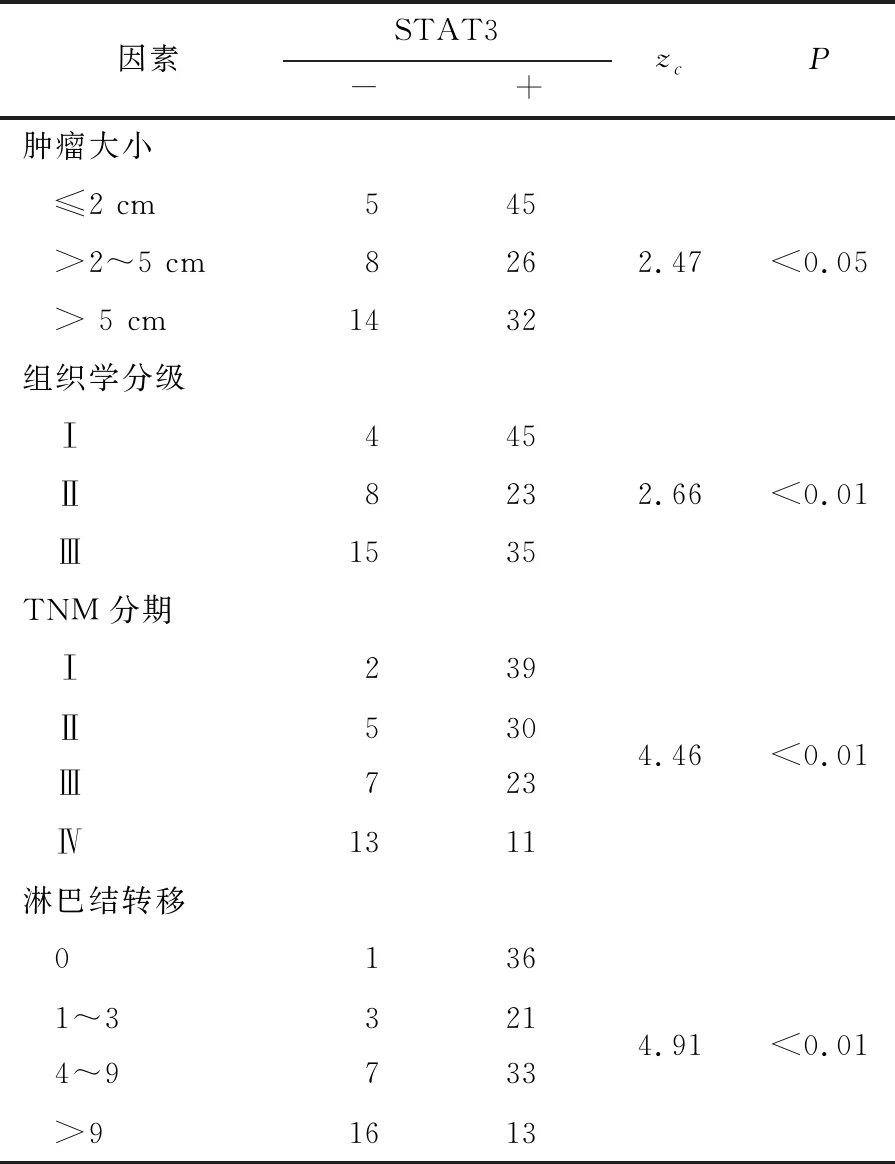
表2 STAT3表达与乳腺癌临床病理特征的联系
2.3 Western blotting检测STAT3蛋白表达 乳腺癌组织中STAT3蛋白的表达(1.01±0.02)显著高于正常乳腺组织(0.24±0.02)(t=-310.40,P<0.01)(见图2)。MDA-MB-231转染48 h后,实验组STAT3蛋白与阴性对照组和空白对照组相比表达降低,差异有统计学意义(P<0.01)(见图3、表3)。
2.4 RT-PCR检测STAT3mRNA表达 MDA-MB-231转染48 h后,实验组mRNA表达水平与阴性对照组和空白对照组相比表达降低,差异有统计学意义(P<0.01)(见表3)。



表3 shRNA转染后MDA-MB-231细胞中STAT3的蛋白和mRNA表达比较
2.5 STAT3-shRNA对MDA-MB-231增殖活性的影响 CCK-8检测结果显示,MDA-MB-231转染24、48和72 h后,细胞生长抑制率分别为5.6%、17.2%和39.1%。实验组细胞增殖活性与阴性对照组和空白对照组相比下降缓慢,差异有统计学意义(P<0.01)(见表4)。

表4 STAT3-shRNA对MDA-MB-231 增殖率的影响
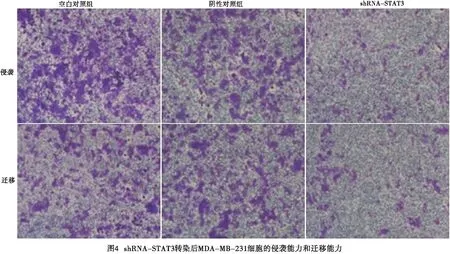
2.6 STAT3-shRNA对MDA-MB-231侵袭迁移的影响 Transwell实验表明,实验组细胞的侵袭和迁移能力低于阴性对照组和空白对照组(见表5)。侵袭和迁移实验结果显示,实验组通过基底膜的细胞数与阴性对照组和空白对照组相比显著减少,差异有统计学意义(P<0.01)(见图4)。

表5 STAT3对MDA-MB-231 侵袭和迁移能力的影响
3 讨论
世界卫生组织 2022 年 1 月 12 日公布的数据显示,2021 年确诊癌症病人数达到1 918万[6]。其中,乳腺癌占新发癌症病例的 12.1%,女性癌症中乳腺癌的发病率和死亡率持续增高,且乳腺癌已超过肺癌成为世界第一大癌[7]。由于 TNBC 特殊的生物学特性,TNBC 也更容易对化疗药物产生耐药性,现有的分子靶向治疗并不能获得较好的临床效果[8-9],极易出现远处转移和复发的症状,往往导致治疗失败和死亡,因此,寻找新的 TNBC 治疗靶点极其重要[10]。
STAT3 是Janus 激活激酶信号转导因子(JAK-STAT) 、 STATs 家族的重要成员之一[11],且是JAK-STAT 信号通路的重要调节因子[12]。STAT3是一种原癌基因,在许多恶性肿瘤中发挥重要作用,其活化后导致肿瘤免疫抑制和抗凋亡,参与细胞增殖、促进血管生成、侵袭[13],如食管鳞状细胞癌、肺腺癌和结直肠腺癌[14]且与JAK-STAT信号通路的表达水平密切相关。最近的一组14 种乳腺癌细胞系的研究[15]表明,激活的STAT3细胞仅在TNBC中发现,并且80%的STAT3被激活[15]。本研究结果显示,STAT3蛋白在乳腺癌组织中的表达高于正常乳腺组织,且STAT3的高表达促进乳腺癌的增殖、侵袭和迁移;后续研究结果表明,TNBC中STAT3蛋白和STAT3 mRNA的阳性表达高于正常乳腺组织,且STAT3在TNBC病人中的表达水平越高,肿瘤增殖越快,肿瘤亦越大,临床分期越晚,侵袭转移能力越强,预后越差。细胞转染后增殖活性缓慢下降,细胞的侵袭和迁移能力明显降低。
STAT3与雌激素和孕激素受体的表达无关[16],但STAT3 在三阴性或雌激素和孕激素受体阴性的乳腺癌组织中高度表达,其中在TNBC的发生发展中,STAT3的过表达是影响TNBC病人预后的独立因素。这也为推测STAT3可以作为乳腺癌临床筛查的标志物和TNBC免疫靶向治疗提供了理论依据[17]。未来临床运用联合STAT3抑制剂的治疗方案可能是对于TNBC一种新的治疗方法[18]。
综上所述,STAT3与TNBC的临床病理相关,提示STAT3可能参与调控TNBC的发生和发展,对乳腺癌的增殖、侵袭和转移中起重要作用,其高表达与预后不良密切相关。后续实验将对其发生机制进行进一步深入研究。

