弗氏链霉菌双拷贝串联基因tylF、tylE和tylCV工程菌的构建
陈亚兰,牛 春,张 萍
(宁夏泰瑞制药股份有限公司,银川 750101)
泰乐菌素(Tylosin)是一种由弗氏链霉菌(Streptomycesfradiae)产生的大环内酯类兽用抗生素,外观为淡黄色粉末,微溶于水,易溶于有机溶剂,呈弱碱性[1],由美国研究者Hamill等[2]于1959年发现,是国际上目前使用最广泛的兽用抗生素之一[3-4 ]。泰乐菌素对革兰阳性菌、某些革兰阴性球菌、支原体、分枝杆菌、螺旋体及原虫等有抑制作用,常用于防治由支原体感染引起的猪气喘病,也可以治疗猪痢疾、萎缩性鼻炎、关节炎、猪丹毒、钩端螺旋体病等[5]。此外泰乐菌素还可添加到饲料中作为畜禽的抗菌促生长添加剂,促进畜、禽的生长以及对饲料的利用率,被广泛地应用于畜禽生产及兽医治疗,所以国际国内市场需求量极大[6-8]。目前,在大规模工业生产中,弗氏链霉菌是泰乐菌素的主要生产菌[9-11]。泰乐菌素主要由泰乐菌素A、泰乐菌素B、泰乐菌素C和泰乐菌素D四种组分构成,其中泰乐菌素A为主要组分,且生物活性最强。工业生产上要求A组分含量≥85%,四种组分的总含量≥95%。
弗氏链霉菌泰乐菌素生物合成基因簇(tylgene cluster)从抗性基因tylB延伸至tlrC,约85 kb,含43个ORFs提供泰乐菌素合成所需完整的结构基因,其中tylF编码的大菌素-O-甲基转移酶(Macrocin-O-Methyltransferase)催化泰乐菌素 C3 位羟基的甲基化反应[12],催化泰乐菌素C转化为泰乐菌素A,泰乐菌素 C3 位羟基的甲基化反应是泰乐菌素生物合成的最后一步,也是限速反应[13];tylE编码去甲基大菌素-O-甲基转移酶(Demethylmacrocin-O-methyltransferase)催化去甲基大菌素转化为大菌素(Macrocin, tylosin C);tylCV编码碳霉糖转移酶(Mycarosyl transferase),负责将碳霉糖(Mycarose)转移到去甲基拉克亭霉素(Demethyllactinomycin),合成去甲基大菌素(Demethylmacrocin)。
外源基因导入链霉菌的常用方法有PEG介导的原生质体法、电转化法和接合转移法[14-15],相较于其他两种方法,接合转移法除了操作简单外,还可以避开包外核酸酶,一定程度上能克服链霉菌对外源基因的限制[16],在链霉菌遗传操作中广泛应用。链霉菌工程菌构建中常用的载体为pSET152整合型表达载体,含阿泊拉霉素抗性基因,能通过噬菌体 φC31 的attB位点特异性整合到链霉菌染色体上[17-18 ],是链霉菌常用的质粒。红霉素抗性基因启动子(permE)是已知的链霉菌组成型强启动子,它常用于在链霉菌中提高目的基因(簇)的表达水平,以方便目的基因(簇)的表达产物或所生物合成化合物的检测,以及提高目标化合物的生物合成水平等[19-20]。
1 材料与方法
1.1 菌株和质粒 弗氏链霉菌、质粒pSET152(含有红霉素抗性基因启动子permE)均由宁夏泰瑞制药股份有限公司保藏。
1.2 载体、限制性内切酶和试剂 质粒提取试剂盒、DNA回收试剂盒、全基因组提取试剂盒和各种酶均购自TakaRa公司。
1.3 培养基和抗生素 大肠杆菌的培养基为LB培养基;弗氏链霉菌固体培养基为高氏一号培养基;大肠杆菌-链霉菌接合转移培养基为MS培养基;孢子预萌发培养基为2×YT;发酵培养基采用公司内部培养基[21]。
LB中氨苄青霉素(Ampicillin, Amp)使用量为25 μg/mL,安普霉素(Apramycin, Apr)储存浓度为50 μg/mL, 卡那霉素(Kanamycin, Kan)的使用量为25 μg/mL,萘啶酮酸(Naphthylpyruvic acid, Nap)的使用量为50 μg/mL。
1.4 目的基因的获取 从GenBank下载permE、tylF、tylE和tylCV的基因序列,根据序列使用引物设计软件 Primer Premier 5分别设计permE、tylF、tylE和tylCV的重叠延伸PCR引物(表1),其中permE的上游和tylCV的下游分别引入EcoRV和XbaI酶切位点。以弗氏链霉菌全基因组为模板,PCR扩增获得所需要的目的基因片段,纯化后置于-20 ℃保存,备用。
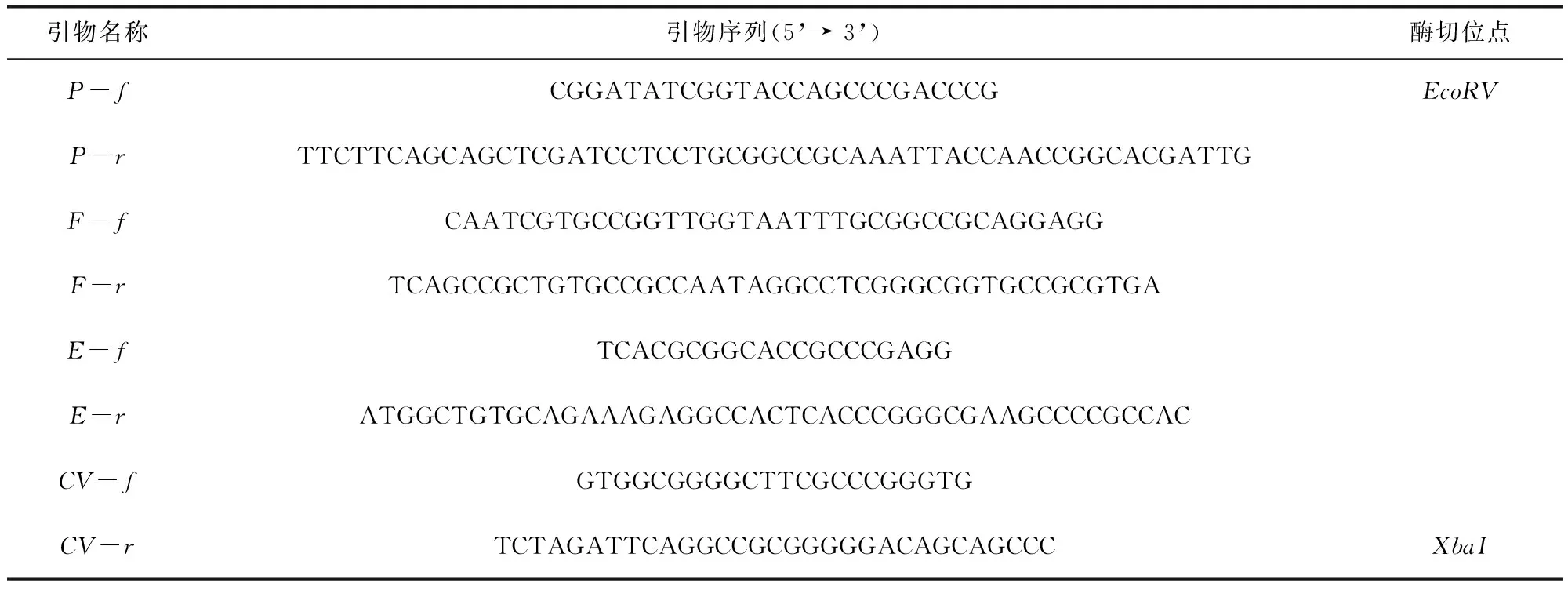
表1 目的基因扩增引物及酶切位点Fig 1 Primers and restriction sites for target gene amplification
1.5 重组片段permE-tylF-tylE-tylCV的获得 用重叠延伸PCR法连接permE、tylF、tylE和tylCV基因,实验方法为:以permE和tylF为模板,用引物P-f/F-r扩增获得permE-tylF基因片段,纯化后-20 ℃保藏;以permE-tylF和tylE为模板,用引物P-f/E-r扩增获得permE-tylF-tylE基因片段,纯化后-20 ℃保藏;以permE-tylF-tylE为模板,用引物P-f/CV-r扩增获得permE-tylF-tylE-tylCV基因片段,纯化后-20 ℃保藏。
1.6 构建重组载体pSET152-permE-tylF-tylE-tylCV使用EcoRV和XbaI酶37 ℃,过夜酶切pSET152质粒和permE-tylF-tylE-tylCV基因片段,回收酶切产物。按照目的基因与载体的摩尔比为7的比例加入酶切后的pSET152质粒和permE-tylF-tylE-tylCV基因片段,16 ℃的温度下在T4 DNA连接酶的作用下过夜反应。将连接产物转化至DH5a大肠杆菌后再转入ET12567大肠杆菌,筛选阳性克隆子。
1.7 ET12567(pUZ8002, pSET152)与弗氏链霉菌的接合转移 将转化子的过夜培养物转接在LB中,在50 μg/mL的安普霉素条件下,37 ℃培养转化子,到合适浓度(OD600在0.4~0.6)收集菌体;用等体积新鲜的LB洗涤菌体两次洗掉抗生素,0.1倍体积的LB悬浮备用。刮取适量孢子研磨,将研磨液于漏斗中过滤,收集滤液,50 ℃热激10 min,冷却到室温后加入等体积的2×YT孢子预萌发培养基;37 ℃、180 r/min摇床培养2~4 h,3000 r/min离心收集孢子,并悬浮于1 mL的培养液中,打散孢子备用;按照供受比为10∶1(或1∶1)将处理过的转化子培养物和孢子悬液混合,混匀后涂布平板[22-23]。培养21 h后覆盖萘啶酮酸(50 μg/mL)和安普霉素(50 μg/mL)。
1.8tylF、tylE和tylCV基因双拷贝菌株泰乐菌素效价检测 将适量弗氏链霉菌菌丝体与接合子的菌丝体接种到发酵培养基中,28 ℃、230 r/min连续培养7 d后,取硫酸铝酸化后的上清液检测泰乐菌素效价,检测方法参见文献[24]。
1.9 接合子的分子水平验证 将出发菌与接合子的菌丝接种到含有Apr的LB培养基中培养至对数生长后期,提取全基因组。分别以引物P-f/CV-r进行PCR扩增。
2 结果与分析
2.1permE、tylF、tylE和tylCV基因的扩增 以弗氏链霉菌全基因组为模板,分别用引物P-f/P-r、F-f/F-r、E-f/E-r、CV-f/CV-r扩增强启动子permE、tylF、tylE和tylCV基因,基因片段大小为270 bp(图1a)、735 bp(图1b)、1188 bp(图1c)和1386 bp(图1 d),将PCR产物纯化后保藏至-20 ℃备用。
2.2 重叠延伸PCR法连接permE、tylF、tylE和tylCV基因 通过重叠延伸PCR法获得重组基因片段permE-tylF-tylE-tylCV,大小约为3500 bp,电泳结果如图2所示,在3500 bp处出现单一、清晰的条带,说明重组片段连接正确,可用于后续实验。将该片段胶回收后于-20 ℃保藏备用。

图2 重组基因片段permE-tylF-tylE-tylCV电泳图Fig 2 Electrophoretic diagram of recombinant gene fragment permE-tylF-tylE-tylCV
2.3 供体菌的构建 筛选到一株阳性克隆子,提取质粒进行PCR验证(图3)和酶切验证(图4),在约3500 bp处扩增出了目的条带,使用EcoRV和XbaI也切出了约3500 bp大小的片段,结合空载体的酶切结果(图5),初步说明pSET152-permE-tylF-tylE-tylCV重组载体构建成功,测序结果表明tylF、tylE和tylCV基因均与GenBank上发表的序列相同。至此,pSET152-permE-tylF-tylE-tylCV重组载体构建成功,可用于后续实验。

图3 pSET152-permE-tylF-tylE-tylCV重组载体PCR验证结果Fig 3 PCR verification results of recombinant vector pSET152-permE-tylF-tylE-tylCV

图4 pSET152-permE-tylF-tylE-tylCV重组载体酶切验证结果Fig 4 Results of enzyme digestion verification of recombinant vector pSET152-permE-tylF-tylE-tylCV

图5 pSET152载体酶切结果Fig 5 pSET152 vector digestion result
2.4 重组菌株的摇瓶发酵验证 从接合转移培养皿中共挑选了20个单菌落,并将其于试管斜面培养,培养12 d后仅有13个单菌落斜面长势较好,斜面孢子层较厚,呈白色。刮取适量带有少量培养基的斜面孢子接种于发酵培养基进行摇瓶发酵验证,培养7 d后测定效价(连续培养3批),结果如表2所示。其中3、6、7、8、9、10和13号连续三批的效价趋于稳定,且高于出发菌株,分别高出约12%、9%、9%、18%、23%、29%和21%。用液相色谱仪分析3、6、7、8、9、10和13号单菌落的发酵液,结果如表3所示。通过表2可得,7、8、9、10、13号单菌落发酵液中泰乐菌素A的含量显著(P≤0.05)高于出发菌,其中10号单菌落泰乐菌素A在10.778 min出峰(图6),相对峰面积为59.07%,高出出发菌11.66%。同样,10号单菌落的泰乐菌素C也显著(P≤0.05)高于其它4株菌和出发菌,而泰乐菌素B和泰乐菌素D的变化不显著,说明增加tylE和tylCV基因的拷贝数可有效提高泰乐菌素C的含量,增加tylF基因的拷贝数可积累泰乐菌素A。

图6 RTL21-10单菌落发酵液液相色谱峰图Fig 6 Liquid chromatographic peak of fermentation broth of RTL21-10 single colony

表2 连续3批发酵摇瓶效价测定情况Tab 2 Determination of fermentation titer for three consecutive batches of shaker

表3 各单菌落发酵液组分Tab 3 Components of fermentation broth of each single colony
2.5 工程菌株的PCR验证 提取 RTL21-10单菌落的全基因组,并以该全基因组为模板,用引物P-f/CV-r扩增permE-tylF-tylE-tylCV片段,电泳结果如图7所示,在3500 bp处有单一、清晰的条带,说明弗氏链霉菌tylF、tylE、tylCV双拷贝工程菌构建成功。

图7 RTL21-10号单菌落PCR验证结果Fig 7 PCR verification results of RTL21-10 single colony
3 讨 论
本研究成功构建了一株双拷贝tylE、tylF和tylCV基因的高产泰乐菌素工程菌株,以上三个基因由强启动子permE启动表达,以确保发酵过程中工程菌的稳定性,强化双拷贝的tylF、tylE和tylCV基因的表达。采用以上策略,获得一株弗氏链霉菌工程菌,单菌落编号为RTL21-10,效价比出发菌高出29%,利用液相色谱对RTL21-10单菌落的发酵液进行分析,各组分均优于对照菌株。由此可见,增加泰乐菌素合成途径中的相关基因的拷贝数可提高抗生素的产量,也可优化组分。本研究成功构建了高产泰乐菌素工程菌株,该方法为弗氏链霉菌的遗传改造提供参考,具有重要的研究意义。
增加合成代谢途径中关键酶基因的拷贝数是链霉菌代谢工程育种的有效手段[25],tylF基因编码的大菌素-O-甲基转移酶是限速酶,可催化泰乐菌素 C3 位羟基的甲基化反应[26]。范亮等[27]构建具有双拷贝tylF基因的泰乐菌素基因工程菌,以解决泰乐菌素基因生物合成的限速环节,重组菌株泰乐菌素的发酵单位较出发菌株提高32.7%。马次郎[28]等人构建了双拷贝tylD、tylF、tylJ基因的泰乐菌素工程菌,泰乐菌素发酵摇瓶效价较出发菌株提高了28.1%,该菌株tylD、tylF、tylJ表达水平高于出发菌株,并且在进入稳定期后期表达量达到最大值。何翔宇[29]利用 Red/ET 同源重组技术构建含有完整泰乐菌素生物合成基因簇的质粒 pBAC-tyl,并将该质粒在白色链霉菌 J1074(StreptomycesalbusJ1074)中进行异源表达,泰乐菌素的发酵产量达到 14.6 mg/L。此外,陈文青[30]利用红霉素抗性基因启动子permE在弗氏链霉菌中异源表达vhb基因,在5L发酵罐条件下研究发现,VHb蛋白的表达显著促进了泰乐菌素合成与菌体的生长,这种作用越是在限氧条件下,表现的越是明显。但是,在工业生产过程中,随着泰乐菌素产量的不断提高,部分泰乐菌素被还原为雷诺霉素(Relomycin)—— 一种严重影响泰乐菌素产品质量的副产物,Huang等[31]从弗氏链霉菌中纯化了该酶,并对其性质进行了初步研究,确定了泰乐菌素还原酶隶属于醛酮还原酶家族,朱慧等[32]的研究结果也证实了醛酮还原酶可催化还原泰乐菌素。
本研究成功构建了高产泰乐菌素的工程菌株,但对tylE、tylF以及tylCV基因的表达情况还需进一步研究,以更深入的了解弗氏链霉菌工程菌株的代谢途径。同时,在泰乐菌素的工业生产中,一方面可通过增加关键基因的拷贝数以提高泰乐菌素的产量,另一方面可通过抑制醛酮还原酶的活性以达到积累泰乐菌素的目的。
——一道江苏高考题的奥秘解读和拓展

