应用化学计量解决滴定实验中的实际问题
安金利 韩晓雨
(1.北京实验学校 2.北京师范大学附属中学平谷一分校)
回顾近年来全国各地高考题,化学计量的考查基本上是以物质的量为核心,将物质质量、气体体积、溶液浓度等物理量进行转化,以滴定实验为载体来确定各物质之间的量化关系.化学计量是化学实验过程中的一个必要环节,有着画龙点睛的作用.一般通过氧化还原滴定、酸碱中和滴定、沉淀滴定以及配位滴定的方法,一步或多步完成测定得到相关的数据.更为关键的是要应用化学计量关系对数据进行处理,得出正解.在解题过程中,学生要厘清实验思路,以物质的量为核心通过守恒法确定各物质之间的计量关系,再通过化学符号量化表达这种关系,得出待测物质的相关量.
1 常见滴定实验的计量关系
1.1 氧化还原滴定中的物料守恒法
氧化还原滴定是直接或间接利用已知氧化剂(或还原剂)的量来测定未知还原剂(或氧化剂)的方法.
例1(2019年北京卷,节选)化学小组用如下方法测定经处理后的废水中苯酚的含量(废水中不含干扰测定的物质).
Ⅰ.用已准确称量的KBrO3固体配制一定体积的amol·L-1KBrO3标准溶液;
Ⅱ.取V1mL上述溶液,加入过量KBr,加H2SO4酸化,溶液颜色呈棕黄色;
Ⅲ.向Ⅱ所得溶液中加入V2mL废水;
Ⅳ.向Ⅲ中加入过量KI;
V.用bmol·L-1Na2S2O3标准溶液滴定Ⅳ中溶液至浅黄色时,滴加2滴淀粉溶液,继续滴定至终点,共消耗Na2S2O3溶液V3mL.
已知:I2+2Na2S2O3=2NaI+Na2S4O6(Na2S2O3和Na2S4O6溶液颜色均为无色).
废水中苯酚的含量为_________g·L-1(苯酚摩尔质量:94g·mol-1).
解析由题意可知:n(BrO3-)=aV1×10-3mol.根据Ⅱ反应:BrO3-+5Br-+6H+=3Br2+3H2O 可得n(Br2)=3aV1×10-3mol.溴单质分别与苯酚和KI反应,首先确定与KI反应消耗的溴的量,设为n(Br2-KI).根据Br2+2I-=I2+2Br-,根据I2+2Na2S2O3=2NaI+Na2S4O6可 知:Br2~I2~2Na2S2O3,即

再确定与苯酚反应消耗的溴的量,设为n(Br2-苯酚).由反应
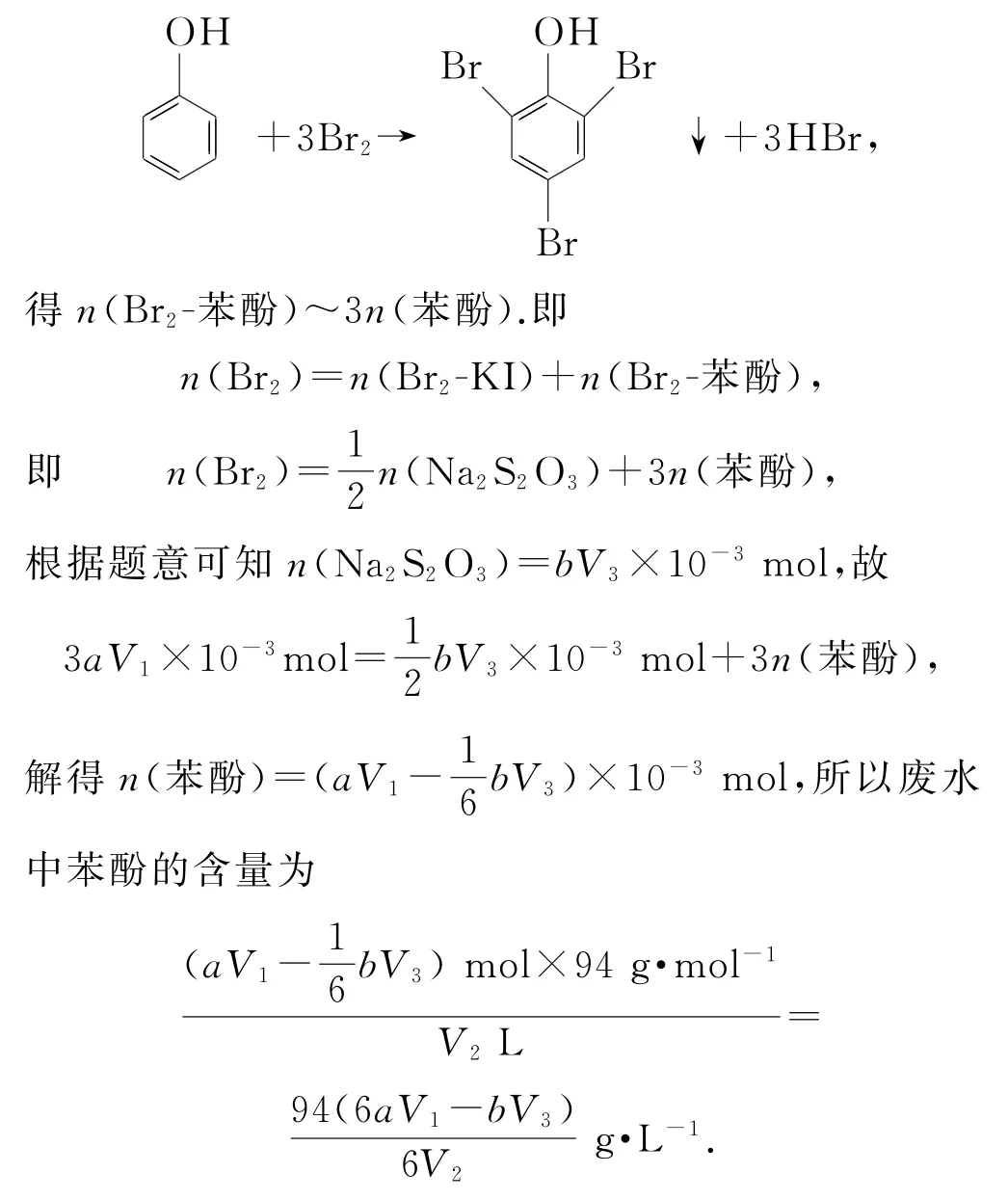
点评本题考查氧化还原反应滴定的综合运用.直接用溴滴定苯酚存在下列问题:1)反应快速灵敏,滴定终点难以判断;2)使用液溴或溴水很难确定溴单质的量.选择用一定量的KBrO3溶液与足量KBr溶液反应制得稀溴水,可以定量控制溴.制得的溴先后与苯酚和KI反应,再将溴与KI反应生成的I2与Na2S2O3进行滴定分析,巧妙地将滴定终点转化为碘与淀粉的反应,现象明显且便于控制.数据处理时,以溴为核心,利用化学反应中的计量数找出溴与苯酚及Na2S2O3的物质的量关系,列方程进行求解.
1.2 酸碱中和滴定中的物料守恒法
酸碱中和滴定是用已知物质的量浓度的酸(或碱)来测定未知物质的量浓度的碱(或酸)的方法.
例2(2017年北京卷,节选)SCR 和NSR 技术可有效降低柴油发动机在空气过量条件下的NOx排放.SCR(选择性催化还原)工作原理如图1所示.
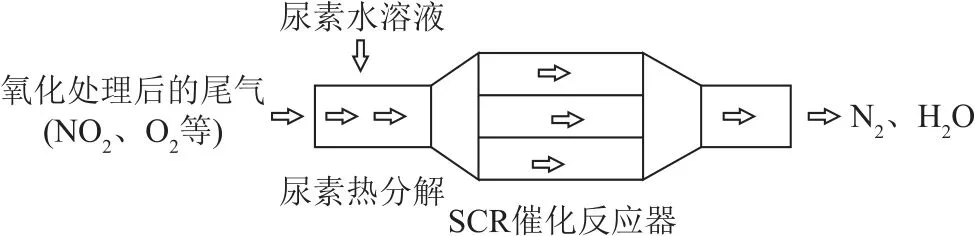
图1
尿素溶液浓度影响NO2的转化,测定溶液中尿素(M=60g·mol-1)含量的方法如下:取ag尿素溶液,将所含氮完全转化为NH3,所得NH3用过量的V1mLc1mol·L-1H2SO4溶液吸收完全,剩余H2SO4用V2mLc2mol·L-1NaOH 溶液恰好中和,则尿素溶液中溶质的质量分数是_________.
解析尿素[CO(NH2)2]中的N 元素完全转化为NH3,利用N 元素守恒可以得出n(尿素)=.H2SO4溶液发生2 个反应:①2NH3+H2SO4=(NH4)2SO4(为方便计算,假设生成正盐);②2NaOH+H2SO4=Na2SO4+2H2O.利用化学计量关系可得
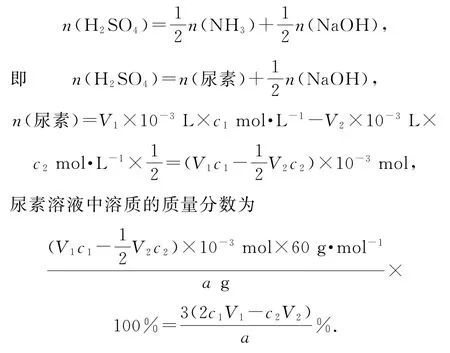
点评本题考查的重点除了酸碱中和滴定实验本身外,更在于守恒思想应用的考查.学生在通过守恒思想确定化学计量关系的过程中存在以下误区:1)容易忽略尿素和氨气1∶2的守恒关系.2)容易忽略计量单位的转换,尤其是毫升和升之间的转换.
1.3 沉淀滴定中的物料守恒法
沉淀滴定是以沉淀反应为基础的一种滴定方法,常用银量法对卤素进行滴定.
例3三氯化六氨合钴([Co(NH3)6]Cl3)是一种橙黄色晶体,实验室制备过程如下.
Ⅰ.将研细的6gCoCl2·6H2O 晶体和4gNH4Cl固体加入锥形瓶中,加水,加热溶解,冷却.
Ⅱ.加入13.5mL浓氨水,用活性炭作催化剂,混合均匀后逐滴滴加13.5mL5% H2O2溶液,水浴加热至50~60 ℃,保持20min.用冰浴冷却,过滤,得粗产品.
Ⅲ.将粗产品溶于50 mL 热的稀盐酸中,趁热过滤、冷却,向滤液中缓慢加入6.7 mL 浓盐酸,有大量橙黄色晶体析出,冰浴冷却后过滤.
Ⅳ.先用冷的2mol·L-1HCl溶液洗涤晶体,再用少许乙醇洗涤,干燥,得产品.
沉淀滴定法测定制备的产品中Cl-的质量分数:
ⅰ.准确称取agⅣ中的产品,配制成100mL溶液,移取25mL溶液于锥形瓶中.
ⅱ.滴加少量0.005mol·L-1K2CrO4溶液作为指示剂,用cmol·L-1AgNO3溶液滴定至终点.
ⅲ.平行测定3次,消耗AgNO3溶液的体积的平均值为VmL,计算晶体中Cl-的质量分数.
溶解度:AgCl为1.3×10-6mol·L-1,Ag2CrO4(砖红色)为6.5×10-5mol·L-1.
制备的晶体中Cl-的质量分数是________(列计算式,Cl的相对原子质量:35.5).
解析本题是对沉淀滴定过程中计量关系的考查,巧妙地利用相同c(Ag+)时溶解度小(或Ksp小)的物质先沉淀,溶解度大(或Ksp大)的物质后沉淀的原理来确定滴定终点.即有砖红色沉淀出现,且30s后不再变化.通过测定n(Ag+)来确定n(Cl-).很容易得出晶体中Cl-的质量分数为
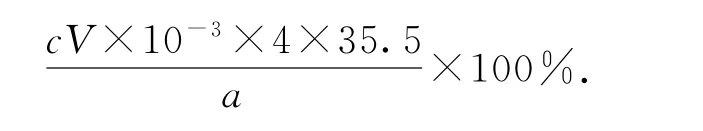
点评学生容易忽略从100mL 溶液中移取25mL溶液进行实验,因此在列计算式时,时常忘记4倍关系.
1.4 配位滴定中的物料守恒法
配位滴定是以配位反应为基础的一种滴定方法,水硬度的测定就利用了配位反应原理.
例4已知:工业中将含有较多钙、镁盐类的水称为硬水,水的总硬度是将水中Ca2+、Mg2+的总量折合成CaO 来计算的,每升水中含10 mgCaO 定为1度;铬黑T 混合指示剂指示的是Ca2+和Mg2+的混合滴定终点,钙指示剂指示的是Ca2+的滴定终点,即

Ⅰ.用移液管吸取水样50.00mL于250mL锥形瓶中,加5 mL pH =10 的缓冲溶液,再加少许(约0.1g)铬黑T 混合指示剂,用0.01 mol·L-1EDTA 标准溶液滴定至酒红色变为纯蓝色,记录EDTA 用量V1(25.00mL).
Ⅱ.另取50.00mL水样于250mL锥形瓶中,加入5mL10% NaOH 溶液摇匀,加入少许(约0.1g)钙指示剂,用0.01 mol·L-1EDTA 标准溶液滴定至酒红色变为纯蓝色,记录EDTA 用量V2(15.00mL).
则每升水样中含钙______mg;含镁______mg;水的总硬度是________度.
解析根据配位滴定公式中n(Ca2+)∶n(EDTA)=1 ∶1 和n(Mg2+)∶n(EDTA)=1∶1的物质的量关系,Ⅰ中测定的是50 mL水样中n(Ca2+)与n(Mg2+)的总和,即V1(25.00 mL)EDTA 标准溶液中的n(EDTA);Ⅱ中测定的是水样中的n(Ca2+),即V2(15.00 mL)EDTA 标准溶液中的n(EDTA);二者差值为n(Mg2+).因此

化学计量问题的解题模型可以总结如下:1)厘清实验方案;2)找到守恒关系;3)确定计量关系;4)代入数值计算.
2 学以致用
测定某品牌钙片中钙元素的质量分数.
任务1:阅读材料.
钙片中钙是以CaCO3的形式存在的,加工时将CaCO3研磨成极细的粉末,并辅以淀粉等材料(不含钙元素)混合均匀、压制、烘干成型.
①取两片钙片称重,记录钙片质量为mg,研细后放入锥形瓶中.
②记录酸式滴定管中HCl的读数,记为V1mL;向锥形瓶中加入过量的HCl标准液,不断搅拌至不再产生气体,记录滴加HCl标准液后的体积为V2mL,则V(HCl)=(V2-V1)mL.
③向②的锥形瓶中滴加几滴酚酞试液.记录碱式滴定管中NaOH 的读数,记为V3mL,再用NaOH 标准液进行滴定至刚好出现红色,且30s后不再褪色,达到滴定终点,记录滴加NaOH 标准液的体积为V4mL,则V(NaOH)=(V4-V3)mL.
任务2:厘清实验方案.
碳酸钙能与HCl发生反应:CaCO3+2HCl=CaCl2+CO2+H2O.过量的盐酸用标准NaOH 回滴,通过与CaCO3反应的标准HCl体积求得钙片中Ca元素的质量分数.
任务3:找到守恒关系.
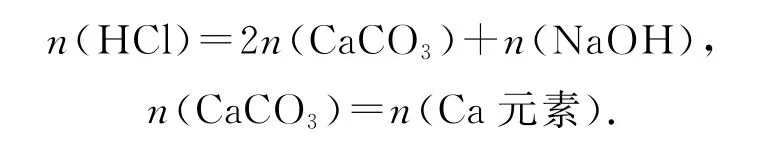
任务4:确定计量关系.
Ca元素的质量为[V(HCl)×10-3L×c(HCl)mol·L-1-V(NaOH)×10-3L×c(NaOH)mol·L-1]×40g·mol-1.
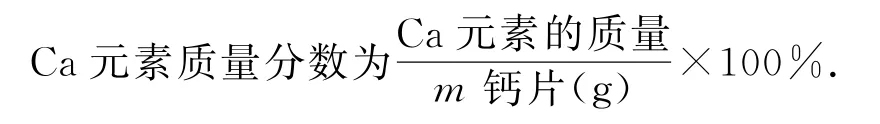
任务5:数据处理(如表1).

表1
总之,化学计量是学习化学和解决化学问题的一种重要手段,它需要学生快速厘清实验方案,熟练运用守恒方法,准确确定计量关系,精确运用化学符号表达化学实质,从而解决化学问题.
(完)

