离子方程式中常见错误类型分析
王子维
(甘肃省甘谷第一中学)
离子反应方程式能揭示化学反应的本质,不仅可以表示某个具体的反应也可以表示某一类反应,体现了“宏观辨识与微观探析”的化学学科核心素养,因此在高考中备受青睐.本文分析离子方程式中常见的错误类型,以期能引起重视.
1 真题再现
例下列反应的方程式书写正确的是( ).
A.(2021年广东卷)Na2O2放入水中:
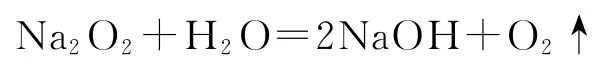
B.(2021年1月浙江卷)铜片上电镀银的总反应(银作阳极,硝酸银溶液作电镀液):

C.(2021年湖北卷)向次氯酸钙溶液中通入少量CO2气体:
D.(2021年1月浙江卷)明矾溶液中加入少量氢氧化钡溶液:2Al(OH)3↓+3BaSO4↓
分析Na2O2放入水中的化学方程式应该是:2Na2O2+2H2O=4NaOH+O2↑,选项A 中氧元素不守恒,错误.银作阳极,阳极的电极反应式为Age-=Ag+,铜片作阴极,阴极的电极反应式为Ag++e-=Ag,总反应为),选项B正确.向次氯酸钙溶液中通入少量的CO2,产物是CaCO3和HClO.离子方程式为Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO,选项C 错误.明矾溶液中加入少量Ba(OH)2溶液,参与反应的Ba2+与OH-物质的量之比为1∶2,生成的Al(OH)3与BaSO4沉淀物质的量之比为2∶3,离子方程式为3BaSO4↓,选项D 正确.答案为B、D.
2 离子方程式中常见错误类型例析
书写离子反应方程式时除了违背反应事实、拆分错误之外还有常见错误类型举例如下.
2.1 忽视连续反应的离子方程式
1)向次氯酸钙溶液通入少量SO2:
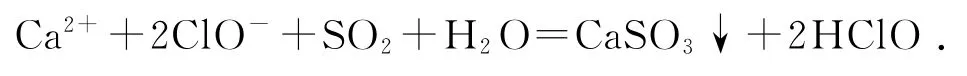
错因分析HClO 具有氧化性,与具有还原性的CaSO3能继续发生反应.
正确写法
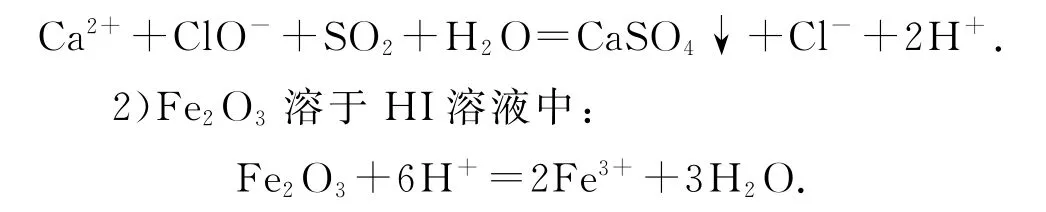
错因分析生成的Fe3+具有氧化性,与具有还原性的I-能继续发生反应.
正确写法

2.2 忽视守恒关系的离子方程式
1)酸性溶液中KIO3与KI反应生成I2:

错因分析原子守恒,但反应前后所带电荷数、得失电子不守恒.
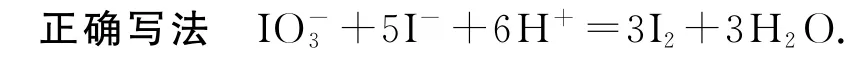
2)酸性KMnO4溶液与H2O2反应:

错因分析反应前后所带电荷数、原子守恒,但得失电子不守恒.
正确写法

2.3 忽视与量无关的离子方程式
1)向苯酚钠溶液中通入少量CO2:
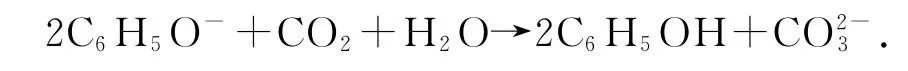
错因分析苯酚钠溶液与CO2反应只生成NaHCO3,与量无关.
正确写法
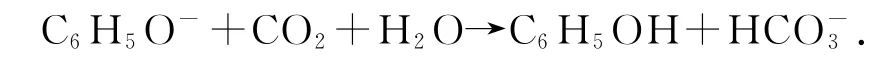
2)向Al2(SO4)3溶液中加入过量的NH3·H2O:

错因分析Al(OH)3不与弱碱继续反应,所以反应只生成Al(OH)3.
正确写法
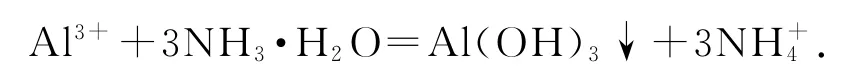
2.4 忽视溶液条件的离子方程式
1)NaClO 和NaCl混合溶液中滴入少量FeSO4溶液:
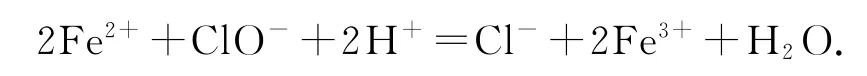
错因分析该溶液中NaClO 为强碱弱酸盐,故溶液呈碱性,离子方程式书写中不应该有H+.
正确写法
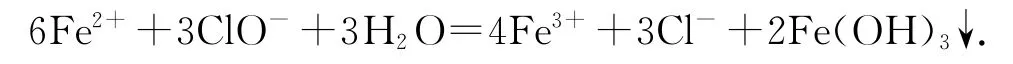
2)向酸性KMnO4溶液中通入SO2:
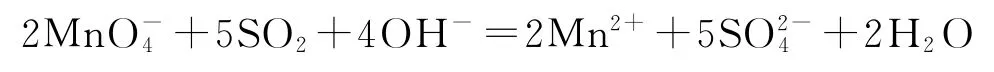
错因分析该溶液呈酸性,离子方程式书写中不应该有OH-.
正确写法
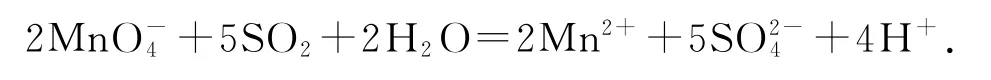
3)电解氯化镁溶液:
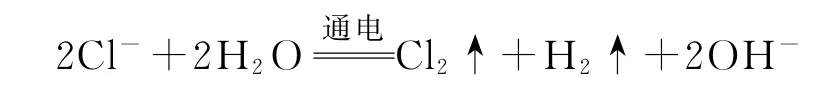
错因分析该溶液中含有Mg2+,生成的OH-与Mg2+结合产生Mg(OH)2沉淀.
正确写法

2.5 忽视电极类别的离子方程式
1)用铜作电极电解CuSO4溶液:
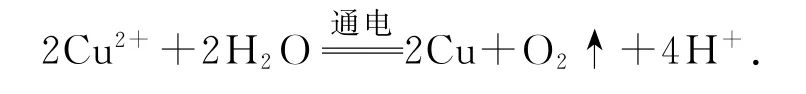
错因分析铜电极为活性电极,应优先于水放电,不会释放出氧气.

错因分析充电时为电解池装置,上述为放电时正极的反应.
正确写法
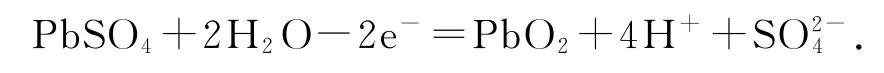
2.6 忽视水解、电离特点的离子方程式
1)Na2SO3溶液中的水解:
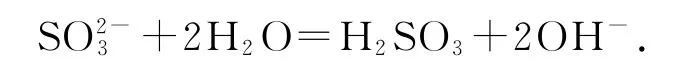
错因分析多元弱酸根离子如应分步水解,以第一步为主.
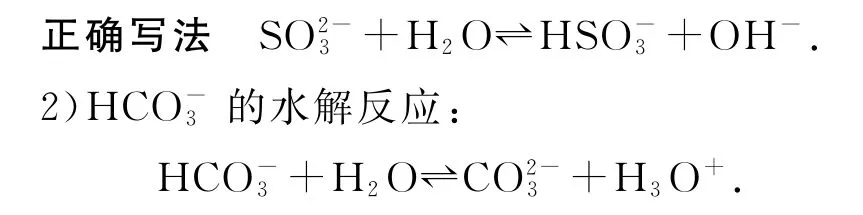
错因分析该离子方程式不是水解反应的离子方程式,而是HCO3-的电离方程式.
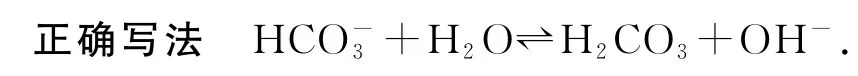
3)将饱和FeCl3溶液滴入沸水中制取Fe(OH)3胶体:Fe3++3H2O⇌Fe(OH)3↓+3H+.
错因分析水解一般是很微弱的,生成的Fe(OH)3量很少,以胶体形式存在而不是沉淀.
正确写法
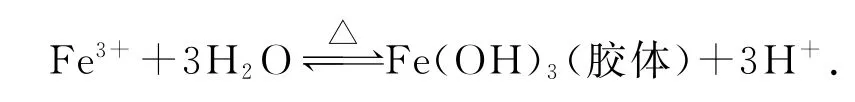
2.7 忽视反应本质的离子方程式
1)纯碱溶液和苯酚反应:
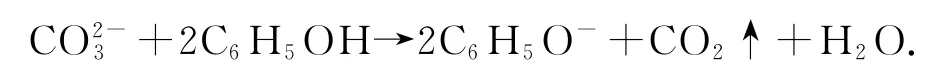
错因分析苯酚的酸性比碳酸弱,不能生成CO2,只能生成HCO3-.
正确写法
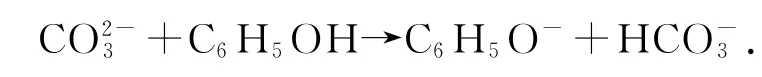
2)用稀硝酸清洗试管内壁的银镜:
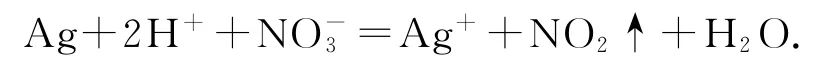
错因分析试管内壁的银与稀硝酸反应只能生成NO.
正确写法

2.8 忽视原始微粒个数比的离子方程式
1)FeBr2溶液中通入过量Cl2:
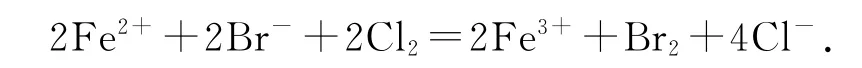
错因分析FeBr2溶液中Fe2+与Br-个数比为1∶2而且都参与了反应.
正确写法
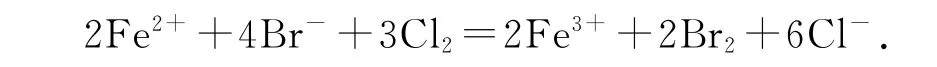
2)(NH4)2Fe(SO4)2溶液中加入过量的NaOH:

错因分析(NH4)2Fe(SO4)2溶液中与Fe2+个数比为2∶1而且都参与了反应.
正确写法
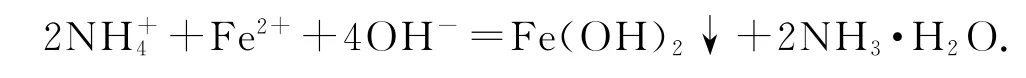
明晰离子方程式中常见错误类型,通过总结归纳、练习反馈,能提高解答该类试题的准确率.
(完)

