在备战高考中科学探究 在拓展建模中行成于思
——以关于元素周期律内容的高考化学题为例
李成宝
(山东省青岛西海岸新区胶南第一高级中学)
在近年来全国和各省市自主命题的高考化学试题中涉及元素周期律的相关试题是屡见不鲜的.这类试题多以元素的原子结构、元素的性质等形式呈现,考查证据推理与模型认知核心素养.
1 典例展示,挖掘高考命题的内涵
例一种麻醉剂的分子结构式如图1所示.其中,X 的原子核只有1 个质子;元素Y、Z、W 原子序数依次增大,且均位于X 的下一周期;元素E 的原子比W 原子多8个电子.下列说法不正确的是( ).
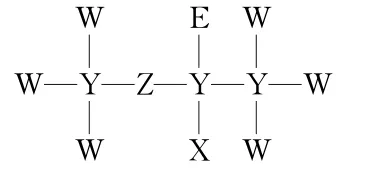
图1
A.XEZ4是一种强酸
B.非金属性:W>Z>Y
C.原子半径:Y>W>E
D.ZW2中,Z的化合价为+2价
试题赏析试题以“首尾相同”的分子结构式为载体将元素周期律问题展现给学生,是一种对化学模型的认知形式.问题情境中“X 的原子核只有1 个质子”有了从“1”开始的寓意.随之而来的问题探究,使得对元素在周期表中的位置和原子核外电子数的探究复杂化,让试题变得“扑朔迷离”起来,给学生一种新鲜感.探究以选择题的形式呈现,选择的答案在元素的性质、原子半径的比较和元素化合价的判断等方面,体现了结构决定性质的化学思想.
2 典例剖析,研究问题的切入点
典例选择的是一道广东省高考化学试卷中的选择题,从选项看,要求解决4个方面的问题,其设置的内容是对相关化学知识的高度综合.题干情境包括2个方面的内容,一是文字叙述,二是分子结构式的示意图,体现了“化零为整”的过程.解决问题的关键在于推断出5种对应的元素.由“结构”特征来体现“元素”,再由具体元素的特性判断试题的选项,是“结构决定性质、性质演绎化学原理”的映射.
解法探究结合题干文字叙述和分子结构示意图,分析各字母代表的相应元素结果如图2所示.
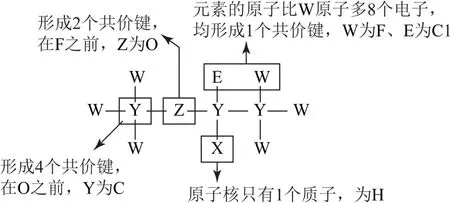
图2
根据分析可知XEZ4是HClO4,是一种强酸,选项A正确.W是F元素,Z和Y分别是O元素和C元素,因此可以得出选项B正确.原子半径可以根据“电子层数越多,原子半径越大”的规律判断,Cl原子比C和F 的原子核外多了一层电子,因此Cl原子的半径一定比F 原子的半径大,选项C 不正确.ZW2是OF2,F的非金属性强,故分子中O 元素的化合价为+2,选项D 正确.答案为C.
反思在解答题干有文字叙述和分子结构示意图的元素周期律类试题时,对分子结构模型的认知是核心(文字描述也不能忽略),推断出各字母代表的相应元素是前提,利用元素在周期表中的位置和元素具有的特性是突破选项问题的重要环节.笔者通过对典型例题的分析,让学生感悟元素(选择题一般考查短周期元素)在分子结构式中的成键特征,如表1所示.
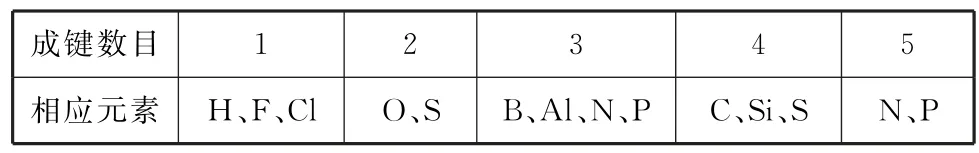
表1
3 变式演练,构建“元素周期律”问题的模型
2021年河北卷的第11题与典例具有异曲同工之妙,笔者认为在复习备考中不妨作为课堂变式练习,以达到引导学生对知识建模的目的.
变式1如图3所示的2种化合物可应用于阻燃材料和生物材料的合成.其中W、X、Y、Z为原子序数依次增大的短周期元素,X 和Z同主族,Y 原子序数为W 原子的价电子数的3 倍.下列说法中正确的是( ).
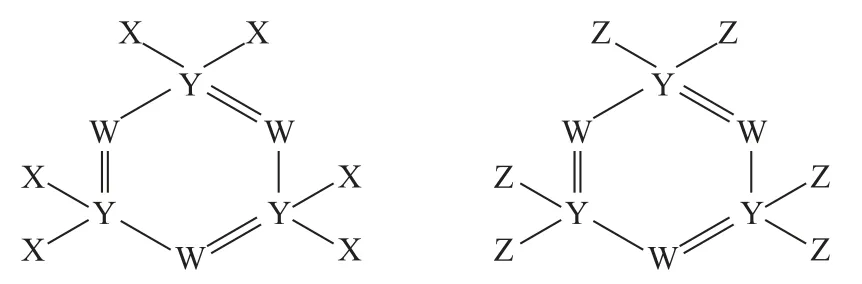
图3
A.X 和Z的最高化合价均为+7价
C.4 种元素中,Y 原子半径最大,X 原子半径最小
D.Z、W 和氢3种元素可形成同时含有离子键和共价键的化合物
创设目的与典例类型相似的试题在不同省市的高考化学卷中频繁出现,这说明了该类试题是高考的热点命题形式,用此题作为课堂变式练习可以引起学生的高度重视,也为这类试题解法建模营造了良好的环境.
解法分析解答本题时,学生仍然需要结合题干文字叙述信息和分子结构示意图进行分析.根据“X 和Z同主族”及分子结构示意图可知X 和Z 形成一价键,分别是F元素和Cl元素;Y 形成五价键(与典例分子结构式不同之处是本题出现了“双键”),是第ⅤA族元素,在F 与Cl之间,所以Y 是P元素.再结合文字描述“Y 原子序数为W 原子的价电子数的3倍”,故W 原子价电子数是5,为N 元素.推断出各字母代表的元素之后,再分析选项.F 没有正价,选项A 不正确.HF的水溶液为弱酸,排除选项B,选项C 与典例分析相同.N、P、H 3 种元素可形成磷酸铵盐,如NH4H2PO4是同时含有离子键和共价键的化合物,选项D 正确.答案为D.
反思1)在结构式中出现即双键,为二价键;在结构式中出现“≡”即三键,为三价键.2)必须将文字与结构式相结合,抛开其中一点就可能出现失误,如果只观察结构式,学生会因W 呈现三价键而可能误判为B 元素,导致不能辨析选项D 说法是否正确.
变式2如图4所示是一种可用于有机物的脱色和漂白等的物质的结构式,其中X、W、Y、M、Z 是短周期主族元素且原子序数依次增大,Y 与Z属于同一主族元素.下列说法错误的是( ).

图4
A.除W 外,其他4种元素简单离子半径比较,Z的最大、X 的最小
B.M、Z和Y3种元素形成的化合物中同种元素的原子间可以形成共价键
C.Y 的简单氢化物的沸点比W 的高
D.除X 以外,其他4 种元素在物质中均满足8电子稳定结构
创设目的与典例的不同之处是结构式是一种离子的形式,通过该变式的训练让学生对离子与结构的关系进行建模.
解法分析结合文字与结构式分析,“Y 与Z 属于同一主族元素”,在结构式中Y 呈现二价键、Z为四价键,故推断Y 是O 元素、Z是S元素,M 形成带1个单位正电荷的离子,原子序数在Y 和Z之间,故M 是Na元素;X、W 的原子序数在O 元素之前,X 呈一价键、W 呈四价键,故X 是H 元素、W 是C元素.然后对选项进行辨析不难得出本题答案为D.
反思 1)原子半径与离子半径大小是不同的,如O 原子核外电子比Na原子少一层,因此原子半径r(O)<r(Na);而O2-比Na+核电荷数少,电子构型相同,半径是前者大,r(O2-)>r(Na+).2)所谓的“满足8电子稳定结构”,不是指原子的价层电子对数为4,而是指原子的价层所有的电子.作为短周期主族元素,原子的价层所有的电子等于其主族数与价键数的和.例如,图4中Z(S元素)的“电子结构”是6+4=10,不满足8电子稳定结构.3)在图4结构式中Y 出现一价键和二价键,出现一价键的原因是Y 在带1个单位负电荷的阴离子团中得到1个电子,故从二价键变成一价键.
总之,高考化学试题中涉及元素周期律相关内容的命题是近年来的热点.因此,在备考阶段,教师可以将这类试题以例题引导和变式训练的形式展开,在不同的层面进行分析,从而达到解题建模的目的.
(完)

