不同粒径微塑料对剑尾鱼肠道结构及肠道微生物的影响
孙 平,杨兵坤,张彦坤,谢鹏飞,张春暖,徐世晓
(1.河南科技大学 动物科技学院,河南 洛阳 471023;2.中国科学院 西北高原生物研究所,青海 西宁 810008)
0 引言
塑料因其稳定的物理和化学性质在众多领域中得到广泛应用,其全球产量和使用量逐年增加,因其难以降解导致塑料垃圾在环境中大量积累[1]。随着时间的推移,塑料垃圾被分解成不同大小和形状的塑料碎片,其中粒径小于5 mm的塑料碎片称为微塑料[2](microplastics,MPs)。微塑料尺寸小、化学性质稳定,很难通过污水处理系统彻底清除,因此可能在水环境中广泛存在[3]。已有研究表明,悬浮于水环境中的微塑料可被浮游生物[4]、鱼类[5]、鸟类[6]和其他海洋类生物[7]等误食,这些被误食的微塑料大部分会随粪便直接排出体外,少部分滞留于消化道内[8],通过多种途径造成肠道组织病理学及功能学改变,影响肠道微生物稳态[9]。然而,关于不同粒径微塑料对淡水鱼类肠道毒性作用的影响还有待进一步探究。
肠道是抵御外源性物质的关键防线,也是动物消化、吸收和免疫的重要器官[10]。到目前为止,越来越多的证据表明在生物体内参与微塑料消化的酶的数量有限,这也意味着机体所摄入的微塑料会在肠道中长期存在而难以消化[11]。剑尾鱼是一种小型热带淡水鱼类,也是中国首个通过审定的淡水鱼类实验动物[12]。其体型小、易饲养、繁殖力强、繁殖周期短、对多种重金属毒物较敏感,且剑尾鱼在体型和第二性征等形态特征方面存在明显性别差异[12],可广泛应用于水环境监测、水产药物安全性评价、化学用品毒性检测、动物疾病检验模型及遗传生物学等研究领域[13]。
据报道,微塑料颗粒的大小是影响其生物毒性的重要因素[14],如斑马鱼(Daniorerio)在0.5 μm微塑料环境中较在50 μm微塑料环境中的毒性效应更严重[15],证实微塑料毒性存在尺寸依赖。而且最近许多研究提出了微塑料颗粒暴露后,肠道微生物菌群改变与肠道毒性之间存在一定的关联。如文献[16]将鲫鱼(Carassius)暴露于聚苯乙烯微塑料环境30 d后,肠道微生物组成中厚壁菌门丰度增加,拟杆菌门丰度减少,且Alpha多样性指数显著增加。将金头鲷(Sparusaurata)暴露于聚苯乙烯微塑料30 d后,通过组织病理学分析发现其肠上皮出现出血、坏死现象并伴随有严重的肠上皮空泡化,而肠道微生物丰富度、多样性没有显著差异,仅物种组成差异分析中存在变化,文献[17]推测微生物组成变化旨在抵消摄入微塑料而造成的机械损伤。因此,本文推测在剑尾鱼肠道中的不同粒径微塑料也会不同程度引起其肠道损伤,包括组织损伤和肠道微生物菌群变化等。本研究将淡水鱼类剑尾鱼暴露于1×107microspheres·L-1的微塑料水环境中72 h[19],通过组织病理学和16S核糖体核糖核酸(ribosomal ribonucleic acid,rRNA)测序,探究不同粒径微塑料对剑尾鱼肠道组织结构及肠道菌群的影响,以期为微塑料对淡水鱼类的毒理效应影响提供数据支持,也为生产中更好地监控微塑料污染提供一定的技术参考。
1 材料与方法
1.1 试验材料与试验用鱼
本试验中使用到的微塑料为球形单分散绿色荧光微塑料颗粒(粒径分别为1 μm和5 μm),购自于天津倍思乐技术开发中心。微塑料基质为聚苯乙烯塑料,可以均匀分散于水中。最大激发波长为470 nm,最大发射波长为526 nm。微塑料粒径分布是通过Multisizer 4e库尔特计数及粒度分析仪按照库尔特原理方法进行检测的。
试验所用到的5月龄雄性剑尾鱼(体长为(5.56±0.55) cm,体质量为(1.63±0.29) g)购买自陕西红剑尾鱼养殖基地,所有鱼均为红眼红体。选择雄性剑尾鱼开展试验的原因是剑尾鱼属胎鳉科、卵胎生鱼类,仔鱼自母体产出后即可自由生活。一般4月龄左右出现追逐、嬉戏等性行为,5月龄左右可以产出仔鱼,为避免雌鱼在试验过程中造成影响,故选用雄鱼。依据GB/T 39649—2020《实验动物 实验鱼质量控制》中试验动物饲养条件,在试验室暂养14 d后选择健康状况良好、生长指标相近的个体开展受控试验。试验动物暂养及试验过程中保持水环境温度为(27±1) ℃(pH7.4±0.2),光周期14 h L∶10 h D。其中,饲养过程中水体经过24 h曝气及活性炭处理(氧溶解度≥5.7 mg/L)。投喂的饲料购买自深圳寸金观赏鱼饲料有限公司,暂养及试验过程中每天8:00和17:00分别投喂1次,饲料投喂量为剑尾鱼体质量的3%。
1.2 试验设计
试验分为3组:M0组(对照组)、M1组(1 μm、1×107microspheres·L-1)和M2组(5 μm、1×107microspheres·L-1)(见表1),每组3个重复,每个重复10尾鱼,共90尾鱼。文献[20]研究表明,直径小于5 μm的微塑料颗粒会进入细胞内,通过循环系统到达机体各个组织器官,故本试验选用1 μm和5 μm粒径微塑料颗粒。此外,文献[21]提出水环境中的微塑料含量可达到1×106microspheres·L-1,本试验选择1×107microspheres·L-1以期预测当水环境中微塑料含量升高后会对水生生物造成的影响。暴露于微塑料环境中72 h后,用MS-222(Sigma,10 mg/L)对试验鱼进行麻醉,每个重复中各随机取6尾鱼,即每个处理组18尾鱼,用75%(体积分数,下同)乙醇擦拭肠道外壁,用镊子去除附着于表面的脂肪,用生理盐水漂洗3次,取3尾鱼的肠道作为1个样本量,即每个处理组中6个样本,将各个样本装入提前编号并已灭菌的EP管中,迅速放进液氮罐,用于肠道微生物的检测。从每组中取出剩余的4尾鱼(试验过程中并未出现死亡个体),用75%乙醇擦拭肠道外壁,置于解剖盘中摆成Z字型,截取1 cm左右的中肠,用镊子去除肠道组织表面的脂肪及肠道内容物后放入提前编号装有通用型固定液的EP管中保存,用于制作组织切片。

表1 不同处理组中微塑料暴露粒径及含量
1.3 指标测定与数据处理
肠道组织切片采用石蜡包埋,苏木精-伊红染色法(Hematoxylin-Eosin staining,HE)染色,切片制作完成后应用显微镜(OLYMPUS CX31)拍照,并通过Biolife Std显微图像分析软件测量肠绒毛长度、隐窝深度、绒隐比(绒毛长度与隐窝深度的比值)、肌层厚度、杯状细胞数量。采用SPSS 20软件进行单因素方差分析(One-way ANOVA),试验结果以平均值±标准差表示,以P<0.05表示差异显著。
肠道微生物采用16S核糖体核糖核酸(ribosomal ribonucleic acid,rRNA)测序分析,主要包括基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)抽提、聚合酶链式反应(polymerase chain reaction,PCR)扩增、文库构建及上机测序和数据分析4部分。其中,数据处理是将原始PE reads通过质控、拼接、去除嵌合体,最终得到序列用于运算分类单元(operational taxonomic unit,OTU)分析,基于操作分类单位OUT聚类分析结果得出Alpha多样性、Bata多样性、物种组成及差异分析数据。
2 结果组织形态
2.1 不同粒径微塑料对剑尾鱼肠道组织形态和结构的影响
微塑料对剑尾鱼肠道组织形态和结构的影响分别见图1和表2。由图1和表2可知:与对照组相比,试验组中肠道组织形态均发生变化,1 μm粒径组中绒毛长度、隐窝深度、绒隐比、肌层厚度、杯状细胞数量均显著降低(P<0.05)。5 μm粒径组中绒毛长度和杯状细胞数量降低,隐窝深度、绒隐比和肌层厚度显著升高(P<0.05)。两试验组之间进行对比,1 μm粒径组中绒毛长度、隐窝深度、肌层厚度显著低于5 μm粒径组(P<0.05),绒隐比和杯状细胞数量高于5 μm粒径组。
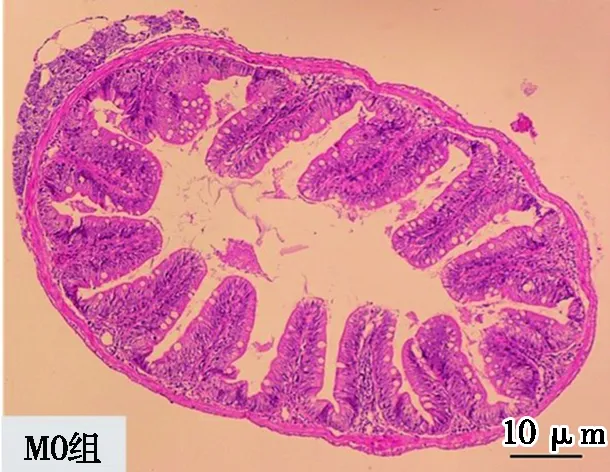
(a) 对照组中剑尾鱼肠道10×10倍显微图像

表2 微塑料对剑尾鱼肠道结构的影响
2.2 不同粒径微塑料对剑尾鱼肠道微生物的影响
2.2.1 16S rRNA基因测序结果
Alpha多样性分析测序3组样品共产生138 039条优化序列,各组分别为44 354条(对照组)、45 302条(1 μm粒径组)和48 383条(5 μm粒径组),对数据进行均一化处理后,3组样品总序列均值为46 013。运用Usearch进行聚类划分可操作分类单元(OTU),3组共有702个OTUs。对照组OTUs为228个,1 μm粒径组OTUs为244个,5 μm粒径组的OTUs为230个,1 μm粒径组和5 μm粒径组OTUs均高于对照组。以各样品中分布的OTUs为计算依据,用MOTHUR软件中的venn命令对各样品中菌群的多样性进行分析并构建图。微塑料对剑尾鱼肠道菌群Alpha多样性指数的影响见表3。由表3可知:3组共有445个OTUs,其中199个共同的OTUs,占三者总数的44.72%;1 μm粒径组与对照组共有238个OTUs,占两者OTUs总数的88.15%;5 μm粒径组与对照组共有244个OTUs,占两者OTUs总数的58.37%;1 μm粒径组与5 μm粒径组共有229个OTUs,占两者OTUs总数的55.18%。每组覆盖度均≥99.93%,表明各样品中的微生物种类已基本覆盖完全。1 μm粒径组和5 μm粒径组香农指数(Shannon)低于对照组,表明不同粒径微塑料均降低了剑尾鱼肠道微生物群落多样性。
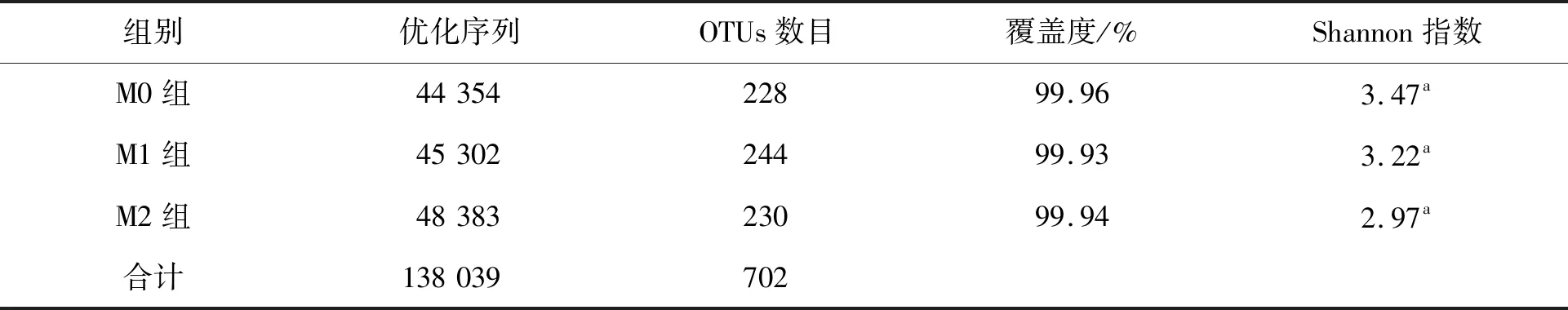
表3 微塑料对剑尾鱼肠道菌群Alpha多样性指数的影响
2.2.2 各分组在门水平上的差异
在门水平上进行物种注释分析,将每个OTUs中丰度排列前5的序列作为代表序列进行统计分析,各组样本中主要微生物菌群为变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)、疣微菌门(Verrucomicrobia)和拟杆菌门(Bacteroidetes)(见图2)。与对照组相比,1 μm粒径组肠道微生物中变形菌门和疣微菌门丰度降低,放线菌门和拟杆菌门丰度增加;5 μm粒径组肠道微生物中变形菌门和疣微菌门丰度增加,厚壁菌门、放线菌门和拟杆菌门丰度降低。1 μm粒径组与5 μm粒径组相比,1 μm粒径组变形菌门和疣微菌门丰度显著低于5 μm粒径组,厚壁菌门、放线菌门和拟杆菌门丰度显著高于5 μm粒径组(见表4)。
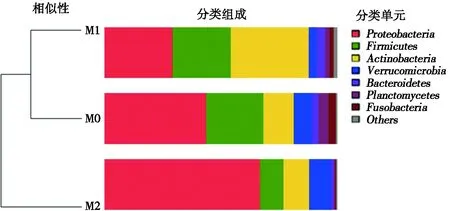
图2 门水平上的微生物群落

表4 微塑料对剑尾鱼肠道菌群排名前5的菌门比例的影响 %
2.2.3 各分组在属水平上的差异
在属水平上进行物种注释分析,将每个OTUs中丰度排列前5的序列作为代表序列进行统计分析,各组样本中主要微生物菌群为韦荣球菌属(Veillonella)、Reyranella、戈登氏菌属(Gordonia)、MNG7_norank和鲸杆菌属(Gemmobacter)(见图3)。与对照组相比,1 μm粒径组肠道微生物中韦荣球菌属、Reyranella、戈登氏菌属(Gordonia)和MNG7_norank丰度增加,鲸杆菌属丰度降低;5 μm粒径组肠道微生物中Reyranella和戈登氏菌属丰度增加,韦荣球菌属、MNG7_norank和鲸杆菌属丰度降低(见表5)。1 μm粒径组与5 μm粒径组相比,1 μm粒径组韦荣球菌属和戈登氏菌属丰度显著高于5 μm粒径组,Reyranella、MNG7_norank和鲸杆菌属丰度显著低于5 μm粒径组。

图3 属水平上的微生物群落

表5 微塑料对剑尾鱼肠道菌群排名前5的菌属比例的影响 %
3 讨论
3.1 微塑料对剑尾鱼肠道组织结构的影响
肠道是吸收营养物质的重要场所,其中肠道绒毛的形态结构决定了其对营养物质的消化吸收能力[22],肠道绒毛的形态结构主要包括绒毛长度、隐窝深度和绒隐比等[23]。本研究中,与对照组相比,暴露组中绒毛长度、绒隐比和杯状细胞数量均显著降低(P<0.05),其中,5 μm粒径组中隐窝深度显著高于对照组和1 μm粒径组。绒毛长度的降低意味着肠道的吸收面积减少,机体的营养物质供应减少[24],而隐窝深度的增加则会减弱肠道对营养物质的吸收能力。也就是说,不同粒径微塑料暴露均可能引起剑尾鱼的能量供应不足,其中,5 μm粒径组的影响效应更大。相关研究表明,将斑马鱼(Daniorerio)暴露于5 μm和20 μm的聚苯乙烯微塑料7 d后,与对照组相比,67%的个体肠道组织中出现绒毛缩短肿胀、肠细胞空泡化等[25]现象。此外,研究发现黑鲫(Carassiuscarassius)间接摄食24 nm聚苯乙烯微塑料后,50%的个体肠道出现损伤,表现为肌层厚度增加、绒毛顶部杯状细胞数量减少等[26]。其中杯状细胞数量减少,表明肠黏液分泌减少,机体免疫力下降,与本研究结果基本一致。也有相关学者指出,将欧洲黑鲈(Dicentrarchuslabrax)暴露于3 mm聚氯乙烯微塑料环境中90 d后,与对照组相比,试验组中肠道组织严重损伤,表现为浆膜层和黏膜肌层呈水肿状,血管扩张明显,白细胞浸润等[27]。此外,将金鱼(Carassiusauratus)暴露于0.7 mm纤维塑料环境中6周后,其肠上皮细胞分裂严重[28]。本研究中未发现肠道肌层水肿和肠细胞分裂现象,推测可能是微塑料暴露时间较短[29],后期可设置不同的急性、亚慢性、慢性暴露试验以验证不同暴露时间对剑尾鱼肠道组织结构的影响。
3.2 在门水平上,微塑料对剑尾鱼肠道微生物的影响
肠道微生物群是肠道的重要组成部分[30],主要参与宿主的食物摄取、能量代谢和免疫调控等[31],在促进肠道发育、抵抗病原入侵、调节机体能量吸收和维持肠道健康的过程中均发挥着极其重要的作用[32]。本研究中,与对照组相比,1 μm粒径组与5 μm粒径组中香农指数均降低,其中5 μm粒径组香农指数低于1 μm粒径组,但差异不显著。香农指数常用于反映肠道微生物Alpha多样性,香农指数越小,说明微生物群落多样性越低。也就是说,1 μm粒径组与5 μm粒径组中微生物群落多样性均降低,且5 μm粒径组较1 μm粒径组降低更多。由于肠道微生物的敏感性,肠道微生物稳态已成为新的环境毒理学指标[33]。如变形菌门丰度增加时可以引起机体免疫失调,诱发炎症反应[34]。拟杆菌门丰度增加时,会降解纤维素、多糖、蛋白质等[35],厚壁菌门则与生物体的能量代谢、糖代谢和脂质代谢密切相关[36]。本研究中,在门的水平上,与对照组相比,1 μm粒径组的放线菌门和拟杆菌门丰度显著增加,推测微塑料可能会导致微生物种群失衡,影响细菌的物质代谢。这一结果与先前关于斑马鱼的研究结果基本一致,研究发现,将斑马鱼暴露于5 μm和50 μm的聚苯乙烯微塑料环境7 d后,肠道微生物群发生显著变化,其中5 μm和50 μm粒径组中放线菌门和拟杆菌门丰度增加,影响能量代谢,干扰机体生长发育[37]。本研究中,与对照组相比,5 μm粒径组的变形菌门和疣微菌门丰度显著增加。这与文献[38]的研究结果基本相似,将盐水虾(Artemiaparthenogenetica)暴露于30 μm聚苯乙烯微塑料环境中24 d后,变形菌门丰度明显增加,机体生长速度减缓。将斑马鱼(Daniorerio)暴露于8 μm微塑料环境中21 d后,发现疣微菌门相对丰度增加,诱发肠道菌群失调和免疫反应[39]。类似地,文献[11]将成年雄性斑马鱼暴露于0.5 μm和50 μm聚苯乙烯微塑料环境中14 d后,发现50 μm粒径组与0.5 μm粒径组相比,厚壁菌门的丰度显著增加,而变形菌门、拟杆菌门和放线菌门丰度显著下降,表明聚苯乙烯微塑料暴露可能通过改变肠道菌群进而影响机体健康,微塑料暴露粒径越大,毒性效应越强。本研究中,1 μm粒径组与5 μm粒径组相比,5 μm厚壁菌门丰度显著低于1 μm,厚壁菌门丰度降低意味着营养物质吸收能力减弱,由此推测5 μm粒径组比1 μm粒径组毒性效应影响更大,但也有相关学者指出,将贻贝(Mytiluscoruscus)暴露于10 μm微塑料环境21 d后,其肠道微生物群落和丰度并无显著变化,表明微塑料对肠道微生物的影响可能存在物种差异性[40]。
3.3 在属水平上,微塑料对剑尾鱼肠道微生物的影响
在属水平上,主要微生物菌群有韦荣球菌属(Veillonella)、Reyranella、戈登氏菌属(Gordonia)、MNG7_norank和鲸杆菌属(Gemmobacter)。韦荣球菌属是革兰氏阴性厌氧菌,是分布在口腔、咽部和肠道中的正常菌群,常用于发酵丙酮酸、乳酸、苹果酸和草酸等有机物[41]。Reyranella是革兰氏阴性需氧菌,是可分解营养物质的正常菌群[42]。戈登氏菌属是一类好氧生长、不游动、轻度抗酸的革兰氏阳性菌,是一种致病菌,可引起多种疾病,尤其是呼吸道相关疾病[43]。鲸杆菌属则可以促进多态水化合物的分解,产生维生素B12[44]。本研究中,在属水平上,与对照组相比,1 μm粒径组中鲸杆菌属丰度降低,5 μm粒径组中韦荣球菌属丰度显著降低,表明微塑料暴露后均会改变剑尾鱼肠道微生物菌群丰度,导致微生物群落有益菌丰度相对降低。相关研究表明,将斑马鱼暴露于5 μm和50 μm聚苯乙烯微塑料环境中,发现两种不同粒径的微塑料暴露后,斑马鱼幼鱼菌群组成在属水平上均发生了变化。其中,与对照组和5 μm粒径组相比,50 μm粒径组中Erysipelotrichaceae菌属的相对丰度显著下降[45],与本试验结果基本一致。本研究中,5 μm粒径组韦荣球菌属丰度显著低于1 μm粒径组,可能是5 μm粒径组肠道损伤程度较1 μm粒径组更严重,导致正常菌群丰度显著减少。
4 结束语
肠道健康对动物机体至关重要,肠道组织完整性是环境-有机体联系的关键组成部分,在营养运输、渗透调节等方面发挥着重要的作用,而肠道微生物多样性及组成是环境-有机体联系的另一个重要组成部分,它有助于维持宿主健康的营养吸收和能量代谢,两者共同维持生态体肠道生态平衡[13]。总之,在本研究中,1 μm粒径组和5 μm粒径组的肠道组织均出现损伤,肠道微生物多样性及组成均发生变化,其中,5 μm粒径组的肠道组织损伤程度和肠道微生物群结构与丰度变化程度均高于1 μm粒径组。推测微塑料毒性存在尺寸依赖,粒径越大,毒性效应越大。但是不同暴露时间、不同粒径、不同浓度所造成的毒性影响均不同,因此需要开展更多相关研究以积累微塑料对生物体的功能性和稳定性造成的危害。此外,后期研究中有必要深入进行剑尾鱼的组织、细胞和基因水平的试验,以期为生产中更好地监控微塑料污染提供一定的数据参考。

